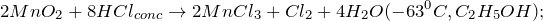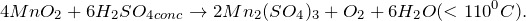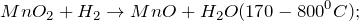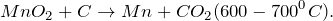Гидролиз нитрита натрия
Общие сведения о гидролизе нитрита натрия
В сухом состоянии устойчив на воздухе, во влажном – окисляется кислородом воздуха. На свету частично разлагается и желтеет. Брутто-формула – NaNO2. Молярная масса нитрита натрия равна 69,00 г/моль.
Рис. 1. Нитрит натрия. Внешний вид.
Хорошо растворяется в воде (гидролизуется по аниону). Кристаллогидратов не образует. В ОВР может проявлять как окислительные, так и восстановительные свойства.
Гидролиз нитрита натрия
Нитрит натрия представляет собой среднюю соль, образованную слабой кислотой – азотистой (HNO2) и сильным основанием – гидроксидом натрия (NaOH):
Подвергается гидролизу по аниону. Характер среды водного раствора нитрита натрия – щелочной. Уравнение гидролиза будет выглядеть следующим образом:
Na + + NO2 — + H2O ↔ HNO2 + Na + + OH — (полное ионное уравнение);
NO2 — + H2O ↔ HNO2 + OH — (сокращенное ионное уравнение);
NaNO2+ H2O ↔ HNO2 + NaOH (молекулярное уравнение).
Примеры решения задач
| Задание | Какие из перечисленных солей будут подвергаться гидролизу: а) KBr; б) Na2S; в) KNO3; г)Cu(NO3)2? Ответ поясните. |
| Решение | Гидролизу подвергаются соли, в составе которых присутствует «слабый ион», те. Они должны быть образованы слабой кислотой и сильным основанием, сильной кислотой и слабым основанием или слабой кислотой и слабым основанием. Для того, чтобы дать верный ответ на поставленный вопрос рассмотрим более конкретно каждое из указанных выше соединений. |
а) бромид калия представляет собой соль, образованную слабой кислотой (бромоводородной) и сильным основанием (гидроксидом калия):
б) сульфид натрия представляет собой соль, образованную слабой кислотой (сероводородной) и сильным основанием (гидроксидом натрия):
в) нитрат калия представляет собой соль, образованную сильной кислотой (азотной) и сильным основанием (гидроксидом калия):
Гидролизу не подвергается.
г) нитрат меди (II) представляет собой соль, образованную сильной кислотой (азотной) и слабым основанием (гидроксидом меди (II) ):
| Задание | Установите соответствие между формулой соли и её отношением к гидролизу: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ответ | Соль силикат магния (MgSiO3) подвергается гидролизу по аниону, поскольку образована сильным основанием –гидроксидом магния и слабой кислотой – кремниевой (4). Соль хлорид серебра (AgCl)подвергается гидролизу по катиону, поскольку образована слабым основанием –гидроксидом серебра (I) и сильной кислотой – хлороводородной (соляной) (2). Соль нитрат цинка (Zn(NO3)2) подвергается гидролизу по катиону, поскольку образована слабым основанием –гидроксидом цинка и сильной кислотой – азотной (2). Соль перхлорат алюминия (Al(ClO4)3) подвергается подвергается гидролизу по катиону, поскольку образована слабым основанием –гидроксидом алюминия и сильной кислотой – хлорной (2). Источник NaNO2 + KMnO4 + H2O = ? уравнение реакцииПодскажите, какое вещество образуется в результате окисления нитрита натрия перманганатом калия в нейтральной среде (NaNO2 + KMnO4 + H2O = ?). Приведите основные физические параметры твердого продукта реакции, расскажите о химических свойствах и его способах получения. При окислении нитрита натрия перманганатом калия в нейтральной среде (NaNO2 + KMnO4 + H2O = ?) происходит образование средней соли нитрата натрия, гидроксида калия, а также выпадение осадка черного цвета – диоксида марганца. Молекулярное уравнение реакции имеет вид: Оксид марганца (IV) представляет собой твердое вещество черного цвета с коричневым оттенком, кристаллы которого при нагревании разлагаются. Не реагирует с водой. Из раствора осаждается в виде гидрата состава Проявляет окислительно-восстановительные свойства: В промышленных масштабах диоксид марганца получают из природного минерала пиролюзита. Источник AcetylЭто пилотный ролик из серии об органических реакциях. Наведите курсор на ячейку элемента, чтобы получить его краткое описание. Чтобы получить подробное описание элемента, кликните по его названию.
|


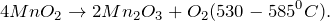
 . Переводится в раствор действием концентрированных кислот:
. Переводится в раствор действием концентрированных кислот: