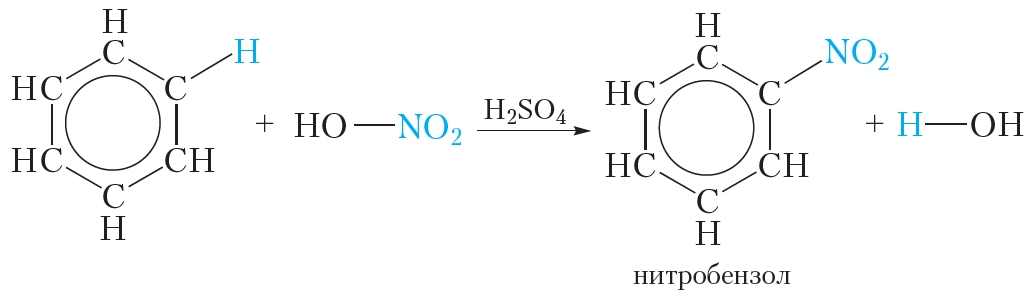§ 15. Ароматические углеводороды. Бензол

Что вы знаете о бензоле?
Название «ароматические соединения» возникло давно, на ранних этапах развития органической химии. К ним относили соединения, получающиеся из природных смол, эфирных масел, бальзамов, обладающих приятным запахом. Впоследствии оказалось, что существует ещё много веществ, которые по строению и химическим свойствам схожи с ароматическими соединениями, но не имеют приятного запаха. Однако исторически сложившееся название так и осталось.
Большинство ароматических углеводородов опасны для жизни человека, они токсичны, и работа с ними требует строгого соблюдения мер безопасности. Так, бензол является ядовитым веществом, действует на почки, при длительном контакте изменяет формулу крови, может нарушать структуру хромосом. Бензол — типичный и простейший представитель ароматических углеводородов.
Строение бензола
Молекулярная формула бензола С6Н6. Очевидно, что это ненасыщенный углеводород — не хватает восьми атомов водорода до полного насыщения — С6Н14. Для ненасыщенных углеводородов характерно обесцвечивание раствора перманганата калия и бромной воды. Проверим это на опыте с бензолом.

Проблема. Почему бензол не обесцвечивает бромную воду и раствор КМnO4? Какие можно сделать предположения о строении бензола?
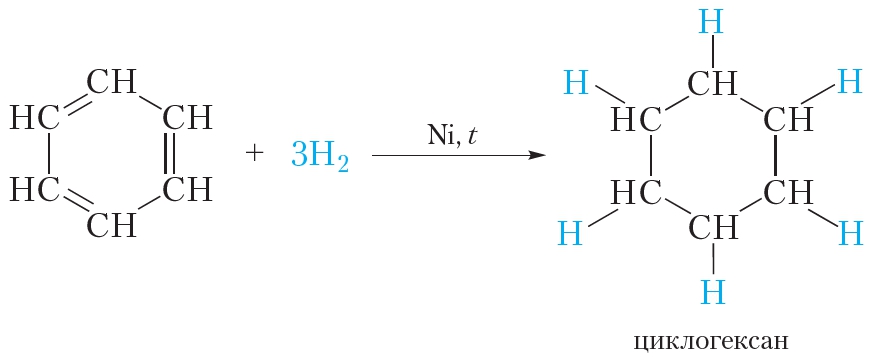
Опыт позволяет предположить, что бензол не образует прямую или разветвлённую цепь, в которой находятся двойные или тройные связи. Это же самое доказывает и реакция гидрирования бензола. Экспериментально также установлено, что молекула бензола (1 моль) присоединяет только три молекулы водорода (3 моль), в результате чего получается циклическое соединение — циклогексан:
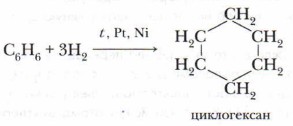
Из этого следует, что бензол — углеводород циклического строения.
Значительно позже русским учёным Н.Д. Зелинским была проведена обратная реакция — каталитическое дегидрирование циклогексана. В результате этой реакции был получен бензол:
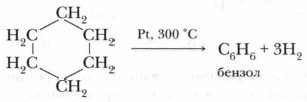
Немецкий химик Ф.А. Кекуле в 1865 г. высказал предположение о циклическом строении бензола с чередованием простых (одинарных) и двойных (кратных) связей и предложил выразить это структурной формулой следующим образом (1, 2):
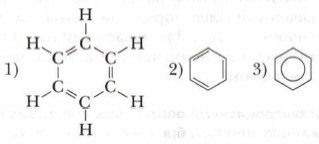
В современной химии наряду с традиционными формулами Кекуле часто пользуются структурной формулой бензола, в которой акцент сделан на бензольное кольцо (3).

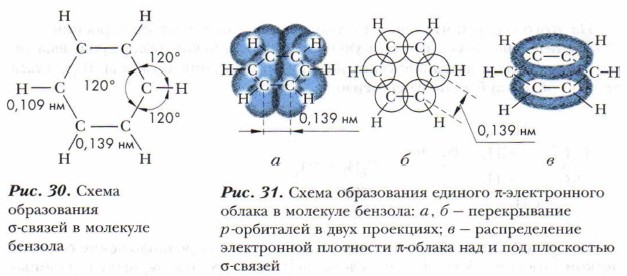
Все атомы углерода в молекуле бензола находятся в sh 2 -гибридном состоянии. Каждый атом углерода образует три σ-связи: с двумя соседними атомами углерода и одним атомом водорода. Эти связи лежат в одной плоскости, и углы между ними равны 120° (рис. 30). Таким образом, шесть атомов углерода образуют правильный шестиугольник. Кроме того, каждый атом углерода имеет одну негибридную 2p-орбиталь, на которой находится один электрон.
Негибридная р-электронная орбиталь каждого атома углерода перекрывается рядом находящимися негибридными р-электронными облаками слева и справа, образуется единое π-электронное облако, состоящее из шести электронов. Электронная плотность в нём распределена равномерно (рис. 31). Все связи между атомами углерода одинаковые. Перекрывание происходит над и под плоскостью σ-связей. С подобным явлением вы уже знакомились при изучении диеновых углеводородов, содержащих сопряжённые двойные связи (см. § 13).
Исследования показали, что в бензоле нет простых и двойных связей, под влиянием π-электронного облака ядра атомов углерода сближаются, и расстояние между центрами соседних атомов углерода сокращается и становится одинаковым — 0,139 нм. Вспомним, что длина одинарной связи С—С равна 0,154 нм, а двойной связи С=С — 0,134 нм.
В настоящее время используют следующие современные структурные формулы молекулы бензола:
Чаще всего пользуются формулой в виде правильного шестиугольника с окружностью в цикле.
Электронное строение бензола объясняет загадки молекул бензола:
- благодаря сопряжению электронная плотность в бензольном кольце выравнивается, расстояния между атомами углерода одинаковые;
- благодаря сопряжению молекула бензола становится более устойчивой, связь между атомами углерода в бензольном кольце значительно прочнее;
- бензол стоек к действию окислителей, реакции присоединения затруднены.
Плоскость, в которой расположены атомы углерода, называется бензольным ядром или бензольным кольцом.
Бензольное ядро — это прочная система. Связь в бензольном ядре часто называют ароматической. Делокализованная π-связь (см. рис. 31, б, в) — главный признак принадлежности веществ к группе ароматических соединений. По международной номенклатуре ароматические углеводороды называются аренами.
Ароматические углеводороды, или арены, — это органические соединения, в молекулах которых имеется одно или несколько бензольных колец.
Общая формула углеводородов ряда бензола, имеющих одно бензольное кольцо, CnH2n-6.
Известны также небензоидные ароматические соединения, например гетероциклические.
Физические свойства бензола
Бензол — это легкокипящая (температура кипения 80,1 °С) бесцветная жидкость, не растворяется в воде. Имеет специфический запах. При охлаждении легко застывает и превращается в белую кристаллическую массу с температурой плавления 5,5 °С.
Химические свойства бензола
1. Реакция горения
Как все углеводороды, бензол сгорает с образованием углекислого газа и воды:
Бензол горит коптящим пламенем.
Задание. Вычислите массовую долю (%) углерода в бензоле.
2. Реакции замещения
Наличие π-электронного облака в бензольном кольце, а также его пространственная доступность создают предпосылки для протекания реакций замещения. Для аренов характерны реакции электрофильного замещения в бензольном кольце. Важнейшими из таких реакций являются: галогенирование и нитрование.
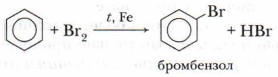
А. Галогенирование
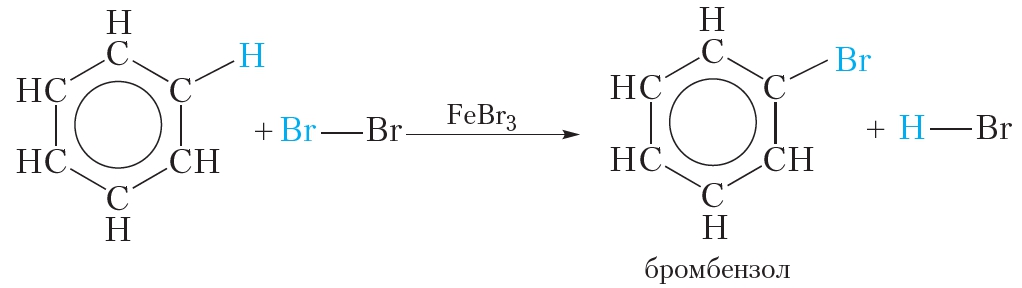
Бензол при обычных условиях не обесцвечивает бромную воду, но при нагревании в присутствии железных стружек вступает в реакцию, при этом образуется тяжёлая жидкость бромбензол — СбН5Вr:
Б. Нитрование
При действии на бензол нитрующей смеси (концентрированные серная и азотная кислоты) и при нагревании происходит реакция замещения, нитрогруппа азотной кислоты — NO2 замещает атом водорода в молекуле бензола:

При этом образуется желтоватая тяжёлая жидкость, нерастворимая в воде, с запахом горького миндаля — нитробензол C6H5NO2 которая используется в качестве растворителя, а также для получения анилина.
3. Реакции присоединения
Проблема. Бензол с большим трудом вступает в реакции присоединения. Почему это происходит?
Реакции присоединения аренов связаны с разрушением устойчивой системы бензольного кольца. Они энергетически невыгодны и протекают только при нагревании или при облучении.
А. Галогенирование
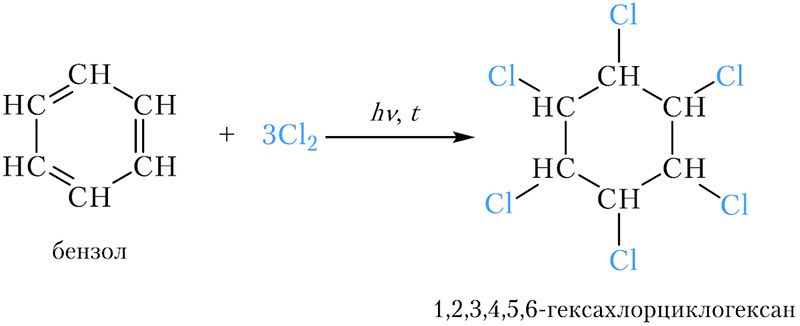
Реакция присоединения хлора к бензолу идёт при УФ-облучении и температуре кипения бензола. При этом образуется гексахлорциклогексан:
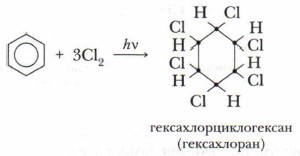
Гексахлорциклогексан — ядохимикат, который до недавнего времени использовался для защиты растений от насекомых, но он опасен для жизни человека, а потому заменён на более безопасные и легко разлагаемые пестициды.
Б. Гидрирование
Эта реакция идёт в присутствии катализаторов (Pt, Ni) и при нагревании:
Источник
§ 20. Химические свойства, получение и применение бензола
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 20. Химические свойства, получение и применение бензола |
| Напечатано:: | Гость |
| Дата: | Пятница, 22 Октябрь 2021, 03:58 |
Оглавление
Химические свойства бензола
Как вы уже знаете, в молекуле бензола имеется устойчивая сопряжённая система π-связей. Поэтому для бензола характерны реакции замещения, так как в этих реакциях сопряжённая система сохраняется. Наоборот, реакции присоединения для бензола малохарактерны. Так, бензол не обесцвечивает бромную воду, но в присутствии катализатора он вступает с бромом в реакцию замещения.
1. Галогенирование
Для осуществления этой реакции бензол смешивают с бромом в колбе и добавляют катализатор FeBr3. При этом протекает реакция замещения одного атома водорода на бром:
О протекании реакции можно судить по выделению бромоводорода, изменяющего цвет влажной индикаторной бумажки, помещённой в верхнюю часть колбы. Продукт бромирования бензола называется бромбензол.
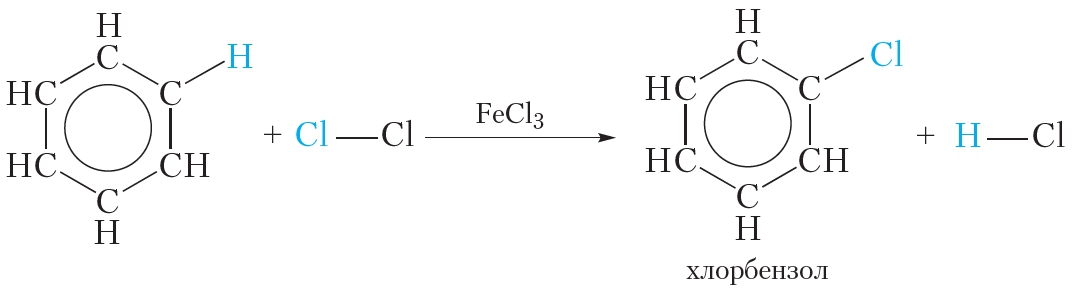
Как видно, в этой реакции единая система π-электронов сохраняется. Подобным образом проводят и хлорирование бензола:
2. Нитрование
Так называются реакции, в результате которых в молекулу органического соединения вводится группа — NO2, называемая нитрогруппой.
Если к смеси концентрированных азотной и серной кислот прибавить бензол, происходит реакция нитрования бензола, в результате которой образуется тяжёлая желтоватая жидкость с запахом горького миндаля — нитробензол:

Смесь концентрированных азотной и серной кислот называется нитрующей смесью. В нитрующей смеси азотная кислота выполняет роль нитрующего реагента, а серная кислота является катализатором.
С нитрованием гомолога бензола — толуола, продуктом которого является взрывчатое вещество, вы можете познакомиться, перейдя по ссылке в QR-коде.
3. Гидрирование
В жёстких условиях бензол может вступать в реакции присоединения. Примером реакции присоединения с участием бензола является его гидрирование, которое протекает при температуре около 200 °С под давлением в присутствии катализаторов гидрирования (никель или платина). При этом одна молекула бензола присоединяет сразу три молекулы водорода и превращается в циклогексан:

С реакцией присоединения хлора к бензолу вы можете познакомиться, перейдя по ссылке в QR-коде.
4. Горение
Подобно всем углеводородам, бензол горит. Уравнение реакции горения бензола:
Получение бензола
Из природных источников
Благодаря высокой устойчивости сопряжённой системы p-связей, ароматические фрагменты встречаются в составе каменного угля. Поэтому одним из способов получения бензола является переработка каменного угля. При сильном нагревании без доступа воздуха каменный уголь подвергается сложным химическим превращениям. В результате образуется много летучих продуктов, из которых, наряду с другими веществами, извлекают бензол.
Бензол получают также в результате переработки нефти. Эти процессы будут рассмотрены в следующем параграфе.
Из ацетилена
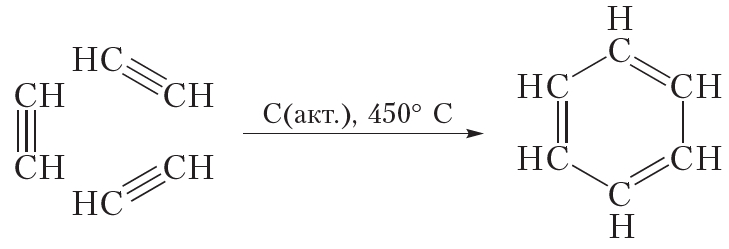
Бензол можно получить из ацетилена:
В данной реакции из трёх молекул ацетилена образуется одна циклическая молекула бензола, поэтому эта реакция называется реакцией циклотримеризации. Данная реакция протекает при пропускании ацетилена над нагретым активированным углём.
Применение бензола
Значительная часть бензола используется для синтеза других веществ. Так, нитрованием бензола получают нитробензол, который является исходным веществом для синтеза анилина (§ 45). Хлорированием бензола получают хлорбензол, который применяется для получения фенола (§ 27), пестицидов и т. д. Из бензола получают этилбензол. Дегидрированием этилбензола синтезируют винилбензол (стирол), который является сырьём для производства полимеров.
Бензол и некоторые его гомологи применяются в качестве растворителей органических веществ, однако из-за высокой токсичности бензола его применение в этом качестве ограниченно.
Для бензола характерны реакции замещения, в которых сопряжённая система π-связей сохраняется.
Бензол не обесцвечивает бромную воду, но в присутствии катализатора вступает с бромом в реакцию замещения с образованием бромбензола.
В жёстких условиях бензол вступает в реакцию присоединения с водородом. В результате образуется циклогексан.
Бензол получают в результате переработки нефти и каменного угля. Кроме того, бензол может быть получен по реакции циклотримеризации ацетилена.
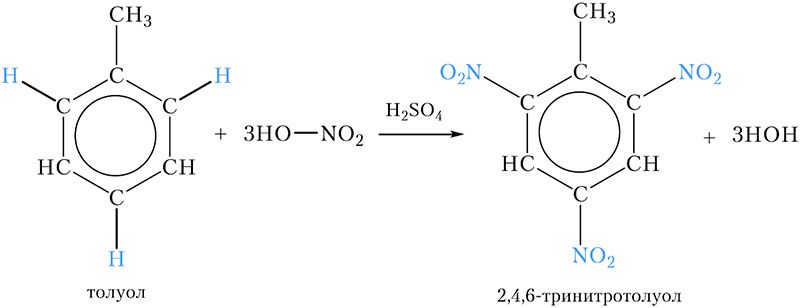
*Нитрование толуола
Нитрование толуола
Примером нитросоединения с несколькими нитрогруппами в молекуле является продукт нитрования ближайшего гомолога бензола — толуола. При этом три атома водорода бензольного кольца замещаются на нитрогруппы:
Название продукта — 2,4,6-тринитротолуол , его часто называют просто тринитротолуолом, ТНТ или тротилом. Тринитротолуол является взрывчатым веществом, которое используется в промышленности и военном деле.
*Хлорирование бензола
Хлорирование бензола
Молекула бензола может присоединить три молекулы хлора. Реакция протекает при нагревании и облучении ультрафиолетовым светом:
Образуется 1,2,3,4,5,6-гексахлорциклогексан , или гексахлоран. Это вещество долгое время использовалось в качестве инсектицида. Сейчас оно не применяется ввиду высокой токсичности.
Реакции гомологов бензола с участием боковой цепи
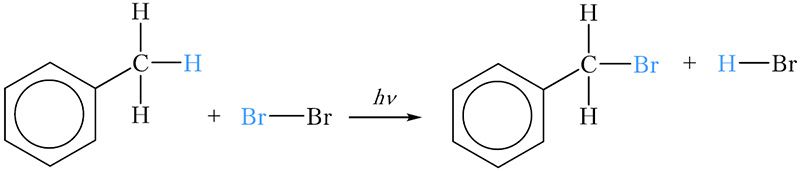
Гомологи бензола могут вступать в реакции замещения атомов водорода боковой цепи другими атомами. Используя это свойство, можно легко различить бензол и толуол. Для этого в две пробирки наливают по 2–3 см 3 бензола и толуола соответственно, затем по 2–3 см 3 бромной воды. Пробирки закрывают пробками и встряхивают. При этом бром из водной фазы за счёт лучшей растворимости в углеводородах переходит в органический слой, который находится сверху. При этом органический слой окрашивается в оранжевый цвет. Пробирки некоторое время интенсивно освещают. Через несколько минут можно наблюдать, что в одной из пробирок оранжевая окраска органического слоя сохранилась, тогда как во второй пробирке органический слой обесцветился. Обесцвечивание произошло в пробирке с толуолом за счёт протекания реакции замещения атома водорода метильной группы на атом брома:
Образовавшееся бромпроизводное толуола не имеет окраски.
Эта реакция напоминает реакцию замещения атомов водорода в молекулах алканов атомами галогенов. Реакция протекает при освещении, это свидетельствует о радикальном механизме реакции замещения, инициируемой светом (§ 10).
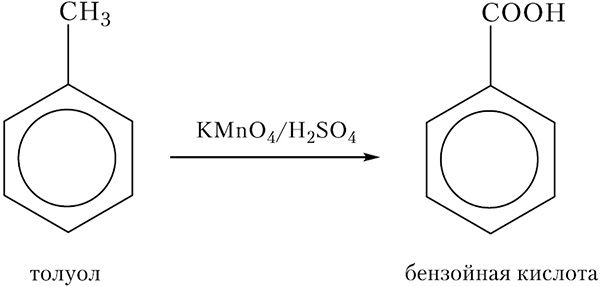
Атом углерода метильной группы в молекуле толуола легко окисляется, при этом образуется бензойная кислота. В качестве окислителя обычно используют раствор перманганата калия, подкисленный серной кислотой, либо хромовую смесь (раствор дихромата калия K2Cr2O7, подкисленный H2SO4). Схема реакции окисления толуола:
Вопросы и задания
1. Как распознать на основании химических свойств три жидкости: бензол, гексан и гексен-1? Приведите уравнения соответствующих реакций. Укажите условия их протекания. Опишите наблюдаемые явления.
2. Напишите уравнения реакций взаимодействия метана и бензола с хлором. Укажите условия их протекания. Почему обе реакции называются реакциями замещения?
3. Известно, что в присутствии платины этилен присоединяет водород даже при комнатной температуре. Бензол в этих условиях водород не присоединяет. Реакция присоединения водорода к бензолу протекает в жёстких условиях — при температуре 200 о С под давлением и в присутствии никеля в качестве катализатора. Объясните, с чем связано такое различие в реакционной способности этилена и бензола.
4. Приведите уравнение реакции циклотримеризации ацетилена в присутствии активированного угля. Какие продукты могут образоваться при циклотримеризации пропина в подобных условиях? Приведите их структурные формулы и дайте им названия.
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
6*. Напишите уравнение реакции нитрования толуола. Назовите продукт реакции. Где он используется?
7*. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
гептен-1 


8*. Напишите структурные формулы всех гомологов бензола состава С9Н12. Назовите их.
9*. Каково строение углеводорода состава С8Н8, обесцвечивающего бромную воду, легко полимеризующегося, а при окислении дающего бензойную кислоту? Напишите уравнения описанных реакций.
(Ответ: стирол.)
10*. Установите строение ароматического углеводорода состава С9Н12, при моногалогенировании которого в присутствии катализатора получается только одно галогенпроизводное.
(Ответ: 1,3,5-триметилбензол. )
Источник