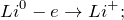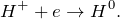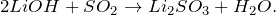- Li + H2O = ? уравнение реакции
- Гидрид лития: способы получения и химические свойства
- Способ получения
- Химические свойства
- Литий: способы получения и химические свойства
- Качественная реакция
- Химические свойства
- Li2O + H2O = ? уравнение реакции
- Оксид лития: способы получения и химические свойства
- Способ получения
- Химические свойства
Li + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме Li + H2O = ? Запишите молекулярное и уравнение реакции. Охарактеризуйте химический элемент литий: запишите его электронную конфигурацию, укажите основные физические и химические свойства, а также способы получения.
В результате взаимодействия лития с водой (Li + H2O = ?) происходит образование гидроксида лития и выделение газа водорода. Молекулярное уравнение реакции имеет вид:
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы литий и водород изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Литий – третий элемент Периодической таблицы. Обозначение – Li от латинского «lithium». Расположен в во втором периоде в IA группе. Относится к группе щелочных металлов. Заряд ядра равен 3. Электронная конфигурация выглядит следующим образом:
Литий достаточно широко распространен в земной коре. Наиболее ценны минералы сподумен 


В виде простого вещества литий представляет собой металл серебристо-белого цвета. Является самым легким из металлов (плотность 0,539 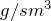

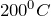
Для получения лития в промышленных масштабах наиболее часто используют его минералы, в лаборатории же – электролиз расплава хлорида лития в смеси хлоридов бария и калия.
Источник
Гидрид лития: способы получения и химические свойства
Гидрид лития LiH — неорганическое бинарное соединение щелочного металла лития и водорода, белого цвета, легкий, плавится без разложения, разлагается при дальнейшем нагревании.
Относительная молекулярная масса = 7, 95; относительная плотность для тв. и ж. состояния = 0, 82; tпл = 680◦ C
Способ получения
Гидрид лития получают реакцией взаимодействия лития и водорода:
2Li + H2 = 2LiH
Химические свойства
Гидрид лития белый, легкий, плавится без разложения, разлагается при дальнейшем нагревании.
1. Гидрид лития — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
1.1. При взаимодействии с кислородом гидрид лития образует гидроксид лития:
2LiH + O2 = 2LiOH
1.2. Гидрид лития взаимодействует с хлором , образуя хлорид лития и хлороводород:
LiH + Cl2 = LiCl + HCl
1.3. Гидрид лития реагирует с серой с образованием сульфида лития и сероводорода:
2LiH + 2S = Li2S + H2S
1.4. При взаимодействии гидрида лития и азота образуется нитрид лития и аммиак:
1.5. Взаимодействуя с углеродом (графитом) гидрид лития образует ацетиленид лития и ацетилен:
2. Гидрид лития взаимодействует со сложными веществами :
2.1. При взаимодействии с водой гидрид лития образует гидроксид лития и газ водород:
LiH + H2O = LiOH + H2↑
2.2. С хлороводородной кислотой гидрид лития реагирует при комнатной температуре с образованием хлорида лития и водорода:
LiH + HCl(разб.)= LiCl + H2↑
2.3. Гидрид лития может реагировать с такими оксидами , как:
2.3.1. Оксидом серы IV , образуя сульфат лития и хлороводород:
2.3.2. Оксидом кремния , с образованием силиката лития, кремния и водорода:
2.4. Гидрид лития реагирует с аммиаком с образованием нитрида лития и водорода:
Источник
Литий: способы получения и химические свойства
Литий — это щелочной металл, серебристо-белого цвета. Самый легкий из металлов, мягкий, низкая температура плавления.
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Качественная реакция
Качественная реакция на литий — окрашивание пламени солями лития в карминно-красный цвет .
Химические свойства
Литий — активный металл; на воздухе реагирует с кислородом и азотом, и покрывается оксидно-нитридной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Литий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами .
1.1. Литий легко реагирует с галогенами с образованием галогенидов:
2Li + I2 = 2LiI
1.2. Литий реагирует с серой с образованием сульфида лития:
2Li + S = Li2S
1.3. Литий активно реагирует с фосфором и водородом . При этом образуются бинарные соединения — фосфид лития и гидрид лития:
3Li + P = Li3P
2Li + H2 = 2LiH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
1.5. Литий реагирует с углеродом с образованием карбида:
1.6. При взаимодействии с кислородом литий образует оксид.
2. Литий активно взаимодействует со сложными веществами:
2.1. Литий бурно реагирует с водой . Взаимодействие лития с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
2Li 0 + H2 + O = 2 Li + OH + H2 0
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Литий взаимодействует с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , литий бурно реагирует с соляной кислотой :
2Li + 2HCl = 2LiCl + H2↑
2.3. При взаимодействии лития с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии лития с концентрированной серной кислотой образуется сульфат лития, диоксид серы и вода:
2.4. Литий реагирует с азотной кислотой:
3Li + 4HNO3(разб.) = 3LiNO3 + NO↑ +2H2O
2.5. Литий может реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
2.6. В расплаве литий может взаимодействовать с некоторыми солями . Обратите внимание! В растворе литий будет взаимодействовать с водой, а не с солями других металлов.
Например , литий взаимодействует в расплаве с хлоридом алюминия :
3Li + AlCl3 → 3LiCl + Al
Источник
Li2O + H2O = ? уравнение реакции
Закончите уравнение реакции Li2O + H2O = ? Расставьте стехиометрические коэффициенты. Запишите молекулярное уравнение реакции. Охарактеризуйте полученное вещество: приведите его основные физические и химические свойства. Каким образом его можно получить в лаборатории? А в промышленности?
В результате взаимодействия оксида лития с водой (Li2O + H2O = ?) происходит образование гидроксида лития (соединение). Молекулярное уравнение реакции имеет вид:
Данная реакция не относится к окислительно-восстановительным, поскольку ни один химический элемент не изменяет своей степени окисления.
Гидроксид лития представляет собой твердое вещество белого цвета, кристаллы которого плавятся без без разложения, но при дальнейшем нагревании в атмосфере водорода разлагаются. Он хорошо растворяется в воде.
Проявляет свойства основных гидроксидов (щелочь), реагирует с кислотами, кислотными оксидами, поглощает углекислый газ из воздуха.
В лабораторных условиях гидроксид лития получают по реакция растворения металлического лития в воде, а также реакциям обмена между солями лития и гидроксидами металлов:
Источник
Оксид лития: способы получения и химические свойства
Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса = 29,88; относительная плотность для тв. и ж. состояния = 2, 013; tпл = 1453º C; tкип ≈ 2600º C.
Способ получения
1. Оксид лития можно получить путем взаимодействия лития и кислорода :
2. Оксид лития получается при разложении гидроксида лития:
2LiOН → Li2O + Н2O
3. Путем термического разложения карбоната лития с образованием оксида лития и оксида углерода:
4. При термическом разложении нитрата лития образуется оксид лития, оксид азота и кислород:
Химические свойства
1. Литий вытесняется из оксида в результате взаимодействия с другими металлами :
1.1. Оксид лития взаимодействует с металлами и некоторыми неметаллами с образованием лития и оксида металла:
Li2O + Si = 4Li + SiO2
Li2O + Mg = 2Li + MgO
3Li2O + 2Al = 6Li + Al2O3
2. Оксид лития взаимодействует со сложными веществами:
2.1. Оксид лития реагирует с водой . Образуется гидроксид лития:
Li2O + H2O = 2LiOH
2.2. Оксид л ития взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид лития с соляной кислотой образует хлорид лития и воду:
2.3. При взаимодействии лития с оксидами образуются соли:
Источник