- Оксид кальция: способы получения и химические свойства
- Способ получения
- Химические свойства
- Какие оксиды реагируют с оксидом кальция и водой
- Что такое оксиды?
- Что такое оксид кальция?
- Что происходит при взаимодействии оксида кальция с водой?
- Заключение
- Реакция оксида кальция с водой
- Реакция взаимодействия оксида кальция с водой.
- Уравнение реакции взаимодействия оксида кальция с водой:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Acetyl
Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Источник
Какие оксиды реагируют с оксидом кальция и водой
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Оксиды – это широко распространенная группа химических соединений. К оксидам относятся многие очень известные соединения, такие как вода, углекислый газ, угарный газ. А как реагируют оксиды с другими веществами?
Что такое оксиды?
Это вещества, молекулы которых состоят из атомов кислорода и какого-либо химического элемента из таблицы Менделеева. Состав оксидов зависит от валентности этих атомов, т. е. количества химических связей, которые они способны образовать.
Получить данные вещества можно разными способами, но чаще всего они возникают при горении или разложении сложных веществ.
Что такое оксид кальция?

Это неорганическое вещество ещё называется негашеной известью. Оно представляет собой белый порошок, иногда с серым оттенком.
Ярко выраженного вкуса или запаха у него нет. Несмотря на внешнюю безобидность, это очень едкое вещество. Свои агрессивные свойства оно проявляет сильнее, когда вступает во взаимодействие с водой. В результате получается вещество под названием гашеная известь или гидроксид кальция.

В небольших количествах оксид кальция может использоваться в сферах пищевой промышленности:
- улучшает состав и качество муки, из которой потом пекут хлеб;
- входит в состав пищевых добавок;
- входит в состав регуляторов кислотности в кондитерских изделиях и в выпечке;
- способно поддерживать питательную среду для дрожжей;
- выступает в качестве катализатора при гидролизе жиров для производства пищевых масел;
- используется в процессе производства сахарного песка.


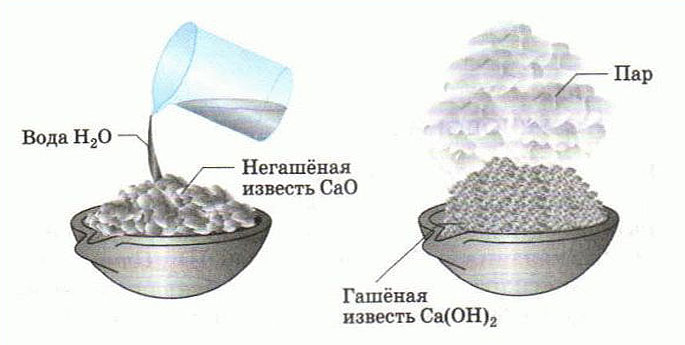
Что происходит при взаимодействии оксида кальция с водой?
Если оксид кальция смешать с водой, то в результате получится гашеная известь. Данный процесс имеет химическую природу. Во время его протекания выделяется определенное количество тепла. Часть воды, которая была добавлена в порошок изначально, постепенно испаряется.
Гашеная известь или гидроксид кальция может быть использована в быту. Что из нее готовят?
- Безопасное удобрение для грунта, борется с вредителями и паразитами.
- Профилактическая побелка для стволов растений.
- Нейтрализация кислот в различных органических средствах.
- Дубление натуральной кожи.
Также гашеная известь широко используется строителями:
- Входит в состав масел.
- Есть в небольшом количестве в солидоле.
- Используется для изготовления гипса и огнеупорных материалов.
- Входит в состав некоторых цементов.
- Используется в изготовлении силикатного кирпича.
- Применяется в качестве внутренней побелки.
- Входит в состав вяжущих и красящих смесей.
- Применяется для обработки деревянных изделий, защищает их от гниения и продлевает срок эксплуатации.
Заключение
Оксид кальция применяется весьма широко в различных сферах человеческой жизни (быт, садоводство и огородничество, строительная сфера, пищевая промышленность). Вещество легко вступает в химическую реакцию с водой.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Источник
Реакция оксида кальция с водой
Реакция взаимодействия оксида кальция с водой.
Уравнение реакции взаимодействия оксида кальция с водой:
Оксид кальция взаимодействует с водой . Процесс имеет название «гашение извести ».
Реакция оксида кальция с водой протекает при обычных условиях.
В результате реакции оксида кальция с водой образуется гидроксид кальция .
В ходе реакции оксида кальция с водой при стандартных условиях выделяется тепловая энергия (теплота) 65,27 кДж .
Термохимическое уравнение этой реакции имеет следующий вид:
CaO (т) + H2O (ж)= Ca(OH)2 (т) + 65,27 кДж; ΔH = -65,27 кДж/моль.
Таким образом, реакция оксида кальция с водой носит экзотермический характер.
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 481)
- Экономика Второй индустриализации России (102 474)
- Программа искусственного интеллекта ЭЛИС (27 488)
- Метан, получение, свойства, химические реакции (23 724)
- Этилен (этен), получение, свойства, химические реакции (22 776)
- Природный газ, свойства, химический состав, добыча и применение (21 158)
- Крахмал, свойства, получение и применение (20 566)
- Целлюлоза, свойства, получение и применение (19 410)
- Пропилен (пропен), получение, свойства, химические реакции (19 080)
- Прямоугольный треугольник, свойства, признаки и формулы (18 724)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |















