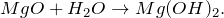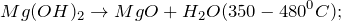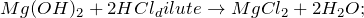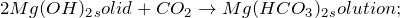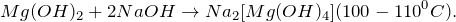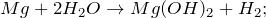- Оксид магния: способы получения и химические свойства
- Способ получения
- Химические свойства
- В какие реакции вступает оксид магния
- Примеры реакций оксида магния
- Реакции MgO с кислотными оксидами
- Реакции с амфотерным оксидами:
- Как MgO реагирует с водой?
- Оксид магния смешать с водой
- MgO + H2O = ? уравнение реакции
- Магний: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
Оксид магния: способы получения и химические свойства
Оксид магния MgO — бинарное неорганическое вещество . Белый, тугоплавкий, термически устойчивый, не реагирует с водой. Проявляет основные свойства.
Относительная молекулярная масса Mr = 40,3; относительная плотность для тв. и ж. состояния d = 3,62; tпл ≈ 2825º C; tкип = 3600º C.
Способ получения
1. Оксид магния получается при разложении карбоната магния при температуре 350 — 650º C. В результате разложения образуется оксид магния и углекислый газ:
2. В результате разложения нитрата магния при температуре выше 300º С образуется оксид магния, оксид азота (IV) и кислород:
3. Гидроксид магния разлагается при 350-480º С с образованием оксида магния и воды:
4. Оксид магния можно получить путем разложения сульфата магния при температуре выше 1200º C, образуется оксид магния, кислород и оксид серы (IV):
5. Оксид магния можно получить сжиганием магния в в кислороде при 600 — 650º С:
2Mg + O2 = 2MgO
Химические свойства
1. Оксид магния реагирует с простыми веществами :
1.1. В результате реакции между оксидом магния и кальцием при температуре выше 400º С образуется магний и оксид кальция:
MgO + Ca = CaO + Mg
1.2. Оксид магния реагирует с углеродом при температуре выше 2000º С и образует магний и угарный газ:
MgO + C = Mg + CO
2. Оксид магния взаимодействует со сложными веществами:
2.1. Оксид магния взаимодействует с кислотами . При этом образуются соль и вода.
2.1.1. О ксид магния с разбавленной соляной кислотой образует хлорид магния и воду:
MgO + 2HCl = MgCl2 + H2O
2.3. Оксид магния взаимодействует с водой при 100 — 125º С, образуя гидроксид магния:
Источник
В какие реакции вступает оксид магния
Всё о химических свойствах оксида магния
Оксид магния — порошкообразное вещество, которое в природе встречается в форме минерала периклаз. Порошок этот очень тугоплавкий (расплав образуется при температуре свыше 2650 ⁰С).
Оксид магния легко впитывает влагу, благодаря чему он нашел широкое применение. Оксид магния применяется в пищевой промышленности (кодируется как пищевая добавка Е 530) против комкообразования и слеживания.
В медицине MgO используется как антацид (средство против повышенной кислотности в желудке), как слабительное или как вспомогательное вещество во многих лекарствах, которые выпускаются в форме таблеток.
Нашел MgO широкое распространение и как наполнитель в производстве резины, огнеупоров, цемента, а также в качестве мелкого абразива в электронной промышленности.
Интересное оптическое свойство порошка оксида магния обуслаливает его применение в качестве эталонного отражателя: в широком спектре его коэффициент отражения равен 1.
Одно из названий MgO — жженая магнезия, так как он получается при обжиге минералов магнезита и доломита:
Получить это вещество можно простым способом — взаимодействием магния и кислорода:
Будучи основным оксидом, MgO вступает в реакции с:
- водой, образуя гидроксид магния (о нюансах этой реакции расскажем чуть позже);
- с кислотами, образуя соли и воду;
- с кислотными оксидами, образуя сложные соли;
- c амфотерным оксидами при сплавлении образует сложные вещества — двойные оксиды.
Примеры реакций оксида магния
Растворение в кислотах:
- MgO + HCl (разб) → MgCl₂ + H₂O (для протекания реакции нужны неконцентрированные кислоты)
- MgO + H₂SO₄ → MgSO₄ + H₂O В реакциях с кислотами MgO показывает общие свойства оксидов (образуя соль и воду).
Реакции MgO с кислотными оксидами
MgO + SO₃ → MgSO₄ — образуется сульфат магния
MgO + СO₃ → MgСO₃ — образуется карбонат магния
Реакции с амфотерным оксидами:
Al₂O₃ + MgO → MgAl₂O₄
В этой реакции оксида магния с оксидом алюминия образуется алюминат магния (двойной оксид магния и алюминия). Реакция протекает при высокой температуре (свыше 1500 ⁰С).
Как MgO реагирует с водой?
Являясь основным оксидом, MgO взаимодействует с водой, образуя основание — гидроксид магния.
С холодной водой оксид магния реагирует очень медленно, но если реакцию проводить с водяным паром, реакция пойдет быстрее.
MgO + H₂O (вода в виде горячего пара) → Mg(OH)₂
В результате этой реакции образуется гидроксид магния
А вот если у экспериментатора есть полоска магния, можно провести очень зрелищный опыт:
- полоску металла частично опустить в стакан с водой;
- поджечь оставшуюся часть магния.
Mg + 2H₂O = Mg(OH)₂ + H₂↑
Горение магния продолжается даже в воде. При этом выделяющийся водород тоже вступает в реакцию горения.
Внимание! Не пытайтесь повторить этот опыт самостоятельно!
Источник
Оксид магния смешать с водой
Смесь оксида и нитрида магния общей массой 20 г обработали горячей водой. Выделившийся газ пропустили через трубку с раскалённым оксидом меди(II), в результате масса трубки уменьшилась на 6,0 г. Рассчитайте массовые доли веществ в исходной смеси.
1) Составлены уравнения реакций:
2) Рассчитано количество вещества оксида меди(II):
3) Рассчитано количество вещества аммиака и нитрида магния:
4) Рассчитаны масса нитрида магния и массовые доли веществ в смеси:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, включает все названные выше элементы | 4 |
| В ответе допущена ошибка в одном из названных выше элементов | 3 |
| В ответе допущена ошибка в двух из названных выше элементов | 2 |
| В ответе допущена ошибка в трех из названных выше элементов | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Оксид магния — оксид не щелочного металла, с водой не реагирует. Масса трубки уменьшилась на 6 грамм- почему она уменьшилась на массу кислорода, если кислород не выделяется, соединится с водородом тут же и получится на стенках вода, а внизу трубки медь. Содержимое трубки уменьшится на ту массу оксида меди, которая вступит в реакцию с аммиаком, остальная масса оксида меди в избытке будет. Получается, с аммиаком прореагирует только 6 гр оксида меди исходя из условия задачи. n(CuO)=6/80=0.075 n(NH3)=2*0.075/3=0.05 n(Mg3N2)=0.05/2=0.025 m(Mg3N2)=0.025*100=2.5 m(MgO)=20-2.5=17.5 w(Mg3N2)=(2.5/20)*100=12.5% w(MgO)=(17.5/20)*100=87.5%
Галина, оксид магния будет с водой при нагревании «обработали горячей водой».
примется ли другой метод решения этой задачи, например, через обозначение количества исходных веществ через х и у и дальнейшие расчеты? ответ получился такой же.
Да. Главное, чтобы был правильный ответ, формулы и промежуточные расчёты.
Масса трубки уменьшилась на массу азота, выделяющегося в результате реакции, т.к. он улетучивается, а в закрытой трубке такую реакцию не проводят. Поэтому, 6 г — это будет масса азота
Источник
MgO + H2O = ? уравнение реакции
Помогите составить химическое уравнение по схеме MgO + H2O = ? Расставьте стехиометрические коэффициенты. Укажите тип взаимодействия. Запишите молекулярное уравнение реакции. Охарактеризуйте полученное соединение: укажите основные физические и химические свойства, способы получения.
В результате взаимодействия оксида магния с водой (MgO + H2O = ?) происходит образование нерастворимого в воде основания – гидроксида магния (соединение). Молекулярное уравнение реакции имеет вид:
Гидроксид магния представляет собой вещество белого цвета, кристаллы которого при нагревании разлагаются. Не растворяется в воде. Проявляет основные свойства, реагирует с кислотами, кислотными оксидами. В жестких условиях образует гидроксокомплексы. Поглощает углекислый газ из воздуха. Переводится в раствор солями аммония.
Кроме вышеописанного способа гидроксид магния получают растворением металла в воде:
а также по любой реакции, удовлетворяющей сокращенному-ионному уравнению
Источник
Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Источник