Оксид mno реагирует с водой
В степени окисления +2 для марганца характерны оксид, гидроксид и соли.
Оксид марганца (II) MnO – кристаллическое вещество серо-зеленого цвета, образует две полиморфные модификации: кубическую и гексагональную, обладает полупроводниковыми свойствами.
Проявляет преимущественно основные свойства. С водой и растворами щелочей не взаимодействует, в кислотах растворяется, образуя соли марганца (II) и воду:
При сплавлении со щелочами в избытке кислорода образует гипоманганаты:
Образуется при термическом разложении гидроксида марганца (II) и солей в инертной атмосфере:
Проявляет восстановительные свойства.
Гидроксид марганца (II) Mn(OH)2 – вещество белого цвета, плохо растворимое в воде, основание средней силы, проявляет преимущественно основные свойства, легко растворяется в кислотах:
при обычных условиях с водными растворами щелочей не взаимодействует, при длительном нагревании возможно образование гескагидроксоманганата (II):
На воздухе быстро окисляется:
Проявляет восстановительные свойства.
Получается при взаимодействии солей марганца (II) с растворами щелочей:
Соли марганца (II). Марганец (II) образует соли со многими анионами, многие из них хорошо растворимы в воде, образуя растворы розового цвета. Мало растворимы сульфид, карбонат и ортофосфат марганца (II). Проявляют все свойства солей, в растворе гидролизуют.
Обладают восстановительными свойствами. В щелочной среде окисляются до манганатов – производных марганца (VI):
Источник
Марганец, цинк и серебро
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит
Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
- Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды.
Реакции с кислотами
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
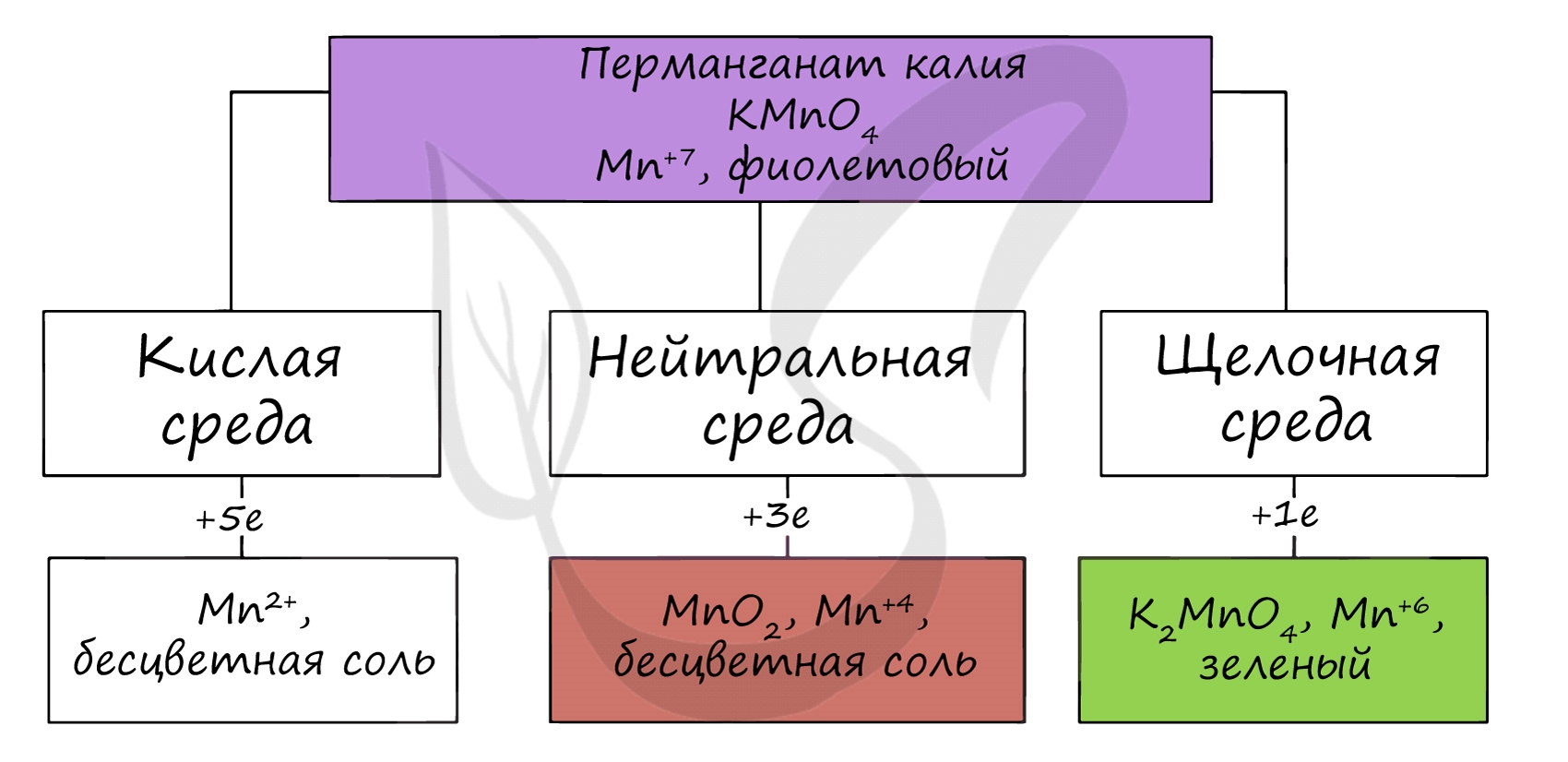
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.
Для цинка характерна постоянная степень окисления +2.
Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
- Реакции с неметаллами (и аммиаком 🙂
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Реакции с кислотами
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
- Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Реакции с кислотами
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
С органическими веществами
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
Источник
Соединения марганца
Устойчивые оксиды и гидроксиды марганца:
- степень окисления +2:
- MnO — основной оксид
- Mn(OH)2 — основание
- степень окисления +3:
- Mn2O3 — основной оксид
- Mn(OH)3 — основание
- степень окисления +4:
- MnO2 — амфотерный оксид
- Mn(OH)4 — амфотерный гидроксид
- степень окисления +6:
- MnO3 — кислотный оксид
- H2MnO4 — кислота
- степень окисления +7:
- Mn2O7 — кислотный оксид
- HMnO4 — кислота
Свойства соединений марганца, указанных выше, изменяются с ростом степени окисления марганца (сверху-вниз) следующим образом:
- степень окисления — возрастает
- кислотные свойства — увеличиваются
- окислительная способность — увеличивается
Оксид марганца MnO(II)
- кристаллы серо-желтого цвета;
- плохо растворяется в воде;
- обладает свойствами полупроводника;
- как основной оксид реагирует с кислотами:
MnO+2HCl = MnCl2+H2O - реагирует в термических реакциях с водородом и активными металлами с образованием марганца:
MnO+H2 = Mn+H2O
MnO+Ca = Mn+CaO - получают MnO(II) разлагая гидроксид марганца (или нитрат марганца):
Mn(OH)2 = MnO+H2O
2Mn(NO3)2 = 2MnO+4NO2+O2
Гидроксид марганца Mn(OH)2(II)
- кристаллы светло-розового цвета;
- обладает слабыми восстановительными свойствами;
- как основание, взаимодействует с кислотами:
Mn(OH)2+2HCl = MnCl2+2H2O - реагирует с кислородом и другими окислителями, окисляясь до марганцовой кислоты или солей ее манганатов:
6Mn(OH)2+O2 = 2Mn2MnO4+6H2O - Mn(OH)2(II) получают взаимодействием щелочей на растворы солей марганца:
MnSO4+2NaOH = Mn(OH)2↓+Na2SO4
Оксид (диоксид) марганца MnO2(IV)
- вещество коричнево-черного цвета;
- нерастворимо в воде;
- обладает амфотерными свойствами:
MnO2+2KOH = K2MnO3+H2O
MnO2+2H2SO4 = Mn(SO4)2+2H2O - проявляет, как окислительные, так и восстановительные свойства, в зависимости от кислотных свойств другого взаимодействующего вещества:
2MnO2+3PbO2+6HNO3 = 2HMnO4+3Pb(NO3)2+2H2O (восстановитель)
MnO2+4HCl = MnCl2+Cl2↑+2H2O (окислитель)
- в производстве марганца и его соединений;
- в производстве коричневой краски;
- в сухих источниках энергии;
- в производстве стекла, в качестве осветлителя;
- в качестве окислителя в органической химии.
Оксид марганца Mn2O7(VII)
- жидкость зелено-черного цвета жирной консистенции;
- неустойчивое вещество;
- tпл = 5,9°C
- ρ = 2,4 г/см 3
- при нагревании выше 50°C разлагается на кислород и низший оксид марганца (при высокой температуре взрывается):
2Mn2O7 = 4MnO2+3O2 - является очень сильным окислителем, воспламеняет горючие вещества;
- как кислотный оксид реагирует с щелочами, образуя соли перманганаты:
Mn2O7+2KOH = 2KMnO4+H2O - взаимодействует с водой с образованием марганцовой кислоты, существующей только в растворах:
Mn2O7+H2O = 2HMnO4 - получают взаимодействием концентрированной серной кислоты на водный р-р перманганата калия:
2KMnO4+H2SO4 = Mn2O7+K2SO4+H2O
Соли марганца (II)
Соли марганца получают растворением марганца в разбавленных кислотах, при этом получается бесцветный раствор, который при взаимодействии с щелочами мутнеет по причине выпадения в осадок гидроксида марганца (II), быстро темнеющего на воздухе с переходом в гидроксид марганца (IV) бурого цвета.
2Mn(OH)2+O2+2H2O = 2Mn(OH)4
Марганцовая кислота
Как уже было сказано выше, марганцовая кислота является сильной кислотой, существующей только в водном растворе. Соли марганцовой кислоты называются перманганатами, самым известным из которых является, конечно же, перманганат калия KMnO4, который в быту называют «марганцовкой».
Во времена СССР ампулу с марганцовкой можно было купить в любой аптеке. Сейчас, перманганат калия «простому смертному» практически не достать, и дело тут не в дефиците, а в специфических свойствах марганцовки, о которых мы не будем распространяться.
Свойства перманганата калия:
- кристаллы темно-фиолетового цвета;
- умеренно растворяется в воде, окрашивая ее в цвет от малинового до темно-фиолетового, в зависимости от концентрации ионов MnO4 — , имеющих фиолетовый цвет;
- является сильным окислителем, в зависимости от кислотности среды, манганаты восстанавливаются с образованием:
- в кислой среде ионы MnO4 — восстанавливаются до ионов Mn 2+ — при добавлении сульфита калия к подкисленному серной кислотой фиолетовому раствору KMnO4, тот обесцвечивается по причине образования соли марганца (II):
2KMn +7 O4+5K2S +4 O3+3H2SO4 = 2Mn +2 SO4+6K2S +6 O4+3H2O - в нейтральной среде при действии сульфита калия образуется бурый осадок оксида марганца (IV), при этом марганец изменяет свою степень окисления с +7 до +4:
2KMnO4+3K2SO3+H2O = 2MnO2↓+3K2SO4+2KOH - в щелочной среде происходит восстановление до манганата, о чем свидетельствует образование манганат-ионов, окрашивающих раствор в зеленый цвет:
2KMnO4+K2SO3+2KOH = 2K2MnO4+K2SO4+H2O
- в кислой среде ионы MnO4 — восстанавливаются до ионов Mn 2+ — при добавлении сульфита калия к подкисленному серной кислотой фиолетовому раствору KMnO4, тот обесцвечивается по причине образования соли марганца (II):
- перманганаты разлагаются при термическом воздействии с выделением кислорода:
2KMnO4 = K2MnO4+MnO2+O2↑ - мелкораздробленные кристаллы марганца при нагревании растворяются в воде, выделяя водород:
Mn+2H2O = Mn(OH)2+H2↑
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник