- Какие оксиды реагируют с оксидом кальция и водой
- Что такое оксиды?
- Что такое оксид кальция?
- Что происходит при взаимодействии оксида кальция с водой?
- Заключение
- Оксид кальция: способы получения и химические свойства
- Способ получения
- Химические свойства
- Примерные вопросы для творческих заданий
- Урок 10. Подготовка к контрольной работе
Какие оксиды реагируют с оксидом кальция и водой
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Оксиды – это широко распространенная группа химических соединений. К оксидам относятся многие очень известные соединения, такие как вода, углекислый газ, угарный газ. А как реагируют оксиды с другими веществами?
Что такое оксиды?
Это вещества, молекулы которых состоят из атомов кислорода и какого-либо химического элемента из таблицы Менделеева. Состав оксидов зависит от валентности этих атомов, т. е. количества химических связей, которые они способны образовать.
Получить данные вещества можно разными способами, но чаще всего они возникают при горении или разложении сложных веществ.
Что такое оксид кальция?

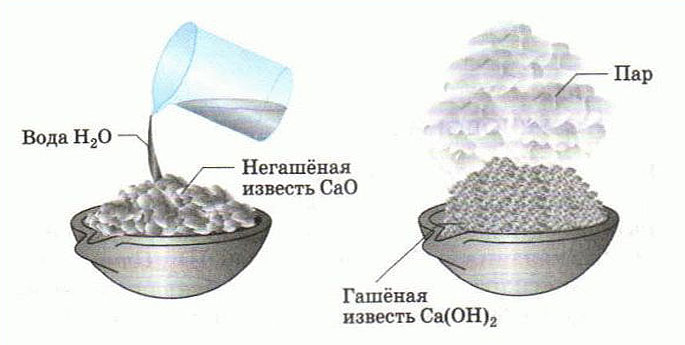
Это неорганическое вещество ещё называется негашеной известью. Оно представляет собой белый порошок, иногда с серым оттенком.
Ярко выраженного вкуса или запаха у него нет. Несмотря на внешнюю безобидность, это очень едкое вещество. Свои агрессивные свойства оно проявляет сильнее, когда вступает во взаимодействие с водой. В результате получается вещество под названием гашеная известь или гидроксид кальция.

В небольших количествах оксид кальция может использоваться в сферах пищевой промышленности:
- улучшает состав и качество муки, из которой потом пекут хлеб;
- входит в состав пищевых добавок;
- входит в состав регуляторов кислотности в кондитерских изделиях и в выпечке;
- способно поддерживать питательную среду для дрожжей;
- выступает в качестве катализатора при гидролизе жиров для производства пищевых масел;
- используется в процессе производства сахарного песка.


Что происходит при взаимодействии оксида кальция с водой?
Если оксид кальция смешать с водой, то в результате получится гашеная известь. Данный процесс имеет химическую природу. Во время его протекания выделяется определенное количество тепла. Часть воды, которая была добавлена в порошок изначально, постепенно испаряется.
Гашеная известь или гидроксид кальция может быть использована в быту. Что из нее готовят?
- Безопасное удобрение для грунта, борется с вредителями и паразитами.
- Профилактическая побелка для стволов растений.
- Нейтрализация кислот в различных органических средствах.
- Дубление натуральной кожи.
Также гашеная известь широко используется строителями:
- Входит в состав масел.
- Есть в небольшом количестве в солидоле.
- Используется для изготовления гипса и огнеупорных материалов.
- Входит в состав некоторых цементов.
- Используется в изготовлении силикатного кирпича.
- Применяется в качестве внутренней побелки.
- Входит в состав вяжущих и красящих смесей.
- Применяется для обработки деревянных изделий, защищает их от гниения и продлевает срок эксплуатации.
Заключение
Оксид кальция применяется весьма широко в различных сферах человеческой жизни (быт, садоводство и огородничество, строительная сфера, пищевая промышленность). Вещество легко вступает в химическую реакцию с водой.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Источник
Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Источник
Примерные вопросы для творческих заданий
1. Каково содержание железа в: а) оксиде железа(II); б) оксиде железа(III); в) железной окалине Fe3O4?
2. Получите оксид углерода(IV), используя реакции разных типов. Запишите уравнения реакций.
3. Найдите ряд, в котором представлены формулы только кислотных оксидов. Как можно отличить углекислый газ от других газов? Составьте уравнение качественной реакции на газ СО2.
| SO2 | Na2O | Fe2O3 |
| K2O | CO2 | HgO |
| CaO | N2O5 | P2O5 |
4. Напишите формулы и названия десяти оксидов, встречающихся в природе. Какие из них твердые, а какие – газы и жидкости?
Урок 10.
Подготовка к контрольной работе
ЧАСТЬ А
Задание. Вспомните все определения, которые встречались вам на протяжении изучения данной темы (уроки 1–9).
ЧАСТЬ Б
УРОВЕНЬ 1
1. Из предложенных ниже формул веществ выпишите отдельно формулы оксидов, кислот, солей, оснований. Дайте им названия.
УРОВЕНЬ 2
2. Напишите по две формулы кислот разных типов (можно использовать формулы кислот из задания 1). Укажите признаки классификации для этих кислот. Например: бескислородные или кислородсодержащие, одно- или многоосновные, стабильные или нестойкие.
3. Составьте формулы гидроксидов, соответствующих формулам оксидов, предложенным в задании 1. Определите характер полученных гидроксидов.
(Подсказка. Оксиду N2O5 cоответствует гидроксид (гидрат оксида) HNO3 – азотная кислота. Это одноосновная, сильная, кислородсодержащая кислота.)
4. Составьте формулы солей по их названиям.
УРОВЕНЬ 1
г) карбонат кальция – . .
УРОВЕНЬ 2
д) фторид алюминия – . ;
е) бромид железа(III) – . ;
ж) силикат натрия – . ;
з) сульфит алюминия – . .
УРОВЕНЬ 3
и) манганат калия – . ;
к) метафосфат кальция – . ;
л) гидрокарбонат магния – . ;
м) гидроксикарбонат меди(II) – . .
Составьте формулы гидроксидов (кислот и оснований), образующих соли в этом задании. Определите характер данных гидроксидов. Дайте им названия.
(Подсказка.
KOH – однокислотное основание, шелочь, гидроксид калия, H2MnO4 – двухосновная кислородсодержащая марганцовистая кислота, существует только в растворе.)
УРОВЕНЬ 1
5. Закончите уравнения реакций, запишите их в молекулярном и ионном видах, укажите типы химических реакций и названия продуктов реакций.
а) Оксид серы(VI) + оксид натрия
б) гидроксид калия + хлорид железа(III)
в) серная кислота + цинк
г) азотная кислота + оксид алюминия
д) гидроксид меди(II) + соляная кислота
е) соляная кислота + карбонат натрия
ж) фосфат натрия + нитрат магния
з) магний + нитрат серебра
и) гидроксид натрия + оксид серы(IV)
УРОВЕНЬ 2
6. а) С какими из перечисленных ниже веществ будет взаимодействовать раствор серной кислоты: магний, медь, гидроксид калия, оксид магния, гидроксид железа(II), оксид серы(IV). Запишите уравнения реакций в молекулярном и кратком ионном видах, укажите типы химических реакций, назовите продукты реакций.
б) С какими из перечисленных ниже веществ будет взаимодействовать раствор гидроксида калия: оксид железа(III), оксид азота(V), азотистая кислота, серная кислота, нитрат железа(III), сульфат натрия. Запишите уравнения реакций в молекулярном и кратком ионном видах, укажите типы химических реакций, назовите продукты реакций.
7. Используя предложенные фрагменты, составьте уравнения реакций в молекулярной и краткой ионной формах, характеризующие химические свойства: а) кислот; б) оснований (растворимых и нерастворимых); в) солей; г) оксидов (кислотных и основных).
HCl + . = H2S 
(для реакции нерастворимого основания Fe(OH)2 c кислотным оксидом SO2 молекулярное и краткое ионное уравнения совпадают);
. = Са3(РO4)2 
. + 2H2O + Zn = Na2[Zn(OH)4] + H2
3ОН – + Fe 3+ = Fe(OH)3
Сu(OH)2 
в) CaCO3 + SiO2 
FeCl2 + . = Fe(OH)2 
Ag + + Cl – = AgCl
Сa(HCO3)2 
SO3 
СuO + H2 
FeO + CO 
8. Запишите уравнения реакций в молекулярном виде, с помощью которых можно осуществить следующие превращения:
а) фосфор 


б) барий 


9. Пунктирными линиями покажите, с какими веществами взаимодействуют кислоты. Запишите уравнения реакций в молекулярном и ионном видах.
Источник






