- Большая Энциклопедия Нефти и Газа
- Растворимость — органическое соединение
- Органика. Влияние на общую формулу и растворимость орг. веществ в воде.
- Все УВ
- Одноатомные спирты
- Многоатомные спирты
- Фенолы
- Фенол
- Альдегиды и кетоны
- Карбоновые кислоты
- Сл. эфиры
- Насыщенные амины
- Ароматические амины
- Аминокислоты
- Теперь перейдём к влиянию на общую формулу.
- Вода как растворитель — свойства, значение и примеры
- Свойства воды как растворителя
- Какие вещества растворяются в воде
- Что не растворяется в воде
- Значение воды как растворителя
- Глава 12. Органические вещества в водных системах
Большая Энциклопедия Нефти и Газа
Растворимость — органическое соединение
Растворимость органических соединений в воде во многом обусловлена образованием водородных связей с растворителем. [1]
Растворимость органических соединений в жидкостях в значительной мере зависит от функциональных групп. Известно правило, что наличие гидроксильных и аминогрупп повышает растворимость в воде и снижает растворимость в спирте; таков, например, ряд гексан — гексиловый спирт — сорбит. [3]
Растворимость органических соединений в воде изучают очень интенсивно, поскольку данные эти нужны для решения многих технологических задач. Достаточно назвать проблему очистки воды от промышленных загрязнений органическими продуктами, для решения которой могут быть применены, в частности, экстрактивные методы. Экспериментальные данные по растворимости опубликованы, в различного рода справочных изданиях. [4]
Растворимость органических соединений в воде в пределах одного химического класса уменьшается с возрастанием длины цепи. Следовательно, адсорбция из водного раствора увеличивается по мере роста цепи в гомологическом ряду, что обусловлено возрастанием степени гидрофобности молекул. Имеющиеся данные свидетельствуют о том, что структурно простые соединения хуже адсорбируются в ионной форме и лучше — в нейтральной. По мере усложнения структуры соединений влияние ионизации ослабевает. [5]
Растворимость органических соединений в первую очередь определяется числом доступных для гидратации атомных группировок. Хорошие хелатообразующие реагенты для гравиметрического анализа, содержат несколько таких группировок, которые затем при комплексооб-разовании с металлом оказываются полностью блокированными. Хела ты таких реагентов очень мало растворимы в воде, так как при комгь лексообразовании гидратирующиеся группировки оказываются полностью блокированными. Для наглядности достаточно привести два примера. [6]
На растворимость органических соединений часто вследствие их сложной структуры оказывают влияние внутримолекулярные и межмолекулярные силы. [7]
Определение растворимости органических соединений в органических растворителях необходимо для правильного проведения различных лабораторных операций. [8]
Испытание растворимости органических соединений может также принести большую пользу для их идентификации. Как известно, полярные соединения в целом лучше растворяются в полярных растворителях, а неполярные — в неполярных. На приведенной ниже схеме показано, как последовательное применение различных растворителей позволяет довольно просто определить, к какому классу относится испытуемое соединение, какие функциональные группы оно содержит. [9]
Сведения о растворимости органических соединений находят в справочной литературе, а если такие сведения отсутствуют, то подбирают соответствующий растворитель на основании результатов пробирочных опытов. [10]
Часто понижение растворимости органических соединений совпадает с повышением температуры их плавления. [12]
Таким образом, растворимость органических соединений в концентрированных растворах щелочей пренебрежимо мала, что существенно отличает эти растворы от других водных фаз, используемых в двухфазных каталитических системах. [13]
Вследствие этого изучение растворимости органических соединений в растворителях различной природы может дать первоначальные сведения о его структуре. [14]
Высаливание ( уменьшение растворимости органических соединений в воде при добавлении неорганических солей) наиболее широко применяется в синтезе водорастворимых красителей. В этих процессах высаливание настолько эффективно, что после добавления NaCl или КС1 к водному раствору красителя след капли раствора на фильтровальной бумаге ( вытек) становится почти бесцветным и краситель весь находится в осадке. Обычно в процессе высаливания выпадают мелкокристаллические осадки, содержащие даже после фильтрования 60 — 80 % маточного раствора. Кристаллы приходится отделять на обычных фильтрпрессах. Высаливание применяется также в мыловарении и ряде других производств. В отдельных случаях, варьируя солевой состав раствора, температуру высаливания и продолжительность процесса, получают крупнокристаллические осадки, пригодные для отфильтровы-вания на механизированных аппаратах. [15]
Источник
Органика. Влияние на общую формулу и растворимость орг. веществ в воде.
Здравствуйте дорогие читатели, в этой статье я расскажу про растворимость органических веществ в воде и про влияние ФГ и связей на общую формулу. Через 8 дней опять в школу. И из-за этого коронавируса линейки не будет, а это была бы моя крайняя линейка в школе. В следующей статье я надеюсь написать окисление в органике, чтобы не пропустить подписывайтесь на канал и ставьте лайки и обязательно дочитайте статью до конца. Начнём.
Все УВ
В воде растворимы плохо, хорошо растворяются в органических растворителях.
Одноатомные спирты
Низшие в воде растворимы хорошо, с ростом молекулярной массы растворимость падает, хорошо растворяются в органических растворителях.
Многоатомные спирты
Хорошо растворимы в воде, хорошо растворяются в органических растворителях.
Фенолы
Малорастворимые в воде, хорошо растворяются в органических растворителях.
Фенол
Ограниченно растворим в воде, но при температуре 66° смешивается с водой в любых соотношениях, хорошо растворяются в органических растворителях.
Альдегиды и кетоны
Низшие хорошо растворяются в воде, с ростом молекулярной массы – плохо. Хорошо растворяются в органических растворителях.
Карбоновые кислоты
Первые три гомолога (метановая – пропановая кислоты) растворимы в воде неограниченно. Дальше растворимость падает, хорошо растворяются в органических растворителях.
Сл. эфиры
Малорастворимые в воде, хорошо растворяются в органических растворителях.
Малорастворимые в воде, хорошо растворяются в органических растворителях.
Насыщенные амины
Низшие в воде растворимы хорошо, с ростом молекулярной массы растворимость падает, хорошо растворяются в органических растворителях.
Ароматические амины
Малорастворимые в воде, хорошо растворяются в органических растворителях.
Аминокислоты
Хорошо растворяются как в воде, так и в органических растворителях.
Теперь перейдём к влиянию на общую формулу.
Конечно не забываем, что отнимается от общей формулы алканов CnH2n+2.
На этом всё. Не забывайте ставить лайки и подписываться на канал. Спасибо за внимание!
Источник
Вода как растворитель — свойства, значение и примеры
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
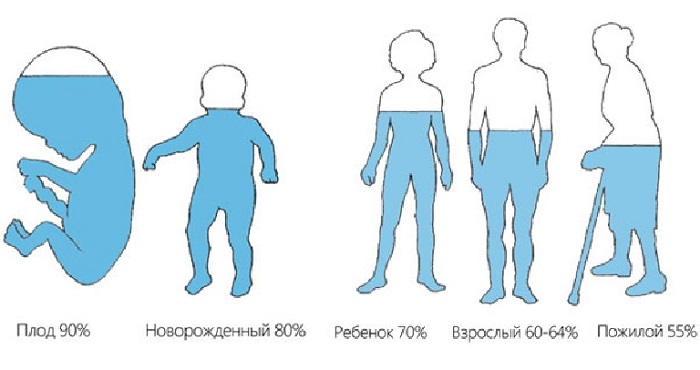
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
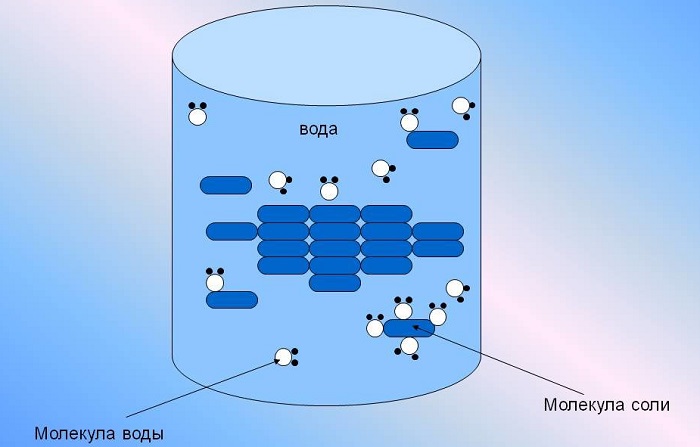
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250 0 С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
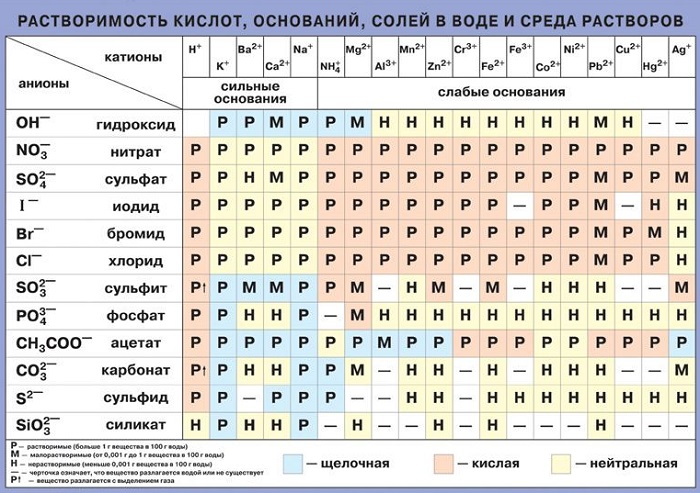
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
К средней степени взаимодействия относятся: бертолетова соль, метан, гипс, кислород, азот, другие химические элементы, например, сульфаты, некоторые газообразные вещества.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.
Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Источник
Глава 12. Органические вещества в водных системах
Органический углерод. Органический углерод является наиболее надежным показателем суммарного содержания органических веществ в природных водах, на него приходится в среднем около 50 % массы органических веществ.
Состав и содержание органических веществ в природных водах определяется совокупностью многих различных по своей природе и скорости процессов: посмертных и прижизненных выделений гидробионтов; поступления с атмосферными осадками, с поверхностным стоком в результате взаимодействия атмосферных вод с почвами и растительным покровом на поверхности водосбора; поступления из других водных объектов, из болот, торфяников; поступления с хозяйственно-бытовыми и промышленными сточными водами.
Концентрация органического углерода подвержена сезонным колебаниям, характер которых определяется гидрологическим режимом водных объектов и связанными с ним сезонными вариациями химического состава, временными изменениями интенсивности биологических процессов. В придонных слоях водоемов и поверхностной пленке содержание органического углерода может значительно отличаться от его содержания в остальной массе воды.
Органические вещества находятся в воде в растворенном, коллоидном и взвешенном состояниях, образующих некоторую динамическую систему, в общем неравновесную, в которой под воздействием физических, химических и биологических факторов непрерывно осуществляются переходы из одного состояния в другое.
Наименьшая концентрация углерода растворенных органических веществ в незагрязненных природных водах составляет около 1 мг/дм 3 , наибольшая обычно не превышает 10–20 мг/дм 3 , однако в болотных водах может достигать нескольких сотен мг/дм 3 .
Углеводороды (нефтепродукты и ароматические углеводороды). В настоящее время поверхность Мирового океана на огромных площадях оказалась покрытой углеводородной пленкой. Причинами этого считают:
– сброс отходов нефтеперегонных заводов (например, только один завод средней мощности дает 400 т отходов сут. –1 );
– сброс балласта и промывка танков нефтевозов после транспортировки (количество нефти, попадающей при этом в воду, в среднем, составляет 1 % от перевозимого груза, т. е. 1–2 Мт год -1 );
– большое число аварий с нефтеналивными судами (только за период с 1967 по 1974 г. произошла 161 авария (Эрхард, 1984), с 1960 по 1970 – около 500 (Рамад, 1981)).
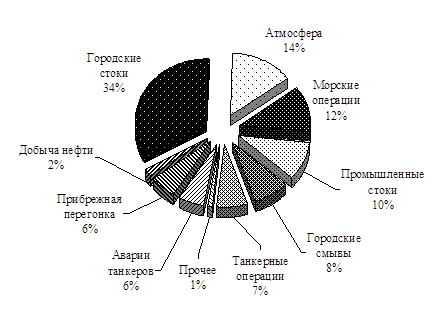
На рисунке 12.1 приведены доли разных антропогенных источников в загрязнении океана нефтепродуктами. Но, необходимо учитывать и то, что нефть – природное вещество и попадает в морскую воду не только в результате техногенной активности, но и с естественными выходами (по разным оценкам от 20 кт до 2 Мт год -1 ).
Рис. 12.1. Антропогенное поступление нефтепродуктов в океаны
(Frid, 2002)
Нефтепродукты относятся к числу наиболее распространенных и опасных веществ, загрязняющих поверхностные воды. Нефть и продукты ее переработки представляют собой чрезвычайно сложную, непостоянную и разнообразную смесь веществ (низко- и высокомолекулярные предельные, непредельные алифатические, нафтеновые, ароматические углеводороды, кислородные, азотистые, сернистые соединения, а также ненасыщенные гетероциклические соединения типа смол, асфальтенов, ангидридов, асфальтеновых кислот). Понятие «нефтепродукты» в гидрохимии условно ограничивается только углеводородной фракцией (алифатические, ароматические, алициклические углеводороды).
Большие количества нефтепродуктов поступают в поверхностные воды при перевозке нефти водным путем, со сточными водами предприятий нефтедобывающей, нефтеперерабатывающей, химической, металлургической и других отраслей промышленности, с хозяйственно-бытовыми водами. Некоторые количества углеводородов поступают в воду в результате прижизненных выделений растительными и животными организмами, а также в результате их посмертного разложения.
В результате протекающих в водоеме процессов испарения, сорбции, биохимического и химического окисления концентрация нефтепродуктов может существенно снижаться, при этом значительным изменениям может подвергаться их химический состав. Наиболее устойчивы ароматические углеводороды, наименее – н-алканы.
Содержание нефтепродуктов в речных, озерных, морских, подземных водах и атмосферных осадках колеблется в довольно широких пределах и обычно составляет сотые и десятые доли мг/дм 3 .
В незагрязненных нефтепродуктами водных объектах концентрация естественных углеводородов может колебаться в морских водах от 0,01 до 0,10 мг/дм 3 и выше, в речных и озерных водах от 0,01 до 0,20 мг/дм 3 , иногда достигая 1–1,5 мг/дм 3 . Содержание естественных углеводородов определяется трофическим статусом водоема и в значительной мере зависит от биологической ситуации в водоеме.
Неблагоприятное воздействие нефтепродуктов сказывается различными способами на организме человека, животном мире, водной растительности, физическом, химическом и биологическом состоянии водоема. Входящие в состав нефтепродуктов низкомолекулярные алифатические, нафтеновые и особенно ароматические углеводороды оказывают токсическое и, в некоторой степени, наркотическое воздействие на организм, поражая сердечно-сосудистую и нервную системы. Наибольшую опасность представляют полициклические конденсированные углеводороды типа 3,4-бензапирена, обладающие канцерогенными свойствами. Нефтепродукты обволакивают оперение птиц, поверхность тела и органы других гидробионтов, вызывая заболевания и гибель.
Отрицательное влияние нефтепродуктов, особенно в концентрациях 0,001–10 мг/дм 3 , и присутствие их в виде пленки сказывается и на развитии высшей водной растительности и микрофитов.
В присутствии нефтепродуктов вода приобретает специфический вкус и запах, изменяется ее цвет, рН, ухудшается газообмен с атмосферой.
ПДКв нефтепродуктов составляет 0,3 мг/дм 3 (лимитирующий показатель вредности – органолептический), ПДКвр – 0,05 мг/дм 3 (лимитирующий показатель вредности – рыбохозяйственный). Присутствие канцерогенных углеводородов в воде недопустимо.
ПАУ. В настоящее время загрязнение полициклическими ароматическими углеводородами (ПАУ) носит глобальный характер. Их присутствие обнаружено во всех элементах природной среды (воздух, почва, вода, биота) от Арктики до Антарктиды.
ПАУ, обладающие выраженными токсическими, мутагенными и канцерогенными свойствами, многочисленны. Их количество достигает 200. Вместе с тем, ПАУ, распространенных повсеместно в биосфере не более нескольких десятков. Это антрацен, флуорантрен, пирен, хризен и некоторые другие.
Наиболее характерным и наиболее распространенным в ряду ПАУ является бенз(а)пирен (БП):
БП хорошо растворим в органических растворителях, тогда как в воде он растворим чрезвычайно мало. Минимальная действующая концентрация бенз(а)пирена мала. БП трансформируется под действием оксигеназ. Продукты трансформации БП являются конечными канцерогенами.
Доля БП в общем количестве наблюдаемых ПАУ невелика (1–20 %). Его делают значимым:
– Активная циркуляция в биосфере
– Высокая молекулярная устойчивость
– Значительная проканцерогенная активность.
С 1977 г. БП на международном уровне считается индикаторным соединением, по содержанию которого оценивается степень загрязненности среды канцерогенными ПАУ.
В формировании природного фона бенз(а)пирена участвуют различные абиотические и биотические источники.
Геологические и астрономические источники. Поскольку ПАУ синтезируются при термических превращениях простых органических структур, БП обнаруживается в:
– гидротермальных образованиях (1–4 мкг кг -1 );
– Вулканических пеплах (до 6 мкг кг -1 ). Глобальный поток вулканического БП достигает 1,2 т год -1 (Израэль, 1989).
Абиотический синтез БП возможен при сгорании органических материалов во время природных пожаров. При горении леса, травяного покрова, торфа образуется до 5 т год -1 . Биотический синтез БП обнаружен для целого ряда анаэробных бактерий, способных синтезировать БП из природных липидов в донных отложениях. Показана возможность синтеза БП и хлореллой.
В современных условиях рост концентрации бенз(а)пирена связан с антропогенным происхождением. Главными источниками БП являются: бытовые, промышленные сбросы, смывы, транспорт, аварии, дальний перенос. Антропогенный поток БП составляет примерно 30 т год -1 .
Кроме того, важный источник поступления БП в водную среду – транспортировка нефти. При этом в воду попадает около 10 т год -1 .
Наибольшее загрязнение БП характерно для бухт, заливов, замкнутых и полузамкнутых морских бассейнов, подверженных антропогенному воздействию (табл. 12.4). Самые высокие уровни загрязнения БП в настоящее время отмечены для Северного, Каспийского, Средиземного и Балтийского морей.
Бенз(а)пирен в донных отложениях. Поступление ПАУ в морскую среду в количестве, превышающем возможности их растворения, влечет за собой сорбцию этих соединений на частицах взвесей. Взвеси оседают на дно и, следовательно, БП накапливаются в донных осадках. При этом основной зоной накопления ПАУ является слой 1–5 см.
Зачастую ПАУ осадков имеют природное происхождение. В этих случаях они приурочены к тектоническим зонам, участкам глубинного термического воздействия, ареалам рассеяния газонефтяных скоплений.
Тем не менее, наиболее высокие концентрации БП обнаруживаются в зонах антропогенного влияния.
ПАУ не только сорбируются на поверхности организмов, но и концентрируются внутриклеточно. Для планктонных организмов характерен высокий уровень накопления ПАУ.
Содержание БП в планктоне может варьировать от нескольких мкг кг -1 до мг кг -1 сухой массы. Наиболее обычное содержание (2–5) 10 2 мкг кг -1 сухой массы. Для Берингова моря коэффициенты накопления (отношение концентрации в организмах к концентрации в воде) в планктоне (Сп/Св) колеблются от 1,6 10 до 1,5 10 4 , коэффициенты накопления в нейстоне (Сн/Св) колеблются от 3,5 10 2 до 3,6 10 3 (Израэль, 1989).
Поскольку большинству бентосных организмов основой питания служит взвешенное органическое вещество и детрит грунтов, зачастую содержащие ПАУ в концентрациях выше, чем в воде, бентонты часто накапливают БП в значительных концентрациях (табл. 12.1). Известно накопление ПАУ полихетами, моллюсками, ракообразными, макрофитами.
Поскольку ПАУ – вещества, встречающиеся в природе, естественно, что существуют микроорганизмы, способные их разрушать. Так, в экспериментах в Северной Атлантике БП-окисляющие бактерии разрушали от 10–67 % внесенного БП. В опытах в Тихом океане была показана способность микрофлоры разрушать 8–30 % внесенного БП. В Беринговом море микроорганизмы разрушали 17–66 % внесенного БП, в Балтийском море – 35–87 %.
Коэффициенты накопления БП в различных объектах экосистемы Балтийского моря (Израэль, 1989)
Для БП доказаны токсичность, канцерогенность, мутагенность, тератогенность, действие на репродуктивную способность рыб. Кроме того, как и другие трудноразложимые вещества, БП способен к биоаккумуляции в пищевых цепях и, соответственно, представляет опасность для человека.
Бензол. Бензол представляет собой бесцветную жидкость с характерным запахом.
В поверхностные воды бензол поступает с предприятий и производств основного органического синтеза, нефтехимической, химико-фармацевтической промышленности, производства пластмасс, взрывчатых веществ, ионообменных смол, лаков и красок, искусственных кож, а также со сточными водами мебельных фабрик. В стоках коксохимических заводов бензол содержится в концентрациях 100–160 мг/дм 3 , в сточных водах производства капролактама – 100 мг/дм 3 , производства изопропилбензола – до 20000 мг/дм 3 . Источником загрязнения акваторий может быть транспортный флот (применяется в моторном топливе для повышения октанового числа). Бензол используется также в качестве ПАВ.
Бензол быстро испаряется из водоемов в атмосферу (период полуиспарения составляет 37,3 минуты при 20°С). Порог ощущения запаха бензола в воде составляет 0,5 мг/дм 3 при 20°С. При 2,9 мг/дм 3 запах характеризуется интенсивностью в 1 балл, при 7,5 мг/дм 3 – в 2 балла. Мясо рыб приобретает неприятный запах при концентрации 10 мг/дм 3 . При 5 мг/дм 3 запах исчезает через сутки, при 10 мг/дм 3 интенсивность запаха за сутки снижается до 1 балла, а при 25 мг/дм 3 запах снижается до 1 балла через двое суток.
Привкус при содержании бензола в воде 1,2 мг/дм 3 измеряется в 1 балл, при 2,5 мг/дм 3 – в 2 балла. Наличие в воде бензола (до 5 мг/дм 3 ) не изменяет процессы биологического потребления кислорода, так как под влиянием биохимических процессов в воде бензол окисляется слабо. В концентрациях 5–25 мг/дм 3 бензол не задерживает минерализации органических веществ, не влияет на процессы бактериального самоочищения водоемов.
В концентрации 1000 мг/дм 3 бензол тормозит самоочищение разведенных сточных вод, а в концентрации 100 мг/дм 3 – процесс очистки сточных вод в аэротенках. При содержании 885 мг/дм 3 бензол сильно задерживает брожение осадка в метантенках.
ПДКв – 0,5 мг/дм 3 (лимитирующий показатель вредности – санитарно-токсикологический), ПДКвр – 0,5 мг/дм 3 (лимитирующий показатель вредности – токсикологический).
Фенолы. Фенолы представляют собой производные бензола с одной или несколькими гидроксильными группами. Их принято делить на две группы – летучие с паром фенолы (фенол, крезолы, ксиленолы, гваякол, тимол) и нелетучие фенолы (резорцин, пирокатехин, гидрохинон, пирогаллол и другие многоатомные фенолы).
Фенолы в естественных условиях образуются в процессах метаболизма водных организмов, при биохимическом распаде и трансформации органических веществ, протекающих как в водной толще, так и в донных отложениях.
Фенолы являются одним из наиболее распространенных загрязнений, поступающих в поверхностные воды со стоками предприятий нефтеперерабатывающей, сланцеперерабатывающей, лесохимической, коксохимической, анилинокрасочной промышленности и др. В сточных водах этих предприятий содержание фенолов может превосходить 10–20 г/дм 3 при весьма разнообразных сочетаниях.
Превышение естественного фона по фенолу может служить указанием на загрязнение водоемов. В загрязненных фенолами природных водах содержание их может достигать десятков и даже сотен микрограммов в 1 дм 3 . Фенолы – соединения нестойкие и подвергаются биохимическому и химическому окислению.
Простые фенолы подвержены главным образом биохимическому окислению. При концентрации более 1 мг/дм 3 разрушение фенолов протекает достаточно быстро, убыль фенолов составляет 50–75 % за трое суток, при концентрации несколько десятков микрограммов в 1 дм 3 этот процесс замедляется, и убыль за то же время составляет 10–15 %. Быстрее всех разрушается собственно фенол, медленнее крезолы, еще медленнее ксиленолы. Многоатомные фенолы разрушаются в основном путем химического окисления.
Концентрация фенолов в поверхностных водах подвержена сезонным изменениям. В летний период содержание фенолов падает (с ростом температуры увеличивается скорость распада).
Сброс фенольных вод в водоемы и водотоки резко ухудшает их общее санитарное состояние, оказывая влияние на живые организмы не только своей токсичностью, но и значительным изменением режима биогенных элементов и растворенных газов (кислорода, углекислого газа).
В результате хлорирования воды, содержащей фенолы, образуются устойчивые соединения хлорфенолов, малейшие следы которых (0,1 мкг/дм 3 ) придают воде характерный привкус.
В токсикологическом и органолептическом отношении фенолы неравноценны. Летучие с паром фенолы более токсичны и обладают более интенсивным запахом при хлорировании. Наиболее резкие запахи дают простой фенол и крезолы.
ПДКв для фенола установлена 0,001 мг/дм 3 (лимитирующий показатель вредности – органолептический), ПДКвр – 0,001 мг/дм 3 (лимитирующий показатель вредности – рыбохозяйственный).
Спирты. Метанол. Метанол попадает в водоемы со сточными водами производств получения и применения метанола. В сточных водах предприятий целлюлозно-бумажной промышленности содержится 4,5–58 г/дм 3 метанола, производств фенолоформальдегидных смол – 20–25 г/дм 3 , лаков и красок 2 г/дм 3 , синтетических волокон и пластмасс – до 600 мг/дм 3 , в сточных водах генераторных станций работающих на буром, каменном угле, торфе, древесине – до 5 г/дм 3 .
При попадании в воду метанол снижает содержание в ней О2 (вследствие окисления метанола). Концентрация выше 4 мг/дм 3 влияет на санитарный режим водоемов. При содержании 200 мг/дм 3 наблюдается торможение биологической очистки сточных вод. Порог восприятия запаха метанола составляет 30–50 мг/дм 3 .
Концентрация 3 мг/дм 3 стимулирует рост сине-зеленых водорослей и нарушает потребление кислорода дафниями. Летальные концентрации для рыб составляют 0,25–17 г/дм 3 .
Метанол является сильным ядом, обладающим направленным действием на нервную и сердечно-сосудистую системы, зрительные нервы, сетчатку глаз. Механизм действия метанола связан с его метаболизмом по типу летального синтеза с образованием формальдегида и муравьиной кислоты, далее окисляющихся до СО2. Поражение зрения обусловлено снижением синтеза АТФ в сетчатке глаза.
ПДКв – 3 мг/дм 3 (лимитирующий показатель вредности – санитарно-токсикологический), ПДКвр – 0,1 мг/дм 3 (лимитирующий показатель вредности – санитарно-токсикологический).
Этиленгликоль. Этиленгликоль попадает в поверхностные воды со сточными водами производств, где он получается или применяется (текстильная, фармацевтическая, парфюмерная, табачная, целлюлозно-бумажная промышленности).
Токсическая концентрация для рыб составляет не более 10 мг/дм 3 , для кишечной палочки – 0,25 мг/дм 3 .
Этиленгликоль очень токсичен. При попадании в желудок действует главным образом на ЦНС и почки, а также вызывает гемолиз эритроцитов. Токсичны и метаболиты этиленгликоля – альдегиды и щавелевая кислота, обусловливающая образование и накопление в почках оксалатов кальция.
ПДКв – 1,0 мг/дм 3 (лимитирующий показатель вредности – санитарно-токсикологический), ПДКвр – 0,25 мг/дм 3 (лимитирующий показатель вредности – санитарно-токсикологический).
Органические кислоты. Органические кислоты относятся к числу наиболее распространенных компонентов природных вод различного происхождения и нередко составляют значительную часть всего органического вещества в этих водах. Состав органических кислот и их концентрация определяются с одной стороны внутриводоемными процессами, связанными с жизнедеятельностью водорослей, бактерий и животных организмов, с другой – поступлением этих веществ извне.
Органические кислоты образуются за счет следующих внутриводоемных процессов:
– прижизненных выделений в результате нормальных физиологических процессов здоровых клеток;
– посмертных выделений, связанных с отмиранием и распадом клеток;
– выделений сообществами, связанных с биохимическим взаимодействием различных организмов, например водорослей и бактерий;
– ферментативного разложения высокомолекулярных органических веществ типа углеводородов, протеинов и липидов.
Поступление органических кислот в водные объекты извне возможно с поверхностным стоком, особенно в период половодья и паводков, с атмосферными осадками, промышленными и хозяйственно-бытовыми сточными водами и с водами, сбрасываемыми с орошаемых полей.
Данные о содержании и составе органических кислот необходимы при изучении процессов химического выветривания, миграции элементов, образования осадочных пород, а также при решении вопросов о взаимоотношении водных организмов со средой, поскольку органические кислоты служат одним из источников углерода и энергии для большинства этих организмов.
Концентрация органических кислот в речных водах колеблется от n·10 до n·10 2 ммоль/дм 3 . Амплитуда внутригодовых колебаний достигает нередко многих сотен процентов. Ряд высших жирных кислот присутствуют в природных водах в очень незначительных концентрациях. Концентрации пропионовой и уксусной кислот колеблются от n·10 до n·10 2 мкг/дм 3 .
Летучие кислоты. Под летучими кислотами понимают сумму концентраций муравьиной и уксусной кислот.
В природных водах в небольших количествах муравьиная кислота образуется в процессах жизнедеятельности и посмертного разложения водных организмов и биохимической трансформации содержащихся в воде органических веществ. Ее повышенная концентрация связана с поступлением в водные объекты сточных вод предприятий, производящих формальдегид и пластические массы на его основе.
Муравьиная кислота мигрирует главным образом в растворенном состоянии, в виде ионов и недиссоциированных молекул, количественное соотношение между которыми определяется константой диссоциации К25°С = 2,4 . 10 -4 и значениями рН. При поступлении муравьиной кислоты в водные объекты она разрушается главным образом под влиянием биохимических процессов.
В незагрязненных речных и озерных водах муравьиная кислота обнаружена в концентрациях 0–830 мкг/дм 3 , в снеговых – 46–78 мкг/дм 3 , в грунтовых – до 235 мкг/дм 3 , в морских – до 680 мкг/дм 3 . Концентрация муравьиной кислоты подвержена заметным сезонным колебаниям, что определяется главным образом интенсивностью биохимических процессов, протекающих в воде.
ПДКв – 3,5 мг/дм 3 (лимитирующий показатель вредности – общесанитарный), ПДКвр – 1,0 мг/дм 3 (лимитирующий показатель вредности – токсикологический).
ПДКв уксусной кислоты составляет 1,0 мг/дм 3 (лимитирующий показатель вредности – общесанитарный), ПДКвр – 0,01 мг/дм 3 (лимитирующий показатель вредности – токсикологический).
Гумусовые кислоты. Гуминовые и фульвокислоты, объединяемые под названием гумусовые кислоты, нередко составляют значительную долю органического вещества природных вод и представляют собой сложные смеси биохимически устойчивых высокомолекулярных соединений.
Главным источником поступления гумусовых кислот в природные воды являются почвы и торфяники, из которых они вымываются дождевыми и болотными водами. Значительная часть гумусовых кислот вносится в водоемы вместе с пылью и образуется непосредственно в водоеме в процессе трансформации «живого органического вещества».
Гумусовые кислоты в поверхностных водах находятся в растворенном, взвешенном и коллоидном состояниях, соотношения между которыми определяются химическим составом вод, рН, биологической ситуацией в водоеме и другими факторами.
Наличие в структуре фульво- и гуминовых кислот карбоксильных и фенолгидроксильных групп, аминогрупп способствует образованию прочных комплексных соединений гумусовых кислот с металлами. Некоторая часть гумусовых кислот находится в виде малодиссоциированных солей – гуматов и фульватов. В кислых водах возможно существование свободных форм гуминовых и фульвокислот.
Гумусовые кислоты в значительной степени влияют на органолептические свойства воды, создавая неприятный вкус и запах, затрудняют дезинфекцию и получение особо чистой воды, ускоряют коррозию металлов. Они оказывают влияние также на состояние и устойчивость карбонатной системы, ионные и фазовые равновесия и распределение миграционных форм микроэлементов. Повышенное содержание гумусовых кислот может оказывать отрицательное влияние на развитие водных растительных и животных организмов в результате резкого снижения концентрации растворенного кислорода в водоеме, идущего на их окисление, и их разрушающего влияния на устойчивость витаминов. В то же время при разложении гумусовых кислот образуется значительное количество ценных для водных организмов продуктов, а их органоминеральные комплексы представляют наиболее легко усваиваемую форму питания растений микроэлементами.
Почвенные кислоты: гуминовые (в щелочной среде) и особенно хорошо растворимые фульвокислоты играют наибольшую роль в миграции тяжелых металлов.
Гуминовые кислоты содержат циклические структуры и различные функциональные группы (гидроксильные, карбонильные, карбоксильные, аминогруппы и др.). Молекулярная масса их колеблется в широком интервале (от 500 до 200 000 и более). Относительная молекулярная масса условно принимается равной 1300–1500.
Содержание гуминовых кислот в поверхностных водах обычно составляет десятки и сотни микрограммов в 1 дм 3 по углероду, достигая нескольких миллиграммов в 1 дм 3 в природных водах лесных и болотистых местностей, придавая им характерный бурый цвет. В воде многих рек гуминовые кислоты не обнаруживаются.
Фульвокислоты являются частью гумусовых кислот, не осаждающихся при нейтрализации из раствора органических веществ, извлеченных из торфов и бурых углей обработкой щелочью. Фульвокислоты представляют соединения типа оксикарбоновых кислот с меньшим относительным содержанием углерода и более выраженными кислотными свойствами.
Хорошая растворимость фульвокислот по сравнению с гуминовыми кислотами является причиной их более высоких концентраций и распространения в поверхностных водах. Содержание фульвокислот, как правило, превышает содержание гуминовых кислот в 10 раз и более.
Азот органический. Под «органическим азотом» понимают азот, входящий в состав органических веществ, таких, как протеины и протеиды, полипептиды (высокомолекулярные соединения), аминокислоты, амины, амиды, мочевина (низкомолекулярные соединения).
Значительная часть азотсодержащих органических соединений поступает в природные воды в процессе отмирания организмов, главным образом фитопланктона, и распада их клеток. Концентрация этих соединений определяется биомассой гидробионтов и скоростью указанных процессов. Другим важным источником азотсодержащих органических веществ являются прижизненные их выделения водными организмами. К числу существенных источников азотсодержащих соединений относятся также атмосферные осадки, в которых концентрация азотсодержащих органических веществ близка к наблюдающейся в поверхностных водах. Значительное повышение концентрации этих соединений нередко связано с поступлением в водные объекты промышленных, сельскохозяйственных и хозяйственно-бытовых сточных вод.
На долю органического азота приходится 50–75 % общего растворенного в воде азота. Концентрация органического азота подвержена значительным сезонным изменениям с общей тенденцией к увеличению в вегетационный период (1,5–2,0 мг/дм 3 ) и уменьшению в период ледостава (0,2–0,5 мг/дм 3 ). Распределение органического азота по глубине неравномерно – повышенная концентрация наблюдается, как правило, в зоне фотосинтеза и в придонных слоях воды.
Амины. К основным источникам образования и поступления в природные воды аминов следует отнести:
– декарбоксилирование при распаде белковых веществ под воздействием декарбоксилаз бактерий и грибов и аминирование;
– сточные воды анилино-красочных предприятий.
Амины присутствуют преимущественно в растворенном и отчасти в сорбированном состоянии. С некоторыми металлами они могут образовывать довольно устойчивые комплексные соединения. Концентрация аминов в воде рек, водохранилищ, озер, атмосферных осадках колеблется в пределах 10 – 200 мкг/дм 3 . Более низкое содержание характерно для малопродуктивных водных объектов.
Амины токсичны. Обычно принято считать, что первичные алифатические амины токсичнее вторичных и третичных, диамины токсичнее моноаминов; изомерные алифатические амины более токсичны, чем алифатические амины нормального строения; моноамины с большей вероятностью обладают гепатотоксичностью, а диамины – нефротоксичностью. Наибольшей токсичностью и потенциальной опасностью среди алифатических аминов характеризуются непредельные амины из-за наиболее выраженной у них способности угнетать активность аминооксидаз.
Амины, присутствуя в водных объектах, отрицательно влияют на органолептические свойства воды, могут усугублять заморные явления. ПДКв для различных видов аминов – от 0,01 до 170 мг/дм 3 .
Сера органическая. Метилмеркаптан является продуктом метаболизма живых клеток. Он также поступает со стоками предприятий целлюлозной промышленности (0,05 – 0,08 мг/дм 3 ).
В водном растворе метилмеркаптан является слабой кислотой и частично диссоциирует (степень диссоциации зависит от рН среды). При рН 10,5 50 % метилмеркаптана находится в ионной форме, при рН 13 происходит полная диссоциация. Метилмеркаптан стабилен менее 12 часов, образует соли – меркаптиды. ПДКв – 0,0002 мг/дм 3 (лимитирующий показатель вредности – органолептический).
Диметилсульфид выделяется водорослями (Oedogonium, Ulothrix) в ходе нормальных физиологических процессов, имеющих существенное значение в круговороте серы. В поверхностные воды диметилсульфид может поступать также со стоками предприятий целлюлозной промышленности (0,05 – 0,08 мг/дм 3 ). Концентрация диметилсульфида в морях достигает n·10 -5 мг/дм 3 (повышенное содержание наблюдается в местах скопления водорослей).
Диметилсульфид не может долго сохраняться в воде водоемов (стабилен от 3 до 15 суток). Он частично подвергается превращениям при участии водорослей и микроорганизмов, а в основном испаряется в воздух.
В концентрациях 1–10 мкг/дм 3 диметилсульфид обладает слабой мутагенной активностью. ПДКв – 0,01 мг/дм 3 (лимитирующий показатель вредности – органолептический), ПДКвр – 0,00001 мг/дм 3 (лимитирующий показатель вредности – токсикологический).
Карбонильные соединения. К карбонильным относятся соединения, содержащие карбонильные и карбоксильные группы (альдегиды, кетоны, кетокислоты, полуфункциональные карбонилсодержащие вещества).
В природных водах карбонильные соединения могут появляться в результате прижизненных выделений водорослей, биохимического и фотохимического окисления спиртов и органических кислот, распада органических веществ типа лигнина, обмена веществ бактериобентоса. Постоянное присутствие карбонильных соединений среди кислородных соединений нефти и в воде, контактирующей с залежами углеводородов, позволяет рассматривать последние в качестве одного из источников обогащения природных вод этими веществами. Источником карбонильных соединений являются также наземные растения, в которых образуются альдегиды и кетоны алифатического ряда и фурановые производные. Значительная часть альдегидов и кетонов поступает в природные воды в результате деятельности человека.
Основными факторами, обусловливающими уменьшение концентрации карбонильных соединений, являются их способность к окислению, летучесть и относительно высокая трофическая ценность отдельных групп карбонилсодержащих веществ.
В поверхностных водах карбонильные соединения находятся в основном в растворенной форме. Средняя концентрация их в воде рек и водохранилищ колеблется от 1 до 6 мкмоль/дм 3 , несколько выше она (6–40 мкмоль/дм 3 ) в озерах дистрофного типа. Максимальные концентрации в водах нефтяных и газонефтяных залежей – 40–100 мкмоль/дм 3 .
В воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования нормируются отдельные соединения с карбонильной группой: циклогексанон ПДКв – 0,2 мг/дм 3 (лимитирующий показатель вредности – санитарно-токсикологический), формальдегид ПДКв – 0,05 мг/дм 3 (лимитирующий показатель вредности – санитарно-токсикологический).
Ацетон. В природные воды ацетон поступает со сточными водами фармацевтических, лесохимических производств, производства лаков и красок, пластмасс, кинопленки, ацетилена, ацетальдегида, уксусной кислоты, оргстекла, фенола, ацетона.
В концентрациях 40–70 мг/дм 3 ацетон придает воде запах, 80 мг/дм 3 – привкус. В воде ацетон малостабилен – при концентрациях 20 мг/дм 3 на седьмые сутки исчезает.
Для водных организмов ацетон сравнительно малотоксичен. Токсические концентрации для молодых дафний составляют 8300, для взрослых – 12900 мг/дм 3 ; при 9300 мг/дм 3 дафнии гибнут через 16 часов.
Ацетон – наркотик, поражающий все отделы ЦНС. Кроме того, он оказывает эмбриотоксическое действие. ПДКв – 2,2 мг/дм 3 (лимитирующий показатель вредности – общесанитарный), ПДКвр – 0,05 мг/дм 3 (лимитирующий показатель вредности – токсикологический).
Формальдегид. Формальдегид поступает в водную среду с промышленными и коммунальными сточными водами. Он содержится в сточных водах производств основного органического синтеза, пластмасс, лаков, красок, лекарственных препаратов, предприятий кожевенной, текстильной и целлюлозно-бумажной промышленности.
В дождевой воде городских районов зарегистрировано присутствие формальдегида. Формальдегид – сильный восстановитель. Он конденсируется с аминами, с аммиаком образует уротропин. В водной среде формальдегид подвергается биодеградации. В аэробных условиях при 20°С разложение продолжается около 30 часов, в анаэробных – примерно 48 часов. В стерильной воде формальдегид не разлагается. Биодеградация в водной среде обусловлена действием Pseudomonas, Flavobacterium, Mycobacterium, Zanthomonas.
Подпороговая концентрация, не влияющая на санитарный режим водоемов и сапрофитную микрофлору, составляет 5 мг/дм 3 ; максимальная концентрация, не вызывающая при постоянном воздействии в течение сколь угодно длительного времени нарушение биохимических процессов, – 5 мг/дм 3 , максимальная концентрация, не влияющая на работу биологических очистных сооружений, – 1000 мг/дм 3 .
При 10 мг/дм 3 формальдегид оказывает токсическое действие на наиболее чувствительные виды рыб. При 0,24 мг/дм 3 ткани рыб приобретают неприятный запах.
Формальдегид оказывает общетоксическое действие, вызывает поражение ЦНС, легких, печени, почек, органов зрения. Возможно кожно-резорбтивное действие. Формальдегид обладает раздражающим, аллергенным, мутагенным, сенсибилизирующим, канцерогенным действием.
ПДКв – 0,05 мг/дм 3 (лимитирующий показатель вредности – санитарно-токсикологический), ПДКвр – 0,25 мг/дм 3 (лимитирующий показатель вредности – токсикологичекий).
Углеводы. Под углеводами понимают группу органических соединений, которая объединяет моносахариды, их производные и продукты конденсации – олигосахариды и полисахариды. В поверхностные воды углеводы поступают главным образом вследствие процессов прижизненного выделения водными организмами и их посмертного разложения. Значительные количества растворенных углеводов попадают в водные объекты с поверхностным стоком в результате вымывания их из почв, торфяников, горных пород, с атмосферными осадками, со сточными водами дрожжевых, пивоваренных, сахарных, целлюлозно-бумажных и других заводов.
В поверхностных водах углеводы находятся в растворенном и взвешенном состоянии в виде свободных редуцирующих сахаров (смесь моно, ди- и трисахаридов) и сложных углеводов.
Концентрация в речных водах свободных редуцирующих сахаров и сложных углеводов в пересчете на глюкозу составляет 100–600 и 250–1000 мкг/дм 3 . В воде водохранилищ концентрация их соответственно равна 100–400 и 200–300 мкг/дм 3 , в воде озер пределы возможных концентраций редуцирующих сахаров 80–65000 мкг/дм 3 и сложных углеводов 140–6900 мкг/дм 3 – более широки, чем в реках и водохранилищах. В морских водах суммарная концентрация углеводов составляет 0–8 мг/дм 3 , в атмосферных осадках 0–4 мг/дм 3 . Наблюдается корреляция между содержанием углеводов и интенсивностью развития фитопланктона.
Жиры. Жиры представляют собой полные сложные эфиры глицерина и жирных кислот (стеариновой, пальмитиновой, олеиновой).
Жиры, присутствующие в природных водах, являются главным образом результатом метаболизма растительных и животных организмов и их посмертного разложения. Жиры образуются при фотосинтезе и биосинтезе и входят в состав внутриклеточных и резервных липидов. Высокие концентрации жиров в воде связаны со сбросом в водные объекты сточных вод предприятий пищевой и кожевенной промышленности, а также хозяйственно-бытовых сточных вод. Понижение содержания жиров в природных водах связано с процессами их ферментативного гидролиза и биохимического окисления.
Жиры находятся в поверхностных водах в растворенном, эмульгированном и сорбированном взвешенными веществами и донными отложениями состояниях. Они входят в состав более растворимых сложных соединений с белками и углеводами, которые находятся в воде как в растворенном, так и в коллоидном состояниях.
Попадая в водный объект в повышенных концентрациях, жиры ухудшают его кислородный режим, органолептические свойства воды, стимулируют развитие микрофлоры.
Содержание жиров в поверхностных водах колеблется от сотых долей миллиграмма до нескольких миллиграммов в 1 дм 3 .
Синтетические поверхностно-активные вещества (СПАВ). СПАВ представляют собой обширную группу соединений, различных по своей структуре, относящихся к разным классам. Эти вещества способны адсорбироваться на поверхности раздела фаз и понижать вследствие этого поверхностную энергию (поверхностное натяжение). В зависимости от свойств, проявляемых СПАВ при растворении в воде, их делят на анионоактивные вещества (активной частью является анион), катионоактивные (активной частью молекул является катион), амфолитные и неионогенные, которые совсем не ионизируются.
Анионоактивные СПАВ в водном растворе ионизируются с образованием отрицательно заряженных органических ионов. Из анионоактивных СПАВ широкое применение нашли соли сернокислых эфиров (сульфаты) и соли сульфокислот (сульфонаты). Радикал R может быть алкильным, алкиларильным, алкилнафтильным, иметь двойные связи и функциональные группы.
Катионоактивные СПАВ – вещества, которые ионизируются в водном растворе с образованием положительно заряженных органических ионов. К ним относятся четвертичные аммониевые соли, состоящие из: углеводородного радикала с прямой цепью, содержащей 12–18 атомов углерода; метильного, этильного или бензильного радикала; хлора, брома, иода или остатка метил- или этилсульфата.
Амфолитные СПАВ ионизируются в водном растворе различным образом в зависимости от условий среды: в кислом растворе проявляют катионоактивные свойства, а в щелочном – анионоактивные.
Неионогенные СПАВ представляют собой высокомолекулярные соединения, которые в водном растворе не образуют ионов.
В водные объекты СПАВ поступают в значительных количествах с хозяйственно-бытовыми (использование синтетических моющих средств в быту) и промышленными сточными водами (текстильная, нефтяная, химическая промышленность, производство синтетических каучуков), а также со стоком с сельскохозяйственных угодий (в качестве эмульгаторов входят в состав инсектицидов, фунгицидов, гербицидов и дефолиантов).
Главными факторами понижения их концентрации являются процессы биохимического окисления, сорбция взвешенными веществами и донными отложениями. Степень биохимического окисления СПАВ зависит от их химического строения и условий окружающей среды.
По биохимической устойчивости, определяемой структурой молекул, СПАВ делят на мягкие, промежуточные и жесткие с константами скорости биохимического окисления, соответственно не менее 0,3 сутки -1 ; 0,3–0,05 сутки -1 ; менее 0,05 сутки -1 . К числу наиболее легко окисляющихся СПАВ относятся первичные и вторичные алкилсульфаты нормального строения. С увеличением разветвления цепи скорость окисления понижается, и наиболее трудно разрушаются алкилбензолсульфонаты, приготовленные на основе тетрамеров пропилена.
При понижении температуры скорость окисления СПАВ уменьшается и при 0–5°С протекает весьма медленно. Наиболее благоприятные для процесса самоочищения от СПАВ нейтральная или слабощелочная среды (рН 7–9).
С повышением содержания взвешенных веществ и значительным контактом водной массы с донными отложениями скорость снижения концентрации СПАВ в воде обычно повышается за счет сорбции и соосаждения. При значительном накоплении СПАВ в донных отложениях в аэробных условиях происходит окисление микрофлорой донного ила. В случае анаэробных условий СПАВ могут накапливаться в донных отложениях и становиться источником вторичного загрязнения водоема.
Максимальные количества кислорода (БПК), потребляемые 1 мг/дм 3 различных ПАВ колеблется от 0 до 1,6 мг/дм 3 . При биохимическом окислении СПАВ, образуются различные промежуточные продукты распада: спирты, альдегиды, органические кислоты и др. В результате распада СПАВ, содержащих бензольное кольцо, образуются фенолы.
В поверхностных водах СПАВ находятся в растворенном и сорбированном состоянии, а также в поверхностной пленке воды водного объекта. В слабозагрязненных поверхностных водах концентрация СПАВ колеблется обычно в пределах тысячных и сотых долей миллиграмма в 1 дм 3 . В зонах загрязнения водных объектов концентрация повышается до десятых долей миллиграмма, вблизи источников загрязнения может достигать нескольких миллиграммов в 1 дм 3 .
Попадая в водоемы и водотоки, СПАВ оказывают значительное влияние на их физико-биологическое состояние, ухудшая кислородный режим и органолептические свойства, и сохраняются там долгое время, так как разлагаются очень медленно. Отрицательным, с гигиенической точки зрения, свойством ПАВ является их высокая пенообразующая способность. Хотя СПАВ не являются высокотоксичными веществами, имеются сведения о косвенном их воздействии на гидробионтов. При концентрациях 5–15 мг/дм 3 рыбы теряют слизистый покров, при более высоких концентрациях может наблюдаться кровотечение жабр.
ПДКв СПАВ составляет 0,5 мг/дм 3 , ПДКвр – 0,1 мг/дм 3 .
Смолистые вещества. Некоторые растения вырабатывают сложные по химическому составу смолистые вещества. Наиболее токсичны для рыб и представителей планктона смолистые вещества, выделяемые хвойными породами (сосна, ель).
Смолистые вещества поступают в поверхностные воды в результате лесосплава, а также со стоками гидролизной промышленности (переработка непищевого растительного сырья).
ПДКвр для смолистых веществ, вымываемых из хвойных пород древесины – ниже 2 мг/дм 3 (лимитирующий показатель вредности – токсикологический).
Водорастворимый сульфатный лигнин. Лигнин представляет собой высокомолекулярное соединение ароматической природы. Различают три класса лигнинов: лигнин хвойной древесины, лиственной древесины и травянистых растений. Общей структурной единицей всех видов лигнина является фенилпропан. Различия связаны с разным содержанием функциональных групп. В растворенной форме сульфатный лигнин поступает в поверхностные водоемы со сточными водами предприятий целлюлозно-бумажной промышленности (сульфатная варка целлюлозы).
Важнейшим свойством лигнина является его склонность к реакциям конденсации. В природных водах лигнин разрушается примерно через 200 суток. При разложении лигнина появляются токсичные низкомолекулярные продукты распада (фенолы, метанол, карбоновые кислоты).
ПДКв – 5 мг/дм 3 (лимитирующий показатель вредности – органолептический), ПДКвр – 2 мг/дм 3 (лимитирующий показатель вредности – токсикологический).
Хлорорганические соединения. Хлорорганические соединения относят к суперэкотоксикантам – чужеродным веществам, которые отличаются уникальной биологической активностью, распространяются в окружающей среде далеко за пределы своего первоначального местонахождения и уже на уровне микропримесей оказывают негативное воздействие на живые организмы.
К хлорорганическим соединениям относят полихлорированные диоксины, дибензофураны, бифенилы, а также хлорорганические пестициды.
Диоксины хорошо растворимы в органических растворителях и практически нерастворимы в воде. Среди других характеристик диоксинов следует указать на их высокую адгезионную способность, в том числе к почве, частичкам золы, донным отложениям, что способствует их накоплению и миграции в виде комплексов с органическими веществами и поступлению в воздух, воду и пищевые продукты.
Однако опасность диоксинов состоит не столько в острой токсичности, сколько в кумулятивном действии и отдаленных последствиях. В настоящее время признано недопустимым присутствие диоксинов в продуктах питания, воздухе и питьевой воде. Однако достичь этого при наличии в окружающей среде больших количеств указанных ксенобиотиков практически невозможно. Поэтому санитарно-гигиеническими службами и органами охраны природы большинства развитых стран установлены нормы допустимого поступления диоксинов в организм человека, а также предельно-допустимые концентрации или уровни их содержания в различных средах.
Хлорированные бифенилы (трихлордифенил, бихлордифенил). В воду хлорированные бифенилы попадают главным образом за счет сброса промышленных отходов в реки, а также из отбросов судов. Они накапливаются в иловых отложениях водоемов (в воде рек и лиманов содержится 50–500 мг/дм 3 ).
В почву хлорированные бифенилы попадают при использовании ила в качестве удобрения и с полей орошения.
Снижение содержания их в почве происходит благодаря испарению и биотрансформации: период полуразложения около 5 лет.
Хлорированные бифенилы обнаружены во всех объектах окружающей среды и всех звеньях биологических цепей, в частности, яйцах птиц; они весьма устойчивы к воздействию факторов окружающей среды.
Хлорированные бифенилы – высокотоксичные соединения, поражающие печень и почки. Их хроническое действие сходно с действием хлорпроизводных нафталина. Они вызывают порфирию: активируют микросомные ферменты печени. С повышением содержания хлора в молекуле хлорбифенилов это последнее свойство усиливается.
Хлорбифенилы обладают эмбриотоксическим действием. По-видимому, токсическое действие хлорированных бифенилов связано с образованием высокотоксичных полихлордибензофуранов и полихлордибензодиоксинов. Медленно накапливаются в организме. Хлорированные бифенилы оказывают выраженное влияние на репродуктивную функцию.
Пестициды. К пестицидам относят химические вещества, применяемые для борьбы с различными вредными организмами: растительноядными клещами (акарициды), насекомыми (инсектициды), бактериями (бактерициды), высшими растениями (гербициды), грибами (фунгициды), моллюсками (лимациды), круглыми червями (нематоциды), паразитическими червями у животных (антигельминты), тлей (афицид), личинками и гусеницами (ларвициды) и др. В эту группу веществ обычно включают и антисептики, применяемые для предохранения неметаллических материалов от разрушения микроорганизмами, а также вещества, употребляемые для предуборочного удаления листьев с растений (дефолианты), вызывающие обезвоживание тканей растений, что ускоряет их созревание и облегчает уборку урожая (десиканты), предпосевную обработку семян (протравители семян) и др.
Пестициды подразделяются на два основных класса: хлорорганические и фосфорорганические. Хлорорганические пестициды представляют собой хлорпроизводные многоядерных углеводородов (ДДТ), циклопарафинов (гексахлорциклогексан), соединения диенового ряда (гептахлор), алифатических карбоновых кислот (пропанид) и др.
Важнейшей отличительной чертой большинства хлорорганических соединений является стойкость к воздействию различных факторов окружающей среды (температура, солнечная радиация, влага и др.) и нарастание концентрации их в последующих звеньях биологической цепи (например, содержание ДДТ в гидробионтах может превышать содержание его в воде на один–два порядка). Хлорорганические инсектициды обладают значительно большей токсичностью для рыб.
Фосфорорганические пестициды представляют собой сложные эфиры: фосфорной кислоты – диметилдихлорвинилфосфат (ДДВФ); тиофосфорной – метафос, метилнитрофос; дитиофосфорной – карбофос, рогор; фосфоновой – хлорофос. Преимуществом фосфорорганических пестицидов является их относительно малая химическая и биологическая устойчивость. Большая часть их разлагается в растениях, почве, воде в течение одного месяца, но отдельные инсектициды и акарициды внутрирастительного действия (рогор, сейфос и др.) могут сохраняться в течение года.
Некоторые химические препараты могут действовать на вредные организмы только при непосредственном контакте (контактные пестициды). Для проявления действия такой препарат обязательно должен войти в непосредственное соприкосновение с объектом воздействия. Контактные гербициды должны, например, иметь контакт со всеми частями уничтожаемого растения, в противном случае возможно отрастание сорных растений. Контактные инсектициды в большинстве случаев проявляют свое действие при соприкосновении с любой частью тела насекомого. Системные пестициды способны передвигаться по сосудистой системе растения и в ряде случаев, по сосудистой системе животного. Они часто оказываются более эффективными, чем препараты контактного действия. Механизм действия системных фунгицидов в большинстве случаев существенно отличается от такового для инсектицидов. Если инсектициды поражают сосущих членистоногих в результате попадания яда в организм вредителя, то фунгициды в основном способствуют повышению устойчивости растения к данному виду заболевания.
Основным источником поступления пестицидов в водные объекты является поверхностный сток талых, дождевых и грунтовых вод с сельскохозяйственных угодий, коллекторно-дренажные воды, сбрасываемые с орошаемых территорий. Пестициды также могут вноситься в водные объекты во время их обработки с целью уничтожения нежелательных водных растений и других гидробионтов, со сточными водами промышленных предприятий, производящих ядохимикаты, непосредственно при обработке полей пестицидами с помощью авиации, при небрежной транспортировке их водным транспортом и при хранении. Несмотря на большой вынос стойких пестицидов в водную среду, содержание их в природных водах относительно невелико из-за быстрой кумуляции пестицидов гидробионтами и отложения в илах. Коэффициенты кумуляции (во сколько раз содержание химического вещества больше в гидробионтах, чем в воде) составляют от 3–10 до 1000–500000 раз.
В поверхностных водах пестициды могут находиться в растворенном, взвешенном и сорбированном состояниях. Хлорорганические пестициды содержатся в поверхностных водах обычно в концентрациях n·10 -5 -n·10 -3 мг/дм 3 , фосфорорганические – n·10 -3 -n·10 -2 мг/дм 3 .
Гербициды. Рамрод (ацилид, нитицид, шатецид, пропахлор). Рамрод – гербицид, представляющий собой белое кристаллическое вещество с периодом разложения в почве до нетоксичных продуктов – до 2-х месяцев.
Рамрод используется для борьбы с сорными растениями при возделывании капусты, лука, брюквы, турнепса, чеснока, кукурузы и некоторых других культур. ПДКв – 0,01 мг/дм 3 , в рыбохозяйственных водоемах содержание препарата не допускается.
Сатурн (рисан, болеро, тиобенкарб, бентиокарб). Сатурн – гербицид, применяемый для борьбы с просовидными сорными растениями при возделывании риса.
Препарат представляет собой светлую труднорастворимую в воде жидкость, нетоксичную для пчел и других насекомых. Меры предосторожности при использовании сатурна – как со среднетоксичными пестицидами. ПДКв – 0,05 мг/дм 3 , ПДКвр – 0,0002 мг/дм 3 .
Симазин (аквазин, гезатоп, принцеп). Симазин – гербицид, применяемый для уничтожения сорняков в посевах кукурузы, в садах, виноградниках, на плантациях чая. Это белое кристаллическое вещество, легко гидролизуемое в воде с образованием циануровой кислоты. Меры предосторожности при использовании симазина – как с малотоксичными пестицидами.
Симазин обладает широким спектром действия на однолетние сорные растения и большой продолжительностью сохранения в почве. В нашей стране симазин рекомендован на кукурузе, озимой пшенице и ржи, на картофеле, землянике, крыжовнике, малине и др. В больших дозах симазин может быть использован для сплошного уничтожения растений на несельскохозяйственных участках (территории железных дорог и аэродромов). В почве симазин сохраняется длительное время.
Симазин практически нетоксичен для птиц и пчел. Содержание препарата в водоемах хозяйственно-питьевого и культурно-бытового назначения не допускается, ПДКвр – 0,0024 мг/дм 3 .
Инсектициды. Альдрин (аглюкон, вератокс, ГГДН, картофин, окталин, соединение 118). Альдрин – инсектицид, отличающийся большой устойчивостью, кумулятивностью и токсичностью. Это сильнодействующее ядовитое вещество, которое поражает внутренние органы (печень, почки). В РФ применение альдрина не разрешено.
Ранее альдрин широко использовался для протравливания семян и опрыскивания хлопчатника. В почве, растениях, в организме насекомых и позвоночных альдрин метаболизируется с образованием дильдрина. В почве данный инсектицид сохраняется долгое время: через год после опрыскивания обнаруживается 90 %, а через 3 года – 72–80 % использованного препарата. При 24–40°С 4–8 % альдрина превращается в дильдрин.
Альдрин придает воде специфический запах и горько-вяжущий привкус. Порог ощущения запаха соответствует концентрации 0,03 мг/дм 3 , привкус возникает при концентрации 0,002 мг/дм 3 . В концентрациях 0,02–0,1 мг/дм 3 препарат не изменяет процессов биохимического окисления органических соединений, а при концентрациях 1–10 мг/дм 3 повышает БПК и оказывает стимулирующее влияние на развитие сапрофитной микрофлоры воды.
ПДКв – 0,002 мг/дм 3 (лимитирующий показатель вредности – органолептический).
Карбофос (малатион, сумитокс, фостион, цитион). Карбофос, представляющий собой бесцветную жидкость – инсектицид многофункционального действия: акарицид, нематицид, ларвицид. Меры предосторожности при использовании карбофоса – как со среднетоксичными пестицидами.
Препарат применяется для борьбы с вредными насекомыми и клещами на многих сельскохозяйственных культурах: плодовых, овощных, ягодных, зерновых. Карбофос эффективен на чайных плантациях, на хлопчатнике, рекомендован для борьбы с вредителями хлебных запасов в зернохранилищах.
ПДКв – 0,05 мг/дм 3 (лимитирующий показатель вредности – органолептический), содержание препарата в воде рыбохозяйственных водоемов не допускается.
Хлорофос (трихлорфон, дилокс, диоксафос, тугон, рицифон, метрифонат). Хлорофос – инсектицид, антигельминтик, афицид. Препарат, представляющий собой белый кристаллический порошок, широко применяется для борьбы с различными вредителями растений и паразитами животных. Хлорофос разлагается на свету, а также в щелочной среде, где протекает дегидрохлорирование. В природных водах он постепенно гидролизуется, окончательными продуктами гидролиза являются хлорацетальдегид и фосфорная кислота. Хлорофос проявляет умеренные кумулятивные свойства. Препарат обладает раздражающим действием, проявляет незначительные кумулятивные свойства. При использовании хлорофоса необходимо соблюдать меры предосторожности как при обращении со среднетоксичными пестицидами. Не допускается остаточное содержание в продуктах животноводства.
ПДКв – 0,05 мг/дм 3 (лимитирующий показатель вредности – органолептический), содержание препарата в воде рыбохозяйственных водоемов не допускается.
Источник