- ЧАСТИЧНО СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
- Взболтать, но не смешивать
- 1. Рафинированное растительное масло:
- 2. Подкрашенная голубой краской вода H2O:
- 4. Расплавленный галлий Ga:
- 5. И последнее вещество — перфтородекалин (perfluorodecalyn) C10F18:
- 6. Конечное состояние
- Написал конструктор, напиши и деструктор
- Смешиваемость и растворимость органических растворителей.
- Для чего нужны диаграммы смешиваемости органических растворителей?
- Влияние температуры на растворимость.
- двухкомпонентные жидкие смеси
ЧАСТИЧНО СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
При достаточно больших отклонениях от закона Рауля смесь может не оставаться гомогенной во всем диапазоне изменений состава. В этом случае жидкости, образующие смесь, называются частично смешивающимися. На рис. 6.22 показаны три возможных типа фазовых диаграмм для частично смешивающихся жидкостей.
Остановимся несколько подробнее на частично смешивающихся жидкостях, которые характеризуются фазовой диаграммой типа а. Если при постоянной температуре Td добавлять компонент А к компоненту В, то растворение А в В будет приводить к образованию раствора до тех пор, пока не будет достигнута точка X. В этой точке компонент В насыщается компонентом А и возникает вторая фаза. Эта новая фаза представляет собой компонент А, насыщенный компонентом В. При дальнейшем добавлении компонента А доля этой второй фазы в смеси возрастает до тех пор, пока не будет достигнута точка У В этой точке фаза, которая состоит из компонента В, насыщенного компонентом А, исчезает и образуется единая фаза, которая состоит из компонента А, насыщенного компонентом В.
Таким образом, точки X и У отвечают составам насыщенных растворов А в В и В в А соответственно при температуре Тй. Во всех точках соединительной линии между X и У насыщенные растворы сосуществуют в равновесии. Их составы остаются постоянными, меняются только относительные количества каждой фазы. Общий состав двух растворов определяется мольной долей хА.
Температура в точке С является максимальной температурой, при которой возможно образование двух фаз. Она называется критической температурой растворения (температура полной растворимости или смешиваемости). Состав жидкой смеси в этой точке называется критическим составом.
Источник
Взболтать, но не смешивать
Все знают, что вода с маслом не смешивается.
Кто помнит школьную физику, легко назовёт третью жидкость, не смешивающуюся с этими двумя: ртуть.
Вопрос: а сколько всего известно взаимно нерастворимых жидкостей при условиях, близких к нормальным?
Авторы этой работы собрали семь. Правда, повторять их опыт дома решительно не хочется, ибо в списке ингредиентов присутствуют анилин, ртуть, и такая «прелесть», как расплавленный (!) белый фосфор. Чертовски горючий, ядовитый, заслуженно полагаемый за это сочетание оружием, заставляющий вновь помянуть урановые ломы в ртути.
Тогда вопрос №2: а сколько можно найти взаимно несмешиваемых жидкостей, которые не страшно принести домой, чтобы показать демку детям?
Мне удалось собрать пять. Собственно, их сливанием вот в эту пробирку мы в статье и займёмся.

1. Рафинированное растительное масло:

В данном случае из виноградных косточек. Состоит оно главным образом из эфиров линолевой и олеиновой кислот. Слово «кислота» пусть не введёт никого в заблуждение. Обе молекулы — это главным образом длинные углеводородные «хвосты» вида *-(CH2)n-CH3. Они и отвечают за гидрофобность. По какой причине вместо масла вполне годится любой жидкий углеводород (пентан, гексан) или их смесь (бензин, керосин). Однако масло менее огнеопасно и покупается в обычном продуктовом магазине.
2. Подкрашенная голубой краской вода H2O:

3. Силиконовое масло:

Силиконовое масло — это смесь низкомолекулярных полимеров с общей формулой вида (C2H6OSi)n. Добытая на Амазоне разновидность используется как загуститель красок и оказалась вязка, как хороший мёд. Если повторять опыт, стоит поискать более текучие разновидности.
Эта жидкость «устаканилась» между водой и маслом, в соответствии с промежуточным значением своей плотности.
4. Расплавленный галлий Ga:

Галлий плавится при +29.8 C. Поэтому пробирка на время помещена в банку с тёплой водой.
Коллекционные количества галлия легко приобретаются в интернете, хотя бы на Амазоне. Металл этот достаточно безопасен, чтобы брать его в руки, и не образует ядовитых испарений. Однако, соприкасаясь с твёрдыми поверхностями и кожей, сильно пачкает их тёмным слоем оксида галлия. Этот оксид растворим в пищевых кислотах, а растворимые соли галлия могут быть и токсичными. Поэтому после работы всё, что с галлием соприкасалось, надо отмывать от его оксида. Обыкновенная тёплая мыльная вода прекрасно справляется с этой задачей.
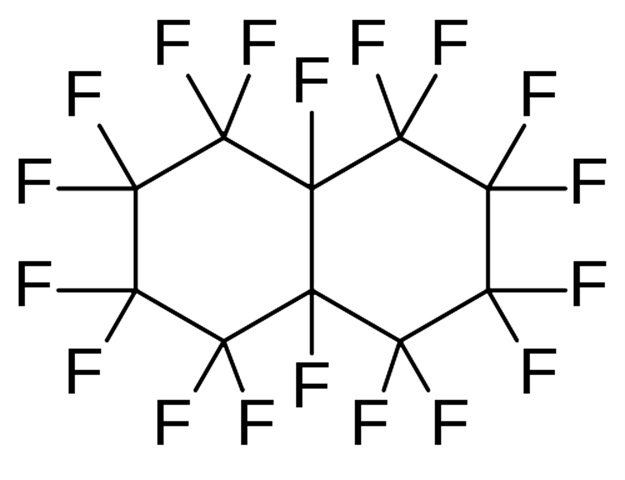
5. И последнее вещество — перфтородекалин (perfluorodecalyn) C10F18:
Эта жидкость заметно тяжелее воды, поэтому собралась над галлием. Состоит она исключительно из фтора и углерода:
В Штатах производители продают это вещество только бизнесам, имеющим легитимную потребность в работе с ним. К счастью, незначительные его количества (5-10 грамм) вполне законно приобретаются у частных лиц на eBay.
Ядовитым в строгом смысле этого слова перфтородекалин не является. Его даже добавляют в некоторые виды косметики, а близкородественные ему соединения используют в качестве основного компонента искусственной крови. Однако пары более лёгких его «родственников» вызывают отключку сознания и используются для наркоза, и мне не хотелось проверять, обладает ли конкретно эта жидкость теми же свойствами. Кроме того, в вопросе о воздействии его на глаза найденные статьи демонстрировали странное разногласие. Так что работал я с ним в очках, перчатках, на открытом воздухе, и не подпускал зрителей к пробирке слишком близко. На всякий случай.
6. Конечное состояние
Качественно перемешав все жидкости стеклянной палочкой, я дал им денёк отстояться, и получил в итоге вот такую картину:

Любопытно, что между некоторыми компонентами возникли тонкие слои дополнительных фаз, вероятно, из-за небольшой взаимной растворимости.
Написал конструктор, напиши и деструктор
Что со всей этой смесью потом делать?
Воду и масло спокойно выливаем. Силиконовое масло — в мусор. Конечные продукты его разложения — вода, углекислый газ и песок, хотя процесс этот небыстрый.
Галлий можно собрать пипеткой, слить в спичечный коробок, заморозить и держать дома для будущих опытов. Только не замораживайте его в стеклянной посуде. Этот металл здорово расширяется при застывании и рвёт её в клочья:

Если всё-таки не хочется держать галлий дома, везите его на свалку для тяжёлых металлов и/или токсичных отходов. Или подарите знакомым химикам, пусть найдут ему применение.
Сложнее всего избавиться от перфтородекалина. Вещество это химически настолько стойкое, что разрушить его в домашних условиях до безопасных компонент практически невозможно. Из-за той же стойкости разлагаться в природе оно будет тысячелетиями, путями не вполне понятными, и с неясным пока воздействием на биосферу за всё это время. Так что, по-хорошему, я бы рекомендовал связаться с организациями, перерабатывающими отходы от настоящих химических лабораторий, и сдать перфтородекалин им. Можно через знакомых химиков, что я и сделал.
Спасибо за чтение, хорошего всем дня! Кому надо, вот PDF.
Источник
Смешиваемость и растворимость органических растворителей.
Растворители – это химические вещества, без которых не обходятся ни одни лакокрасочные работы в Москве, Санкт-Петербурге, Дмитрове и даже по всему миру. Поэтому очень важно ориентироваться в основных свойствах этих веществ, особенно в таких как и растворимость и смешиваемость.
Термины смешиваемый и растворимый часто используют таким образом, что это может вызвать смысловую путаницу. Недвусмысленные рабочие определения этих терминов таковы:
- Смешиваемый. Два компонента, которые могут смешиваться друг с другом в любом соотношении без образования двух отдельных фаз, называют смешиваемыми. Напротив, два компонента, образующие при смешивании отдельные слои, являются несмешиваемыми.
- Растворимый. Компонент, содержащийся в любом количестве в растворителе, растворим в этом растворителе. Наибольшее количество вещества А, которое будет растворяться в данном количестве растворителя Б, называют растворимостью (или предельной растворимостью) А в Б.
Выражения типа «частично смешиваемый» (т. е. имеющий низкую растворимость) или «полностью растворимый» (т. е. смешиваемый) лишь приводят к путанице, и их использования следует избегать.
Для чего нужны диаграммы смешиваемости органических растворителей?
Диаграммы смешиваемости растворителей это удобный справочный материал, но не следует искать в нем больше смысла, чем в нем заключено. Когда пара растворителей обозначена как «несмешиваемые», это означает лишь, что эти два компонента образуют две отдельные фазы при смешивании в некотором соотношении. Это не означает, что компоненты нерастворимы до такой степени, которая полезна (или вредна) для хроматографии.
Например, дихлорметан и вода образуют два слоя при многих соотношениях, следовательно, они не смешиваются друг с другом. Дихлорметан, однако, растворим в воде на уровне 1,6%, а вода — в дихлорметане на уровне 0,2%. Последнее значение (2000 млн-1) не является обычной для кварцевых колонок, используемых в НФ хроматографии, и вызывает дезактивацию поверхности колонок этого типа, приводя к сопутствующей потере удерживания определяемых веществ.
Во многих работах по градиентному элюированию фактором, ограничивающим выбор состава растворителя, обычно является растворимость органического растворителя в воде. С одной стороны, около 65% (17 из 26) приведенных растворителей не смешивается с водой. С другой стороны, около 30% из тех растворителей, которые обозначены как несмешивающиеся с водой, имеют растворимость в воде, достаточно большую для использования в работах во ВЭЖХ: метилэтилкетон — 24%; этилацетат — 9%; 1- бутилацетат — 8%; диэтиловый эфир — 7%; метил-трет-бутиловый эфир — 6%. Использование растворителя, который сам смешивается с несмешиваемой нарой растворителей, часто дает однофазную тройную смесь. Например, дихлорметан не смешивается с водой, но добавление изопропанола к смеси приведет, в конечном счете, к однофазной тройной смеси. Это дает хроматографисту дополнительную степень свободы при выборе подвижной фазы.
Влияние температуры на растворимость.
Растворимость сильно зависит от температуры, поэтому следует предпринять меры, когда работа ведется со смесью растворителей, близкой по составу к насыщению. Это особенно критично, когда процесс смешивания растворителей заметно экзотермичен (например, смесь метанол/вода) или эндотермичен (например, смесь ацетонитрил/вода) и конечный объем получают разведением по объему.
Например, если процесс смешивания экзотермичен, смесь растворителей сначала может быть смешиваемой из-за увеличения ее температуры. Однако, при охлаждении до комнатной температуры раствор может расслоиться на две фазы. Такого варианта можно избежать и получить более точный состав растворителя, если отдельно отмерить точные объемы каждого из компонентов подвижной фазы (количества должны быть ниже предельной растворимости), добавить их друг к другу, дать установиться равновесию и использовать полученный раствор.
Дмитриевский химический завод — это ведущий производитель растворителей в России. Производство многокомпонентных растворителей, бутилацетата и уксусной кислоты реализуется уже более чем 100 лет. Поставляем растворители на ведущие автоконцерны России. Есть опция изготовления растворителя по рецептуре заказчика. Растворитель 646 от Дмитриевского химического завода — это продукт эталонного качества по доступной цене.
Источник
двухкомпонентные жидкие смеси
Мы рассмотрим три разновидности двухкомпонентных жидких смесей, а именно: 1) полностью смешивающиеся жидкости (например, воду и этанол), 2) частично смешивающиеся жидкости (например, воду и бутан-1-ол), 3) несмешивающиеся жидкости (например, воду и масло).
полностью смешивающиеся жидкости
Такие жидкости полностью растворяются одна в другой в любых отношениях, образуя гомогенную смесь, или раствор. Мы начнем ознакомление со свойствами таких систем с рассмотрения модели идеального раствора, а затем покажем, как свойства реальных, или неидеальных, растворов отклоняются от предсказываемых в рамках данной модели. Хотя ни один из известных растворов не является полностью идеальным, некоторые растворы обладают свойствами, близкими к идеальным. В качестве примера подобных растворов укажем раствор бензола и метилбензола (толуола); жидкую смесь азота и кислорода, а также смесь алканов, например, в сырой нефти. Идеальным считается раствор, который обладает следующими свойствами:
- 1) между молекулами одного компонента раствора и молекулами разных компонентов действуют одинаковые силы межмолекулярного притяжения. Молекулы одного компонента практически не облегчают и не затрудняют переход в паровую фазу молекул другого компонента;
- 2) смешивание двух компонентов раствора не сопровождается изменением энтальпии;
- 3) объем смеси двух компонентов (раствора) в точности равен сумме их объемов до смешивания.
Идеальные растворы подчиняются закону Рауля. Согласно закону Рауля, парциальное давление пара (рА) компонента А, находящегося в растворе, равно произведению давления пара чистого компонента А (рА) и мольной доли (хА) этого компонента в растворе.
Для идеального раствора, состоящего из двух компонентов А и В, закон Рауля выражается следующими двумя формулами:

Пар идеального раствора может рассматриваться как идеальный газ, а в таком случае к нему должен быть применим закон Дальтона (см. разд. 3.1). Следовательно, полное давление пара (р) рассматриваемого двухкомпонентного раствора равно сумме парциальных давлений пара каждого компонента:

Отсюда следует, что

Суммарное давление пара двухкомпонентного раствора и парциальное давление пара более летучего компонента увеличиваются с возрастанием мольной доли более летучего компонента в растворе. Одновременно с этим парциальное давление пара менее летучего компонента раствора уменьшается. Это показано на рис. 6.10.
Более летучим компонентом раствора является тот, молекулы которого обладают большей способностью переходить в паровую фазу. Поэтому более летучий компонент имеет более высокое давление пара. Отметим, что состав двухкомпонентного раствора можно выразить через мольную долю одного из его компонентов, А либо В, поскольку
Источник






