Ксилол-о (ортоксилол)
 | Растворители российского пр-ва | |
|---|---|---|
| Вещество: | ортоксилол | |
| Синонимы: | ||
| Стандарт на ортоксилол | ТУ 38.101254-72 с изм.1-7 | |
Каталожный номер на ортоксилол CAS: 95-47-6
Описаниe ксилола (ортоксилола)
бесцветная жидкость, смешивается с этанолом, диэтиловым эфиром, ацетоном, хлороформом, бензолом; растворимость в воде менее 0,015 %.
Имеет три изомера: орто-, мета- и пара-ксилол.
Плотность при 20 град.C
Благодаря этой таблице видно, что метокилол и параксилол имеют одинаковую температуру кипения, и по этому не могут быть разогнаны перегонкой. Зато ортоксилол по температуре перегонки отличается и с успехом отгоняется из смеси в условиях российского производства и продаеться как отдельный продукт по ТУ 38.101254-72 с изм.1-7.
А смесь метаксилола и параксилола идет как сырье на экспорт, где эти изомеры разгоняют в криогенных установках, (температуры плавления у них разные). Затем, метаксилол окисляют до метакриловой кислоты, которая в свою очередь служит для производства метакрилатов и поликрилатов (полиакриловых смол), которые вновь ввозятся в Россию и продаться по очень дорогим ценам.
К сожалению, до сих пор, в России разделение этих изомеров и производство акриловых смол в промышленных масштабах не развито.
Спецификация на ортоксилол
| 1 | Внешний вид, цвет | Прозрачная жидкость, не содержит посторонние примеси, воду |
| 2 | Плотность при 20°C , гсм3 , не менее. | 0.878-0.880 |
| 3 | Температурные пределы перегонки от 5 до 95% 0с не более. | 0.4 |
| 4 | содержание основного вещества ортоксилола ,мол%, не менее | 99.2 |
| 5 | Бромное число,г. брома 100м(куб) ортоксилола, не более | 0.18 |
Фасовка: 200 литровые бочки,при необходимости производиться фасовка в канистры.
Основные физические свойства ортоксилола
| Молярная масса: | для составного вещества не определена. |
| Температура плавления: | — 25,5°C |
| Температура начала кипения: | 150°C |
| Температура вспышки в закрытом тигле: | 28°C |
| Растворимость: | Нерастворим в воде. |
Применение ксилола (ортоксилола)
Применяется для растворения эпоксидных, виниловых, акриловых, кремнийорганических полимеров, нитроцеллюлозы, хлоркаучука, для разбавления меламино и мочевиноформальдегидных материалов. Ортоксилол можно применять взамен сольвента в рецептурах лакокрасочных материалов.
Опасность для человека
Ортоксилол по степени воздействия на организм человека относится к 3-му классу опасности.
Разделение достаточно условное, поскольку толуол попадает в ту же группу, но по воздействию на человека более опасен.
Пары ксилола при высоких концентрациях, более ПДК, отрицательно воздействуют на нервную систему, кожные покровы и слизистые оболочки человека.
Предельно допустимая концентрация паров ксилола в воздухе рабочей зоны составляет 50 мг/м(куб) по ГОСТ 12.1.005-88.
Анализ воздушной среды проводят в соответствии с методическими указаниями по измерению концентрации вредных веществ в воздухе рабочей зоны, утвержденными Министерством здравоохранения.
При работе с ксилолом необходимо применять индивидуальные средства защиты по типовым отраслевым нормам.
Пожаро, взрывоопасность ортоксилола
Ксилол, (ортоксилол) относится к пожаро-, взрывоопасным продуктам: температура самовоспламенения выше 450 град.С, температура вспышки в закрытом тигле не ниже 23град.С, концентрационные пределы воспламенения паров ксилола в смеси с воздухом (по объему): нижний — 1%, верхний — 6%.
Категория и группа взрывоопасности нефтяного ксилола -2Т1
При сливно-наливных работах необходимо соблюдать технику защиты от статического электричества в производственных помещения. При разливе ксилола; нефтяного обезвреживание производят песком с выносом в специально отведенное место. Для тушения применяют тонкораспыленную воду, воздушно-механическую пену и химическую пену. В производственных помещениях и местах хранения запрещено использовать открытый огонь, в частности курить, использовать инструменты дающие искру. Нефтяной ксилол по степени воздействия на организм относится к третьему классу опасности.
Производственные помещения, в которых ведутся работы с ксилолом, должны быть обеспечены приточно-вытяжной вентиляцией, а оборудование — местными отсосами.
В помещениях для хранения и применения ксилола запрещается обращение с открытым огнем, а также использование инструментов, дающих при ударе искру. Электрооборудование и искусственное освещение должно быть выполнено во взрывобезопасном исполнении.
При разливе ксилола обезвреживание производить засыпкой песком с выносом его в специально отведенное место.
Для тушения ксилола необходимо применять тонкораспыленную воду, химическую и воздушно-механическую пену.
Источник
Ортоксилол. Свойства, применение
По своим физико-химическим характеристикам качественный ортоксилол должен соответствовать требованиям ТУ 38.101254-72. Согласно данному документу, ортоксилол – прозрачная жидкость без посторонних примесей, цвет которой не должен быть темнее эталонного раствора 0,003 г К2Сr2O7 в 1 дм3 воды. Плотность вещества должна быть 0,878-0,880 г/куб.см при 20°С. Содержание основного вещества – не менее 99,2%. Температура кристаллизации должна быть не ниже -25,5°С, а температурные пределы перегонки от 5 до 95% — не более 0,4°С. Бромное число ортоксислола, измеряемое в граммах брома на 100 мл продукта, не должно превышать отметку в 0,18г.
Будучи легковоспламеняющейся жидкость, ортоксилол должен храниться и транспортироваться в соответствующих условиях. Хранение его осуществляется в герметично закрытой таре, избегая воздействия прямых солнечных лучей, не допуская близости нагревательных приборов. Все работы с ортоксилолом должны проводиться в хорошо проветриваемом помещении.
Наша компания занимается поставками химического сырья, и ортоксилол от ведущих российских заводов-производителей входит в перечень предлагаемых товаров. Мы разливаем химическую продукцию в различную тару, от пластиковых канистр и бутылей до стальных бочек, а доставка осуществляется автотранспортом.
Источник
Бензол и его гомологи
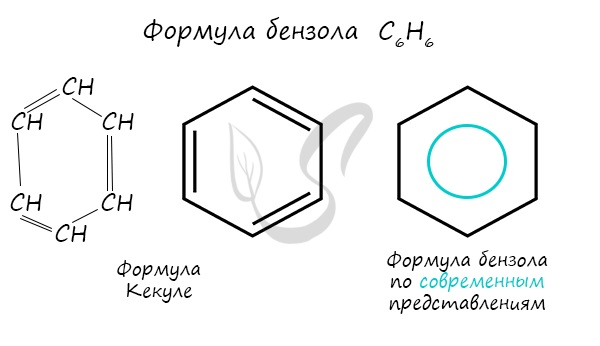
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
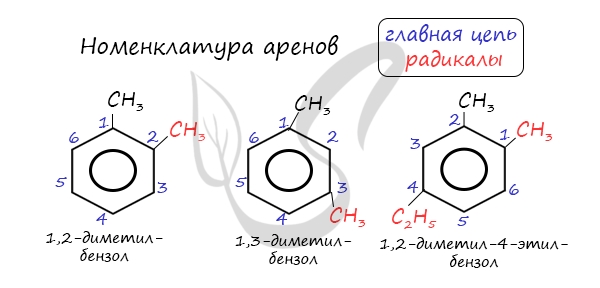
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
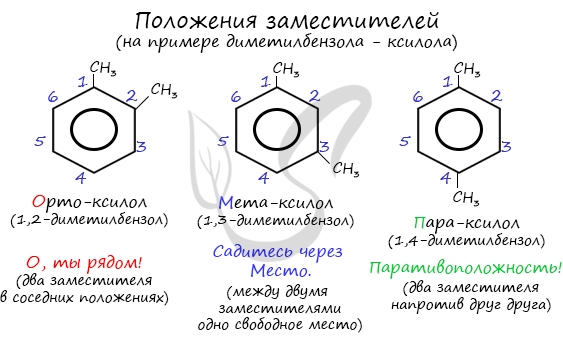
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
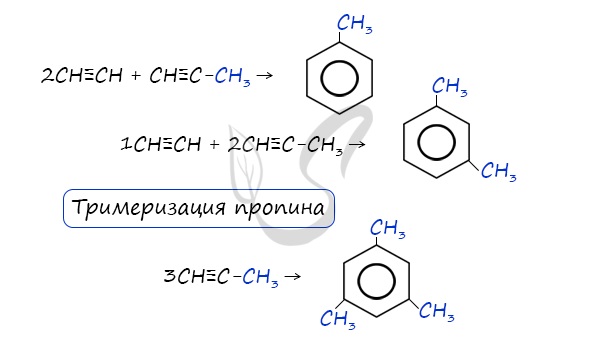
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
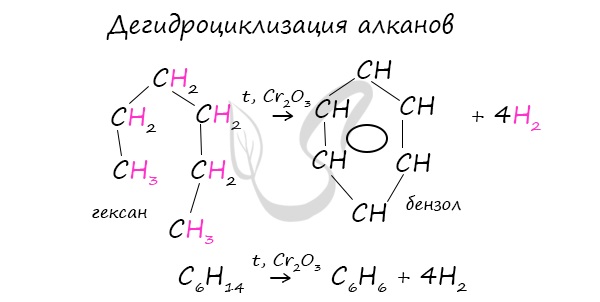
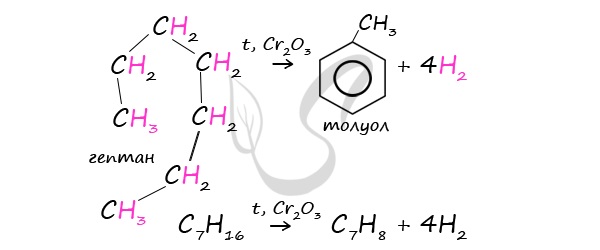
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
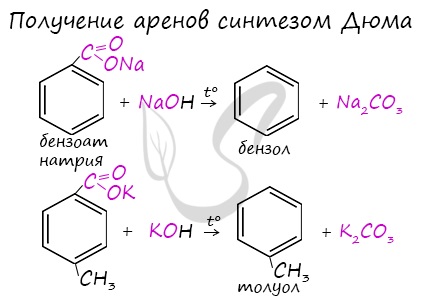
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
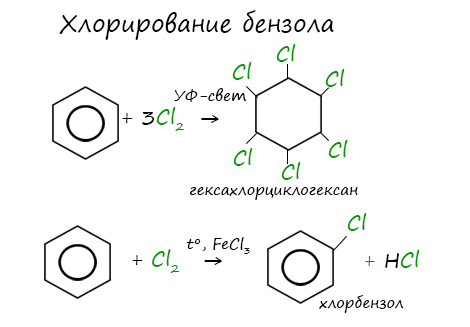
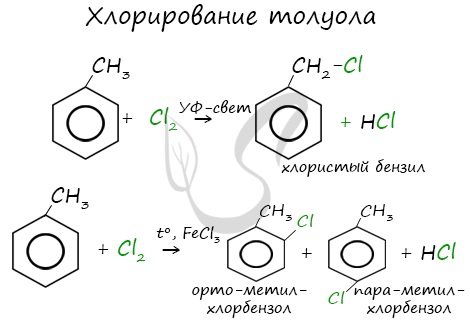
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
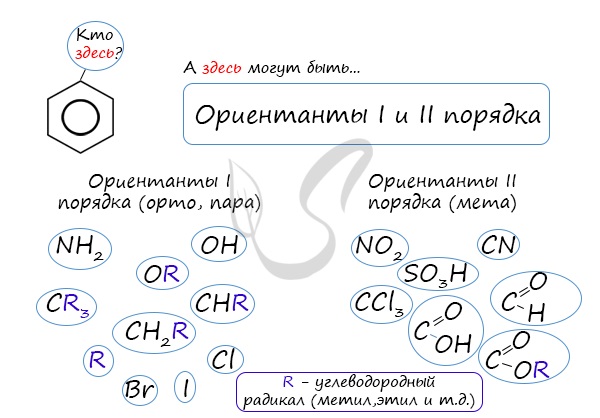
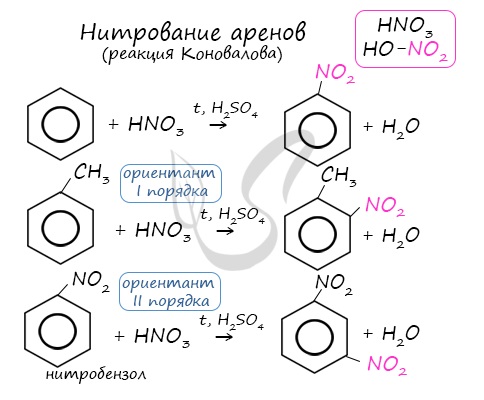
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
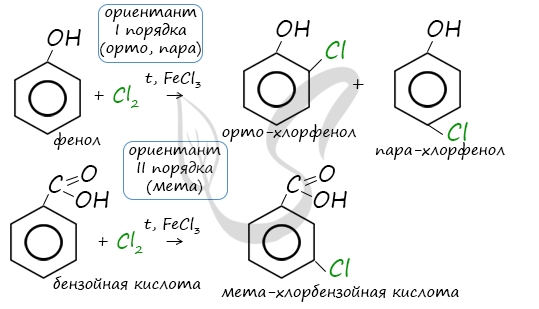
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
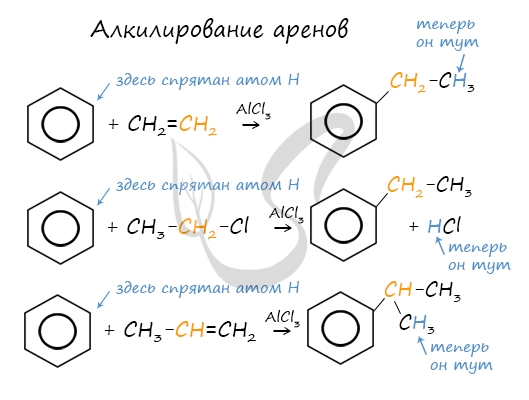
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
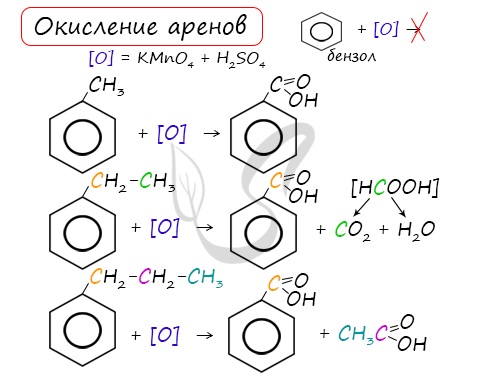
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
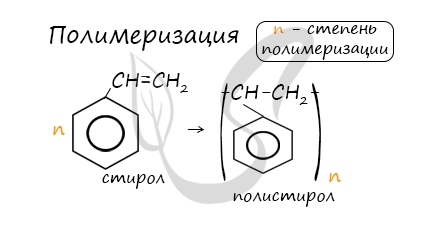
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник