Испарение и конденсация. Кипение жидкости
1. Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарения и кипения.
Испарение происходит с поверхности жидкости при любой температуре. Так, лужи высыхают и при 10 °С, и при 20 °С, и при 30 °С. Таким образом, испарением называется процесс превращения вещества из жидкого состояния в газообразное, происходящий с поверхности жидкости при любой температуре.
С точки зрения молекулярно-кинетической теории строения вещества испарение жидкости объясняется следующим образом. Молекулы жидкости, участвуя в непрерывном движении, имеют разные скорости. Наиболее быстрые молекулы, находящиеся на границе поверхности воды и воздуха и имеющие сравнительно большую энергию, преодолевают притяжение соседних молекул и покидают жидкость. Таким образом, над жидкостью образуется пар.
Поскольку из жидкости при испарении вылетают молекулы, обладающие большей внутренней энергией по сравнению с энергией молекул, остающихся в жидкости, то средняя скорость и средняя кинетическая энергия молекул жидкости уменьшаются и, следовательно, температура жидкости уменьшается.
Скорость испарения жидкости зависит от рода жидкости. Так, скорость испарения эфира больше, чем скорость испарения воды и растительного масла. Кроме того, скорость испарения зависит от движения воздуха над поверхностью жидкости. Доказательством может служить то, что бельё сохнет быстрее на ветру, чем в безветренном месте при тех же внешних условиях.
Скорость испарения зависит от температуры жидкости. Иапример, вода при температуре 30 °С испаряется быстрее, чем вода при 10 °С.
Хорошо известно, что вода, налитая в блюдце, испариться быстрее, чем вода такой же массы, налитая в стакан. Следовательно, скорость испарения зависит от площади поверхности жидкости.
2. Процесс превращения вещества из газообразного состояния в жидкое называется конденсацией.
Процесс конденсации происходит одновременно с процессом испарения. Молекулы, вылетевшие из жидкости и находящиеся над её поверхностью, участвуют в хаотическом движении. Они сталкиваются с другими молекулами, и в какой-то момент времени их скорости могут быть направлены к поверхности жидкости, и молекулы вернутся в неё.
Если сосуд открыт, то процесс испарения происходит быстрее, чем конденсация, и масса жидкости в сосуде уменьшается. Пар, образующийся над жидкостью, называется ненасыщенным.
Если жидкость находится в закрытом сосуде, то вначале число молекул, вылетающих из жидкости, будет больше, чем число молекул, возвращающихся в неё, но с течением времени плотность пара над жидкостью возрастет настолько, что число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё. В этом случае наступает динамическое равновесие жидкости с её паром.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром.
Если сосуд с жидкостью, в котором находится насыщенный пар, нагреть, то вначале число молекул, вылетающих из жидкости, увеличится и будет больше, чем число молекул, возвращающихся в неё. С течением времени равновесие восстановится, но плотность пара над жидкостью и соответственно его давление увеличатся.
3. В воздухе всегда содержится водяной пар, являющийся продуктом испарения воды. Содержание водяного пара в воздухе характеризует его влажность.
Абсолютной влажностью воздуха \( (\rho) \) называют массу водяного пара, содержащегося в 1 м 3 воздуха, или плотность водяного пара, содержащегося в воздухе.
Если относительная влажность равна 9,41·10 -3 кг/м 3 , то это означает, что в 1 м 3 содержится 9,41·10 -3 кг водяного пара.
Для того чтобы судить о степени влажности воздуха, вводят величину, называемую относительной влажностью.
Относительной влажностью воздуха \( (\varphi) \) называют величину, равную отношению плотности водяного пара \( (\rho) \) , содержащегося в воздухе (абсолютной влажности), к плотности насыщенного водяного пара \( (\rho_0) \) при этой температуре:
Обычно относительную влажность выражают в процентах.
При понижении температуры ненасыщенный нар может превратиться в насыщенный. Примером такого превращения является выпадение росы и образование тумана. Так, летним днём при температуре 30 °С плотность водяного пара равна 12,8·10 -3 кг/м 3 . Этот водяной пар является ненасыщенным. При понижении вечером температуры до 15 °С он уже будет насыщенным, и выпадет роса.
Температуру, при которой водяной пар, содержащийся в воздухе, становится насыщенным, называют точкой росы.
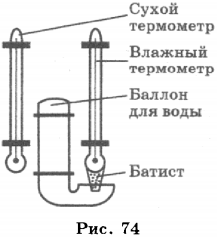
Для измерения влажности воздуха используют прибор, называемый психрометром.
Психрометр состоит из двух термометров, один из которых сухой, а другой — влажный (рис. 74). Термометры прикреплены к таблице, в которой по вертикали указана температура, которую показывает сухой термометр, а по горизонтали — разность показаний сухого и влажного термометров. Определив показания термометров, по таблице находят значение относительной влажности воздуха.
Например, температура, которую показывает сухой термометр, 20 °С, показание влажного термометра — 15 °С. Разность показаний 5 °С. По таблице находим значение относительной влажности \( \varphi \) = 59%.
4. Второй процесс парообразования — кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения.
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
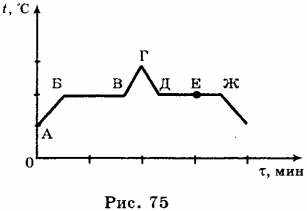
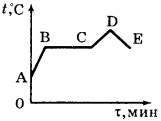
На рисунке 75 приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АБ), кипения (БВ), нагревания пара (ВГ), охлаждения пара (ГД), конденсации (ДЕ) и последующего охлаждения (ЕЖ).
5. Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельной теплотой парообразования \( (L) \) называют величину, равную отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования — \( [L] \) = Дж/кг.
Чтобы рассчитать количество теплоты \( Q \) , которое необходимо сообщить веществу массой \( m \) для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования \( (L) \) умножить на массу вещества: \( Q=Lm \) .
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. Испарение и кипение — два процесса превращения вещества из одного агрегатного состояния в другое. Общей характеристикой этих процессов является то, что оба они
А. Представляют собой процесс превращения вещества из жидкого состояния в газообразное
Б. Происходят при определённой температуре
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
2. Испарение и кипение — два процесса перехода вещества из одного агрегатного состояния в другое. Различие между ними заключается в том, что
А. Кипение происходит при определённой температуре, а испарение — при любой температуре.
Б. Испарение происходит с поверхности жидкости, а кипение — во всём объёме жидкости.
Правильным(-и) является(-ются) утверждение(-я)
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
3. При нагревании вода превращается в пар той же температуры. При этом
1) увеличивается среднее расстояние между молекулами
2) уменьшается средний модуль скорости движения молекул
3) увеличивается средний модуль скорости движения молекул
4) уменьшается среднее расстояние между молекулами
4. В процессе конденсации водяного пара при неизменной его температуре выделилось некоторое количество теплоты. Что произошло с энергией молекул водяного пара?
1) изменилась как потенциальная, так и кинетическая энергия молекул пара
2) изменилась только потенциальная энергия молекул пара
3) изменилась только кинетическая энергия молекул пара
4) внутренняя энергия молекул пара не изменилась
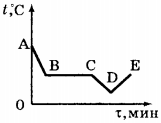
5. На рисунке приведён график зависимости температуры воды от времени при её охлаждении и последующем нагревании. Первоначально вода находилась в газообразном состоянии. Какой участок графика соответствует процессу конденсации воды?
1) АВ
2) ВС
3) CD
4) DE
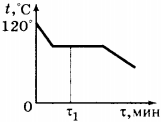
6. На рисунке приведён график зависимости температуры воды от времени. В начальный момент времени вода находилась в газообразном состоянии. В каком состоянии находится вода в момент времени \( \tau_1 \) ?
1) только в газообразном
2) только в жидком
3) часть воды в жидком состоянии, часть — в газообразном
4) часть воды в жидком состоянии, часть — в кристаллическом
7. На рисунке приведён график зависимости температуры спирта от времени при его нагревании и последующем охлаждении. Первоначально спирт находился в жидком состоянии. Какой участок графика соответствует процессу кипения спирта?
1) АВ
2) ВС
3) CD
4) DE
8. Какое количество теплоты необходимо затратить, чтобы превратить в газообразное состояние 0,1 кг спирта при температуре кипения?
1) 240 Дж
2) 90 кДж
3) 230 кДж
4) 4500 кДж
9. В понедельник абсолютная влажность воздуха днём при температуре 20 °С была равной 12,8 г/см 3 . Во вторник она увеличилась и стала равной 15,4 г/см 3 . Выпала ли роса при понижении температуры до 16 °С, если плотность насыщенного пара при этой температуре 13,6 г/см 3 ?
1) не выпала ни в понедельник, ни во вторник
2) выпала и в понедельник, и во вторник
3) в понедельник выпала, во вторник не выпала
4) в понедельник не выпала, во вторник выпала
10. Чему равна относительная влажность воздуха, если при температуре 30 °С абсолютная влажность воздуха равна 18·10 -3 кг/м 3 , а плотность насыщенного пара при этой температуре 30·10 -3 кг/м 3 ?
11. Для каждого физического понятия из первого столбца подберите соответствующий пример из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ПОНЯТИЯ
A) физическая величина
Б) единица физической величины
B) прибор для измерения физической величины
ПРИМЕРЫ
1) кристаллизация
2) джоуль
3) кипение
4) температура
5) мензурка
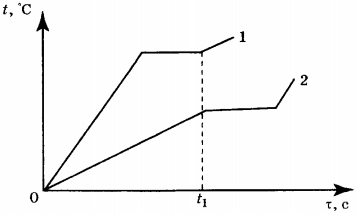
12. На рисунке приведены графики зависимости от времени температуры двух веществ одинаковой массы, находившихся первоначально в жидком состоянии, получающих одинаковое количество теплоты в единицу времени. Из приведённых ниже утверждений выберите правильные и запишите их номера.
1) Вещество 1 полностью переходит в газообразное состояние, когда начинается кипение вещества 2
2) Удельная теплоёмкость вещества 1 больше, чем вещества 2
3) Удельная теплота парообразования вещества 1 больше, чем вещества 2
4) Температура кипения вещества 1 выше, чем вещества 2
5) В течение промежутка времени \( 0-t_1 \) оба вещества находились в жидком состоянии
Часть 2
13. Какое количество теплоты необходимо для превращения в стоградусный пар 200 г воды, взятой при температуре 40 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
Источник
Парообразование: насыщенный и перегретый пар
В начале процесса нагрева воды, при достижении температуры 100°С на дне емкости (сосуда, прибора, котла) постепенно образуются пузырьки пара, которые поднимаясь вверх, не достигая поверхности, конденсируются в верхних более холодных, еще не прогретых до 100°С слоях воды. Через некоторое время, когда температура всего объема воды в сосуде повышается до 100°С, пузырьки пара начинают достигать верхнего слоя воды. То есть начинает происходить процесс кипения и испарения. При этом температура исходящего пара также составляет 100°С.
При увеличении подвода тепловой энергии интенсивность парообразования будет увеличиваться (количество пузырьков пара станет больше), но температура воды и выделяющегося пара будет прежней — 100°С, т.к. атмосферное давление останется неизменным. Напомним, что при атмосферных условиях (давление 1013 мбар) вода имеет температуру испарения 100°С. Но для простоты расчетов принято округлять значение давления до 1 бар (1000 мбар).
Вода на стадии испарения (при достижении температуры 100°С в атмосферных условиях) не может более принимать энергию, не изменив свое агрегатное состояние. Энтальпия (теплосодержание) воды, находящейся в данном состоянии определяется, как ее тепловая энергия насыщения и обозначается как h’.
Если нагреваемый сосуд — закрытого типа, вода и пар могут находиться в состоянии динамического равновесия, при котором число молекул воды, превращающихся в пар, равно числу молекул, конденсирующихся обратно в воду (скорости процессов парообразования и конденсации одинаковы). При этом пар, находящийся в данном состоянии, называется насыщенным.
Чтобы продолжить процесс испарения и добиться полного испарения воды, необходимо передать ей больше энергии, чем тепловая энергия насыщения. Указанная энергия – это теплота парообразования r. Общая энтальпия полученного пара обозначается h” и определяется как:
h”=h’+r
1 кг пара при температуре 100°С обладает тепловой энергией примерно в 6 раз большей, чем 1 кг воды при 100°С. Когда пар с температурой 100°С отдает тепловую энергию, образуется конденсат. То есть процесс конденсации 1 кг пара, имеющего температуру 100°С, будет сопровождаться высвобождением тепловой энергии, которая будет в 6 раз больше, чем присутствует в воде с теми же параметрами. Количество теплоты, выделяемое при конденсации пара, называется тепловой энергией парообразования. Полученный при этом конденсат имеет такую же температуру, как и пар, из которого он был получен.
Значение температуры насыщения пара находится в прямой зависимости от давления пара в сосуде. От давления пара также зависят такие величины, как тепловая энергия насыщения и парообразования, энтальпия и удельный объем. Значения указанных параметров, соответствующих определенному давлению пара, приведены в Таблице насыщенного пара.
В таблице представлены следующие данные:
— температура насыщенного пара (ts, С), которая определяет точку кипения воды при определенном давлении. Значение указанной температуры также определяет температуру конденсации пара;
— удельный объем (v”, м3/кг) — объем, занимаемый единицей массы вещества. Величина удельного объема находится в обратной зависимости от увеличения давления пара;
— удельный вес (po, кг/м3), который показывает массу пара, выраженного в килограммах, содержащегося в 1 м3 объема. Удельный вес увеличивается при увеличении давления;
— энтальпия насыщения (h’, кДж/кг) – показатель количества тепловой энергии, которая необходима для доведения до кипения 1 кг воды при определенном давлении или количество тепловой энергии, которое содержит конденсат, сконденсированный из 1 кг пара при том же давлении. Чем выше давление пара, тем больше тепловой энергии несет конденсат;
— суммарная энтальпия пара (h”, кДж/кг);
— тепловая энергия парообразования (конденсации) (r, кДж/кг) – показатель количества тепловой энергии, требуемой для полного испарения 1 кг воды при определенном давлении или количество тепловой энергии, высвобождаемое при конденсации насыщенного пара при этом же давлении. При повышении давления количество тепловой энергии, которая требуется для полного испарения воды, уменьшается. А при конденсации такого насыщенного пара, соответственно, выделяется меньше энергии.
Для наглядности приведем пример расчета:
Сколько тепловой энергии необходимо, чтобы нагреть 10 м3 (10 000 кг) воды температурой 15°С до 90°С и какое количество пара необходимо для этого, при давлении пара в теплообменнике — 6 бар?
Удельная теплоемкость воды – 4,2 кДж/кг х К.
Сделаем расчет требуемого количества тепловой энергии:
А) Количество среды х перепад температуры х удельная теплоемкость = 10 000 х (90-15) х 4,2 = 3150000 кДж. При давлении 6 бар тепловая энергия конденсации — 2085 кДж/кг.
Б) Требуемое количество пара для нагрева воды: 3150000 / 2085 = 1511 кг. При этом температура конденсата, который будет отводиться через конденсатоотводчик из паровой сети, составит 159°С.
Пар, который имеет температуру и энтальпию при определенном давлении выше указанного в Таблице насыщенного пара, называется перегретым. Например, пар с давлением 9 бар и температурой 190°С является перегретым. Перегретый пар обладает меньшими теплопередающими свойствами по сравнению с насыщенным паром. Если перегретый пар используется в качестве теплоносителя, то значительная часть поверхности теплообмена будет использована для его охлаждения до температуры насыщенного пара. Как правило, перегретый пар используется в качестве энергоносителя паровых турбин.
При равном давлении удельный объем насыщенного пара значительно меньше, чем перегретого. Поэтому при переходе пара из насыщенного состояния в перегретое необходимо обращать внимание на уменьшение пропускной способности трубопроводов. Редуцируя (снижая) давление, насыщенный пар с давлением меньше 31 бар может перейти в перегретое состояние. При этом обмена тепловой энергии не происходит и никакая работа не производится.
С помощью h-t-p диаграммы, представленной ниже можно наглядно показать процессы испарения, конденсации, парообразования и т.д
К примеру, рассмотрим процесс редуцирования давления пара со 120 до 50 бар. Согласно диаграмме точка пересечения с линией давления 50 бар находится в зоне парообразования/конденсации. Часть пара будет конденсироваться, т.к. энтальпия насыщенного пара при давлении 120 бар — 2689,2 кДж/кг меньше, чем энтальпия пара с давлением 50 бар -2794,2 кДж/кг. Пересечение находится в зоне линии х=0,9 — значит 10% пара будет сконденсировано и пар станет «влажным».
Источник