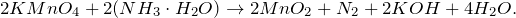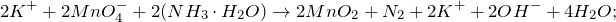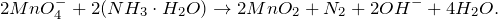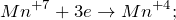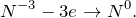- KMnO4 + NH3 = ? уравнение реакции
- Окисление аммиака и его свойства
- Как получить аммиак
- Реакция окисления аммиака
- Сжигание аммиака и его каталитическое окисление кислородом
- Химические свойства
- Заключение
- Нужно изучать химию (об удобрениях и марганцовке)
- О нитратах.
- Ну а теперь о марганцовке.
- Примеры ОВР соединений марганца
KMnO4 + NH3 = ? уравнение реакции
Составьте химическое уравнение по схеме KMnO4 + NH3 = ? Возможна ли вообще такая реакция? Относится ли она к ОВР? Охарактеризуйте полученное нерастворимое в воде соединение: укажите его основные физические и химические свойства, а также способы получения.
В результате взаимодействия перманганата калия с гидратом аммиака (KMnO4 + NH3 = ?) происходит образование твердого осадка оксида марганца (IV), гидроксида калия, воды, а также выделение газа — азота. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что оксиды, газы и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы азот и марганец изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Оксид марганца (IV) представляет собой твердое вещество черного цвета с коричневым оттенком, кристаллы которого при нагревании разлагаются. Не реагирует с водой. Из раствора осаждается в виде гидрата состава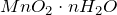
Источник
Окисление аммиака и его свойства
Одним из важнейших соединений азота является аммиак. По физическим свойствам это — бесцветный газ с резким, удушающим запахом (это запах водного раствора гидроксида аммония NH₃·H₂O). Газ хорошо растворяется в воде. В водном растворе аммоний является слабым основанием. Является одним из важнейших продуктов химической промышленности.
NH₃ — хороший редуктор, как в молекуле аммония, азот имеет самую низкую степень окисления -3. Многие характеристики аммиака определяются парой одиночных электронов в атоме азота – реакции присоединения с аммиаком происходят из-за его присутствия (эта пара одиночек расположена на свободной орбите Протона H⁺).
Как получить аммиак

Существуют два основных практических метода получения аммиака: один в лаборатории, другой — в промышленности.
Рассмотрим получение аммиака в промышленности. Взаимодействие молекулярного азота и водорода: N₂ + 2H₂ = 2NH₃ (обратимая реакция). Этот метод получения аммиака называется реакцией Хабера. Для молекулярного азота и водорода, которые должны прореагировать, их необходимо нагреть к 500 ᵒC или 932 ᵒF, давлению MPA 25-30 необходимо создаться. Пористый утюг должен присутствовать как катализатор.
Получение в лаборатории – это реакция между хлоридом аммония и гидроксидом кальция: СА(OH)₂ + 2NH₄Cl = CaCl₂ + 2NH₄OH (как NH₄OH — очень слабое соединение, оно сразу же распадается на газообразный аммиак и воду: NH₄OH = NH₃ + H₂O).
Реакция окисления аммиака
Они протекают с изменением состояния окисления азота. Так как аммиак — хороший редуктор, его можно использовать для уменьшения тяжелых металлов от их окисей.
Уменьшение металлов: 2NH₃ + 3CuO = 3Cu + N₂ + 3H₂O (когда меди (II) оксид нагревают в присутствии аммиака, металлическая медь красного цвета уменьшается).
Окисление аммиака в присутствии сильных окислителей (например, галогенов) происходит по уравнению: 2NH₃ + 3Cl₂ = N₂ + 6HCl (для проведения этой окислительно-восстановительной реакции требуется нагрев). При воздействии перманганата калия на аммиак в щелочной среде наблюдается образование молекулярного азота, марганцовокислого калия и воды: 2NH₃ + 6KMnO₄+ 6KOH = 6K₂MnO₄+ N₂ + 6H₂O.
При интенсивном нагревании (до 1200 ° C или 2192 ᵒF) аммиак может распадаться на простые вещества: 2NH₃ = N₂ + 3H₂. На 1000 oC или 1832 аммиак реагирует с метаном CH4:2CH₄ + 2NH₃ + 3O₂ = 2HCN + 6H₂O (синильной кислоты и воды). Путем оксидации аммиака с гипохлоритом натрия гидразин Н₂Х₄ можно получить: 2NH + NaOCl = N2H4 + NaCl + H2O
Сжигание аммиака и его каталитическое окисление кислородом
Окисление аммиака кислородом имеет определенные особенности. Существует два различных типа окисления: каталитический (с катализатором), быстрый (горение).
При горении происходит окислительно-восстановительная реакция, продуктами которой являются молекулярный азот и вода: 4NH3 + 2O2 = 2N2 + 6H2O (пламя желто-зеленое, горение начинается при 651 или 103,8 градусов по Фаренгейту, так как это температура самовоспламенения аммиака). Каталитическое окисление кислорода также происходит при нагревании (около 800 ᵒC или 1472 ᵒF), но один из продуктов реакции отличается: 4NH₃ + 5O₂ = 4NO + 6H₂O (в присутствии платины или оксидов железа, марганца, хрома или кобальта в качестве катализатора продуктами окисления являются оксид азота (II) и вода).
Рассмотрим однородное окисление аммиака кислородом. Бесконтрольная однотипная оксидация участка газа аммиака — относительно медленная реакция. О ней не сообщается подробно, но нижний предел воспламеняемости аммиачно-воздушных смесей при 25 оС составляет около 15 % в интервале давлений 1-10 бар и уменьшается по мере повышения начальной температуры газовой смеси.
— это молевая доля NH3 в смеси воздух-аммиак с температурой tmixed (OC), то из данных CNH = 0.15-0 следует, что предел воспламеняемости низкий. Поэтому разумно работать с достаточным запасом прочности ниже нижнего предела воспламеняемости, как правило, данные о смешивании аммиака с воздухом часто далеки от совершенства.
Химические свойства
Рассмотрим контактное окисление аммиака до оксида азота. Типичные химические реакции с аммиаком без изменения степени окисления азота:
- Реакция с водой: NH₃ + H₂O = NH₄OH = NH₄⁺ + он⁻ (реакция обратима, так как гидроксид аммония NH₄OH — это нестойкое соединение).
- Реакция с кислотами с образованием нормальных и кислых солей: NH₃ + HCl = NH₄Cl (нормальный хлорид аммония соли сформирован);NH₃ + H₂SO₄ = NH₄HSO₄ (в реакции аммиака с холодной концентрированной серной кислотой образуется кислотная соль гидросульфат аммония); 2NH₃ + H₂SO₄ = (NH₄)₂SO₄.
- Реакции с солями тяжелых металлов с образованием комплексов: 2NH₃ + AgCl = [Ag(NH₃)₂]Cl (сложные соединения серебра (I) хлоридные формы диамина).
- Реакция с haloalkanes: NH3 + CH3Cl = [CH3NH3]Cl (формы гидрохлорида метиламмония – это замещенный ион аммония NH4=).
- Реакция со щелочными металлами: 2NH₃ + 2K = 2KNH₂ + H₂ (образуется амид калия KNH₂; азот не изменяет состояние окисления, хотя реакция окислительно-восстановительная). Реакции присоединения происходят в большинстве случаев без изменения состояния окисления (все вышеперечисленные, кроме последней, классифицируются данным типом).
Заключение
Аммиак — популярное вещество, которое активно используется в промышленности. На сегодняшний день она занимает особое место в нашей жизни, так как большинство продуктов ее деятельности мы используем каждый день. Эта статья будет полезна для прочтения многим, кто захочет узнать о том, что нас окружает.
Источник
Нужно изучать химию (об удобрениях и марганцовке)
Добрый день, друзья! Сегодня решила покопаться в учебниках и справочниках по химии и разобраться в очень важном вопросе: что такое удобрения и какие вещества нельзя смешивать между собой при подкормке.
А также главный вопрос о марганцовке : вред от неё или польза? А может вообще ничего.
Благо, что химию я в школе любила и в терминах её не путаюсь. 😁
Начнем с растений — всем им нужны для роста и жизнедеятельности основные макровещества: такие как азот, калий и фосфор. А также еще большая группа микровеществ: кальций, магний, железо, бор, марганец, сера, молибден и др.
Часть этих веществ — металлы, с мощными восстановительными (щелочными) признаками — элементы 1 и 2 группы таблицы Менделеева: натрий, калий, магний, кальций.
Эти вещества очень активны и вытесняют собой все остальные (пассивные) но очень нужные металлы: железо, марганец, медь.
Также все щелочные металлы сильно конкурируют друг с другом. И чем ниже элемент в подгруппе, тем от сильнее.
В данном случае натрий — самый слабый щелочной металл.
В сведению, соли натрия содержатся в водопроводной воде с избытком.
А в соединении с неметаллами (азот, сера, фосфор, углерод, бор) образуют бинарные соединения: нитриды, сульфиды, фосфиды, карбиды, бориды, которые моментально реагируют с водой, преобразуясь в гидроксиды (щелочь).
Исходя из этого, активные щелочные металлы, даже в виде солей, нельзя смешивать с более слабыми (с точки зрения химии) веществами.
Поэтому, калийные подкормки в виде сульфата калия нельзя одновременно применять вместе с азотными, фосфорными или микроудобрениями.
Сульфат калия хорош одновременно только с сульфатом магния — это элементы одной группы щелочноземельных металлов.
Другими словами — щелочи отдельно, кислоты отдельно.
О нитратах.
Не все азотные удобрения — нитраты. В химии нитратами называют соединения NO3 и соли с ними образующиеся.
Самые настоящие нитраты — как раз таки не карбамид с аммиачной селитрой, а соединения NO3 с группой щелочноземельных металлов: К, Na, Ca.
Кстати, в кальциевой селитре азота в два раза больше, столько же и в карбамиде (мочевине).
И как видно из таблицы, калий добавляют в комплексное удобрение отдельным кристаллом хлорида калия.
Из таблицы также можно определить: какое удобрение дает кислую реакцию, а какое щелочную.
Все аммониевые (NH4) соединения при реакции с водой (гидролизе) имеют кислую реакцию — превращаясь в разбавленную азотную кислоту.
А соли с остатком NO3 образуют гидроксильную группу OH, которая тут же схватывается с высвободившимся щелочноземельным элементом и получаются щелочи.
Нейтральной солью является только хлориды. Они не образуют ни щелочи ни кислоты. Поэтому в комплексные удобрения добавляют только хлорид калия, чтобы не вызвать бурной реакции.
Очень интересно ведет себя аммиачная селитра, которая содержит два соединения азота: оксид азота и гидрид азота.
Так вот в ходе реакции разложения конечным пунктом остается высвободившийся азот и вода. И высвобождается огромное количество энергии.
ЗNH4NO3= 2N2 + N0 + N02 + 6Н20 + 966,50 Дж/кг
Но имеет реакцию все же кислую, из-за временного образования молекул азотной кислоты. (HNO3)
Кстати, отсюда напрашивается вывод, раз от аммиачной селитры столько тепла, может поэтому её рассыпают тоннами, причем в сухом виде, ранней весной по полям с озимыми? Она греет прикорневой слой почвы, защищая от возвратных весенних заморозков.
Есть смысл рассыпать её одновременно с посевами раннего редиса или зеленых овощей — и подкормка и подогрев, и вредители её обойдут стороной!
Ну а теперь о марганцовке.
Её формула KMnO4 (пероксид манганат калия или перманганат) получена путем соединения оксида марганца (природного камня) и щелочи KOH.
Почему марганцовка в процессе хранения в водном (приготовленном) виде превращается вначале в бурую мутную жидкость, а после становится прозрачной с коричневым нерастворимым осадком?
Это начинается обратная реакция с водой с участием кислорода и тепла.
То есть наш перманганат превращается обратно в оксид марганца и щелочь.
Поэтому, использовать марганцовку необходимо сразу после приготовления. И тем более нельзя ничего к ней подмешивать.
Окислительно-восстановительная реакция гидролиза перманганата калия крайне не стабильна. На свету и в тепле очень быстро идет обратный процесс разложения.
Марганцовка является сильным окислителем . Восстанавливается до оксида марганца с разной степенью валентности в зависимости от реакции среды, с которую попадет. Наибольшая валентность наблюдается в щелочной среде, наименьшая — в кислой.
И еще одно хорошее свойство марганцовки — она гасит кислоту до воды. То есть является еще и раскислителем.
А в нейтральной среде образует даже немного щелочи KOH.
Марганцовка — очень мощный и надежный антисептик! Наряду с ней стоит перекись водорода H2O2.
Кстати, с перекисью водорода вступает в реакцию с бурным выделением кислорода.
Кислород выделяется также в соединении марганцовки с любыми органическими веществами. (белком)
В связи с этой способностью марганцовку широко применяют в медицине: как раздражающее, прижигающее, обезвреживающее яды и токсины вещество. Её применяют при инфекционно-воспалительных заболеваниях кожи и слизистых оболочек, обработки ран и язв.
Ну и почему её ограничили в свободной продаже в аптеках? Признали наркотическим веществом. Что?!
Ну наверное, зная уникальные свойства марганцовки, можно и похимичить 😜
Единственное, что может случиться от неправильного хранения или смешивания сухих веществ (кальция, алюминия, магния, серы, фосфора) с марганцовкой — взрыв.
Продолжение о свойствах марганцовки и других антисептиках-фунгицидах можно увидеть здесь .
Ну мы здесь собрались не для этого 😏. На этом у меня всё. Надеюсь, что было интересно. Лично я обожаю химию. Ставьте лайк, если тоже её любите)) Пока.
Источник
Примеры ОВР соединений марганца
ОВР соединений марганца
Рассмотрим окислительно – восстановительные свойства соединений марганца, проявляемые ими в разных условиях (в кислотной, нейтральной или щелочной). При проведении ОВР для создания в растворе кислотной среды обычно используют серную кислоту . Азотную кислоту используют крайне редко, так как она сама является сильным окислителем; соляную, бромоводородную и йодоводородную кислоты не используют из-за их способности к окислению. Щелочная среда создается добавлением в раствор гидроксидов натрия или калия.
Перманганат калия К MnO 4 всегда является окислителем. Продукты восстановления зависят от характера среды:
Условия протекания окислительно-восстановительных превращений для соединений марганца можно представить в виде схемы, приведенной на рисунке 2.
Как видно из приведенной на этом рисунке схемы, перманганат-ион, входящий в состав самого популярного в лабораторной практике окислителя, KMnO 4 , в различных средах восстанавливается по-разному. В наибольшей степени окислительные свойства перманганат калия проявляет в кислотной среде, в несколько меньшей – в нейтральной и в наименьшей степени – в щелочной.
Рассмотрим эти случаи на конкретных примерах.
Пример 1. Составьте уравнение реакции, протекающей при пропускании оксида серы ( IV ) через подкисленный серной кислотой раствор перманганата калия.
Для составления уравнения воспользуемся методом электронного баланса.
При составлении уравнений ОВР наличием в растворе гидросульфатных ионов обычно пренебрегают. (Наличием ионов HSO 4 — нельзя пренебрегать при составлении уравнений ОВР типа взаимодействия концентрированной H 2 SO 4 с NaBr (среди прочего образуется NaHSO 4 ), но уравнения этих реакций составляют, используя метод электронного балланса.)
2. После умножения каждого из уравнений полуреакций на соответствующие множители, сложения уравнений и приведения подобных членов получаем ионное уравнение.
2MnO 4 — + 16 Н + + 5SO 2 + 10H 2 O = 2Mn 2+ + 5SO 4 2- + 20 H + + 8H 2 O
3. Добавив в левой части уравнения необходимое количество противоионов и не забывая о них при написании формул продуктов реакции, запишем молекулярное уравнение:
Из уравнения видно, что серная кислота, которая по смыслу задания должна была вступить в реакцию, в действительности в реакцию не вступает, а, наоборот, в процессе реакции выделяется, то есть добавлена в раствор только как средообразователь . Но это скорее исключение, чем правило. Убедимся в этом на другом примере.
Пример 2. Составьте уравнение реакции, протекающей при сливании раствора перманганата калия с раствором аммиака.
1 . Аммиак – слабое основание, поэтому среда в его водном растворе слабощелочная. Перманганат-ион в этих условиях при восстановлении превращается в диоксид марганца, выпадающий из раствора в виде бурого осадка. В нейтральной и щелочной среде очень мало ионов оксония, поэтому для связывания «лишних» атомов кислорода могут быть использованы лишь молекулы воды. Каждая молекула воды, присоединяя один атом кислорода, превращается в два гидроксид-иона. Аммиак в этих условиях окисляется до азота (ближайшая устойчивая степень окисления – ноль).
2. Ионное уравнение:
2MnO 4 — + 10H 2 O + 2NH 3 = 2MnO 2 + 8OH — + N 2 
3. Так как в одной из полуреакций образуются гидроксид-ионы, а в другой – ионы водорода, что вполне допустимо в нейтральной (или близкой к ней) среде, перед приведением подобных членов в ионном уравнении необходимо учесть, что эти ионы одновременно в водном растворе существовать не могут (пройдет реакция нейтрализации).
После приведения подобных членов получаем ионное уравнение:
2MnO 4 — + 2NH 3 = 2MnO 2 + 2OH — + N 2 
4. Запишем молекулярное уравнение:
2 KMnO 4 + 2 NH 3 = 2 MnO 2 + 2 KOH + N 2 
Пример 3. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита калия в присутствии гидроксида калия.
Пример 4. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита натрия в присутствии серной кислоты.
Пример 5. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита натрия.
Источник