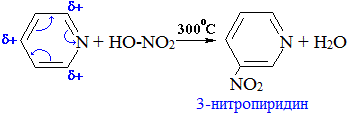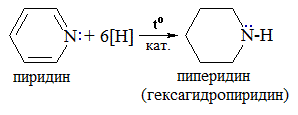Пиридин взаимодействие с водой
Превращения по атому азота
Пиридин – основание средней силы с величиной рКа= 5,2, измеренной в воде (основность алифатических аминов 9-11). Нужно отметить, что в газовой фазе пиридин как основание на 4 порядка сильнее аминов. Пиридин образует кристаллические соли с большинством протонных кислот и часто применяется как основный катализатор или растворитель, способствующий связыванию выделяющихся в ходе той или иной химической реакции кислот.
Как нуклеофил, пиридин реагирует с алкилгалогенидами и другими алкилирующими реагентами по механизму SN2 или SN1 в зависимости от природы субстрата.
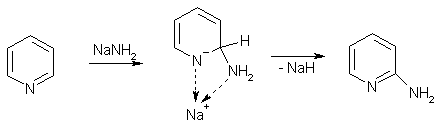
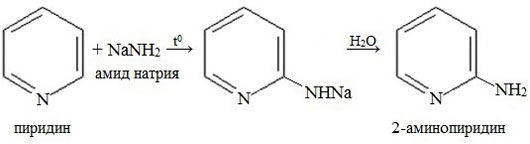
Соли N-алкилпиридиния являются ароматическими соединениями, т.к. неподеленная электронная пара, использующаяся для образования новой связи, не участвует в ароматическом сопряжении. Эти устойчивые вещества проявляют склонность к реакциям с нуклеофилами из-за высокой π-дефицитности, например, аминирование действием амида натрия (реакция Чичибабина) направляется в α-положение
Нуклеофильное гидроксилирование дает α-пиридоны.
При взаимодействии пиридинов с ацилгалогенидами образуются N-ацилиевые соли. Эти соединения мало устойчивы и легко гидролизуются обратно.
Именно по причине низкой устойчивости ацилпиридиниевые соли имеют важное значение для синтетической химии как мягкие ацилирующие реагенты. Например, отметим О-ацилирование кетоенолов – реакция, протекающая по необычному механизму с промежуточным образованием аддукта по α-положению гетероцикла.
При обработке пиридина и его производных надкислотами образуются N-оксиды пиридинов, о свойствах которых будет сказано отдельно.
Реакции по атомам углерода
Взаимодействие с электрофилами
Как было показано выше, пиридин представляет собой π-дефицитное соединение, поэтому взаимодействие с электрофилами для него не характерно, тем более что электрофильные реакции протекают в кислой среде, где во взаимодйствие с электрофилом вступае пиридиниевый ион, обладающий еще большей π-дефицитностью. Эти реакции протекают значительно труднее, чем в бензоле. Пиридин атакуется только сильнейшими электрофилами, причем в весьма жестких условиях. Электрофильное замещение при этом ориентируются в положение 3, что напоминает ориентацию SE2-реакций в нитробензоле (см. главу Нитросоединения). Такая ориентация легко объясняется сравнительной устойчивостью граничных структур, описывающих катионные σ-комплексы, возникающие в результате присоединения электрофила к γ-, β-, и α-положениям пиридинового кольца. Очевидно, что только σ-комплекс II не имеет вклада структуры с положительно заряженным атомом азота.
Как уже было сказано, сначала происходит атака электрофила (или протона) по азоту, что дополнительно пассивирует субстрат, переводя его в катион. Если предотвратить комплексообразование по гетероатому, то реакция атомов ядра с электрофилами протекает более легко.
Нитрование собственно пиридина, особенно нитрующей смесью, когда гетероцикл нацело протонирован, протекает чрезвычайно трудно и практического значения не имеет.
2,6-Диметил- и 2,4,6-триметилпиридины, аминопиридины и пиридоны намного активнее нитруются в форме катионов.
2,6-Дигалогенпроизводные пиридина реагируют легче, т. к. пиридиновый атом азота протонирован в меньшей степени и концентрация свободного основания больше. Нитрование протекает легче в случае использования апротонного нитрующего реагента, например тетрафторбората нитрония:
Сульфирование пиридина серной кислотой протекает несколько легче, чем нитрование, но тоже возможно лишь в жестких условиях. При еще более высоких температурах возможна перегруппировка в 4-сульфокислоту.
Любопытный продукт может быть получен при сульфировании 2,6-ди-трет-бутилпиридина. Само сульфирование протекает особенно легко, т. к. объемные заместители препятствуют комплексообразованию SO3 по атому азота; при нагревании образуется циклический сульфон.
Пиридины могут быть прогалогенированы. Ввести иод в кольцо пиридина с удовлетворительным выходом не удается, однако бром- и хлорпиридины синтезируются весьма просто.
N-Оксиды пиридина проявляют большую активность в реакциях с электрофилами, чем сам пиридин. Существуют два типа электрофильного замещения в N-оксидах: первый вариант (без добавления нуклеофила) приводит, в основном, к N-оксидам 4-замещенных пиридинов. Это на первый взгляд странное обстоятельство связано с замечательной электронной природой N-оксидной функции, которая может быть одновременно не только акцептором, но и донором электронов. Это может быть видно на следующей схеме:
Поэтому N-оксид любого замещенного пиридина, имеющего свободным положение 4, можно пронитровать дымящей HNO3 с хорошим выходом.
Другой подход к использованию N-оксидов – проведение реакции в присутствии слабых нуклеофилов, которые могут входить в состав реагента, например, ацетилнитрата. При этом N-оксид превращается в неароматический аддукт, который и атакуется электрофилом. Можно сказать, что пиридиновый атом азота на время становится донором электронов. Реакция позволяет получить хорошие выходы 3-нитро- и 3,5-динитропиридинов.
Аналогично происходит вступление в положение 5 еще одной нитрогруппы
Более характерными превращениями пиридина являются реакции нуклеофильного замещения. Замещение атома водорода на аминогруппу протекает под действием амида натрия при нагревании и всегда ориентируется в положение 2. Превращение имеет сложный механизм: в ходе реакции выделяются водород, гидрид натрия, аммиак и другие продукты. Тот факт, что водород в положении 4 не замещается, объясняют предварительной координацией атома натрия с пиридиновым азотом.
Обработка пиридинов свежеплавленным едким кали приводит к гидроксилированию до α-пиридонов (α- и γ-гидроксипиридоны существуют в более устойчивой оксо-форме).
Реакции нуклеофильного замещения галогена в пиридине протекают по таким же двум альтернативным механизмам, как и в галогенаренах (см. главу Нуклеофильное замещение в ароматическом кольце) – присоединение-отщепление (АЕ) и отщепление-присоединение (ЕА). Реакция АЕ (присоединение нуклеофила с образованием анионного σ-комплекса и отщепление уходящей группы) протекают преимущественно по атомам 2, 4 и 6, в которых локадизован больший положительный заряд. Кроме того, атом азота участвует в делокализации отрицательного заряда соответствующих σ-комплексов, как нитрогруппа в случае нитрохлорбензолов. Наиболее стабильными являются анионные σ-комплексы I и III.
С помощью реакции типа нуклеофильного АЕ в молекулу пиридина можно ввести самые разнообразные заместители. Вот несколько примеров:
N-оксиды пиридина и N-алкилпиридиниевые соли вступают в те же реакции легче самого пиридина. Особенно интересны N-оксиды α-галогенпиридинов, которые при действии некоторых нуклеофилов сразу превращаются в конденсированные биядерные гетероциклы, в образовании которых участвует N-оксидная группа.
Если галоген находится в положении 3, то реакция пиридинов с нуклеофилами чаще идет по механизму ЕА через промежуточное образование гетероаналога дегидробензола – так называемого гетарина.
При действии атомарных хлора и (при более высоких температурах) брома на пиридин происходит свободнорадикальное галогенирование, которое, в отличие от электрофильного, ориентируется в положения 2 и 6.
Для препаративных целей имеют значение реакции пиридина с нуклеофильными радикалами (реакция Миниши). Источниками радикалов служат различные органические соединения в присутствии перекисей и солей железа(II), катион которого служит в качестве переносчика электронов.
Механизм реакции включает стадии гомолитического разложения перекиси, превращения реагента в свободный радикал, его присоединение к пиридину и последующую ароматизацию.
Таким путем в положение 2 пиридина можно ввести гидроксиметильную группу, диалкиламидную и многие другие функциональные группы.
Источник
Пиридин взаимодействие с водой
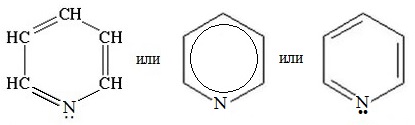
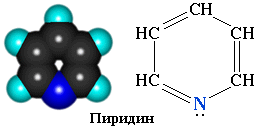
Пиридин С5Н5N – простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота.
Электронное строение молекулы пиридина
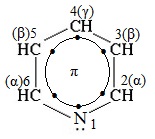
Электронное строение молекулы пиридина сходно со строением бензола. Атомы углерода и азота находятся в состоянии sp 2 -гибридизации. Все s-связи C–C, C–H и C–N образованы гибридными орбиталями, углы между ними составляют примерно 120°. Поэтому цикл имеет плоское строение. Шесть электронов, находящихся на негибридных р-орбиталях, образуют p-электронную ароматическую систему.
Из трех гибридных орбиталей атома азота две образуют s-связи С–N, а третья содержит неподеленную пару электронов, которая не участвует в образовании p-электронной системы.
Физические свойства
Пиридин – бесцветная жидкость с характерным неприятным запахом, Ткип= 115 0 С. Хорошо растворяется в воде и органических жидкостях. Ядовит! Вдыхание его паров может привести к тяжелому поражению нервной системы.
Химические свойства
Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой.
Основные свойства
Неподеленная электронная пара атома азота в молекуле не участвует в образовании единой π-электронной системы, поэтому пиридин подобно аминам, проявляет свойства основания. Пиридин – более слабое основание, чем алифатические амины.
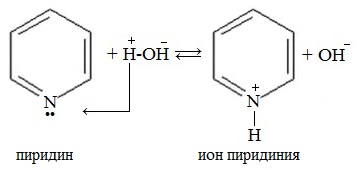
1. Взаимодействие с водой
Водный раствор пиридина окрашивает лакмус в синий цвет.
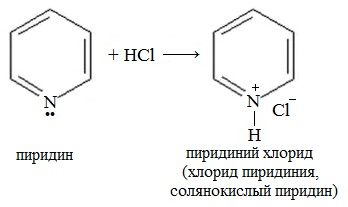
2. Взаимодействие с кислотами
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния.
Ароматические свойства
1. Реакции электрофильного замещения
Наряду с основными свойствами пиридин проявляет свойства ароматического соединения.
Нитрование
Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем у бензола, из-за большой электроотрицательности атома азота. Азот как более электроотрицательный элемент оттягивает электроны на себя и понижает плотность электронного облака в кольце, в особенности в положениях 2, 4 и 6 (орто- и пара- положения), создавая частичный отрицательный заряд в мета-положении.
Атом азота в реакциях электрофильного замещения ведет себя как заместитель II рода, электрофильное замещение идет в положение 3 (мета-положение).
Поэтому реакция нитрования пиридина проходит в более жестких условиях, чем у бензола ( при 300 0 С) и с низким выходом.
2. Реакции присоединения (гидрирование)
Как и бензол, пиридин может присоединять водород в присутствии катализатора с образованием насыщенного соединения пиперидина.
Пиперидин представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин.
3. Реакции нуклеофильного замещения
Аминирование
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара- аминопиридинов (реакция Чичибабина).
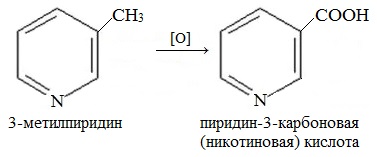
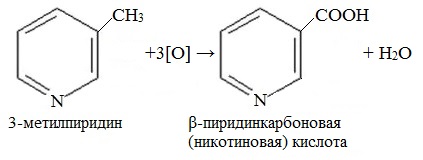
4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты.
Пиридин, как и бензол, устойчив по отношению к окислителям: он не обесцвечивает раствор перманганата калия даже при нагревании.
Получение
1. Выделение из каменноугольной смолы
Пиридин выделяют из каменноугольной смолы, в которой его содержание составляет 0,08%.
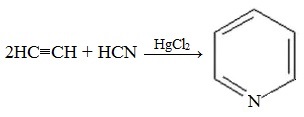
2. Синтез из ацетилена и циановодорода
В лабораторных условиях пиридин можно синтезировать из синильной кислоты (циановодород) и ацетилена:
Биологическая роль
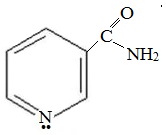
Гомолог пиридина – 3-метилпиридин (β-пиколин) – при окислении образует никотиновую кислоту:
Никотиновая кислота и ее амид – никотинамид
представляют собой две формы витамина РР, который применяется для лечения пеллагры (кожное заболевание).
Многие производные пиридина играют важную роль в природе и жизни человека: они являются витаминами, биологически активными веществами, лекарственными препаратами, красителями и т.п.
Проявляя основные свойства, пиридин и его гомологи известны под общим названием пиридиновые основания.
Источник