- Урок 27. Состав и физические свойства воды
- Состав и строение воды
- Физические свойства воды
- Вода как растворитель
- План описания физических свойств вещества вода
- Физические свойства воды
- Химические свойства воды
- Вода в жизнедеятельности человека. Водные растворы
- Урок «Вода. Физические свойства воды»
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Общая информация
- Похожие материалы
- Урок. Практическая работа «Измерение удельной теплоемкости воды»
- Урок «Биосфера» (10 класс)
- Урок «Введение в естествознание»
- Презентация к уроку «Биосфера»
- Проектная задача по окружающему миру » Кошкин дом» ( 3 класс)
- Научно-практическая работа «Зачем нужны кормушки»
- Методическая разработка для студентов «Проведение термометрии, регистрация результатов»
- ОУД Технологическая карта тема : «Птицы,которые не улетают.»
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Подарочные сертификаты
Урок 27. Состав и физические свойства воды
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Состав и строение воды
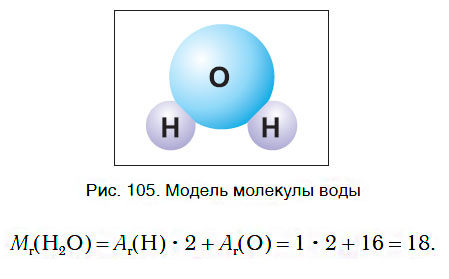
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
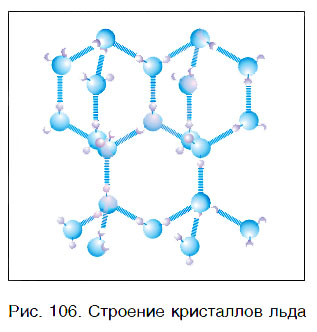
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см 3 , а плотность жидкой воды — примерно 1,00 г/см 3 . Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.
При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
План описания физических свойств вещества вода
Ключевые слова конспекта: вода, физические и химические свойства воды, водные растворы.
Физические свойства воды
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха, плотность 1 кг/л, температура кипения 100 °С при 1 атм, температура плавления 0°С. У воды высокая удельная теплоемкость — 4,12 кДж/кг К), поэтому она долго нагревается и медленно остывает. У воды большая теплота испарения. На испарение 1 г воды требуется 2,25 кДж теплоты.
Атомы Н и О в молекуле воды соединены полярными ковалентными связями. На атоме водорода в молекуле Н2О имеется небольшой положительный заряд δ+, а на атоме кислорода — небольшой отрицательный δ-. Поскольку молекула воды имеет уголковое строение, она представляет собой двухполюсную частицу — диполь: 
Химические свойства воды
Вода реагирует со многими металлами по типу реакций замещения.
С наиболее активными металлами — от Li по Аl в ряду активности металлов при комнатной температуре протекают реакции замещения одного атома Н в молекуле Н2O. С магнием реакция идет при нагревании, с алюминием — после снятия защитной оксидной пленки. В реакции образуются гидроксиды металлов — соединения, содержащие гидроксогруппу ОН, и водород:
2Li + 2Н2O = 2LiOH + Н2↑,
Са + 2Н2O = Са(ОН)2 + Н2↑.
Менее активные металлы — Zn, Mo, W, Fe — взаимодействуют с водой при высокой температуре (400-600 °С). В этих реакциях образуются оксиды металлов и водород:
Zn + Н2O = ZnO + Н2↑,
3Fe + 4Н2O = Fe3O4 + 4Н2↑
Вода реагирует с оксидами активных металлов (реакция гидратации). При этом получаются растворимые в воде гидроксиды металлов — щелочи:
Na2O + Н2O = 2NaOH,
СаО + Н2O = Са(ОН)2.
Вода соединяется с оксидами многих неметаллов. При этом получаются растворимые в воде гидроксиды неметаллов — кислоты:
СO2 + Н2O = Н2СO3,
SO3 + Н2O = H2SO4.
Гидролиз — это обратимая реакция обмена, например соли с водой. При этом происходит расщепление молекул воды на Н и ОН, которые входят в состав двух новых веществ:
К2СO3 + Н2O = КНСО3 + КОН,
РСl3 + ЗН2O = Н3РО3 + ЗНСl.
Вода в жизнедеятельности человека. Водные растворы
Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды. Все процессы в живой клетке осуществляются в водной среде. В сутки человеку необходимо 2 л питьевой воды. Кроме того, вода нужна, чтобы варить пищу, стирать белье, умываться. Большие количества пресной воды расходуются в промышленности и сельском хозяйстве (растворитель). Отметим, что соленая вода морей и океанов для этих целей непригодна. Доля пресной воды в общих запасах воды на Земле составляет менее 3% от всех водных ресурсов.
Вода — химический реагент. Соединяясь с оксидами активных металлов, вода образует щелочи, а в реакциях с оксидами неметаллов дает кислоты — два больших и важных в деятельности человека класса веществ. Один из способов синтеза этилового спирта (этанола) C2H5OH — реакция этилена С2Н4 с водой:
Жесткость воды — это свойства воды, обусловленные содержанием в ней ионов Са 2+ , Mg 2+ , Fe 2+ . Если концентрация этих ионов велика, то воду называют жесткой, если мала — мягкой. При стирке с мылом в жесткой воде образуются осадки, часть мыла уходит в осадок и ухудшается качество ткани. Такая вода непригодна для охлаждения в радиаторах автомобилей, в паровых котлах и стиральных машинах. При нагревании жесткой воды образуется накипь, которая забивает трубы и ускоряет изнашивание механизмов. Различают временную и постоянную жесткость воды.
Временная или карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Са(НСО3)2, магния Mg(HCO3)2 и железа Fe(HCO3)2. При кипячении воды гидрокарбонаты разлагаются с образованием осадка карбоната, и жесткость воды снижается:
Са(НСO3)2 = СаСО3↓ + СO2↓ + Н2O,
Fe(HCO3)2 = FeCO3↓ + CO2↓ + Н2O.
Другой способ устранения временной жесткости — действие известкового молока или соды:
Постоянная жесткость воды обусловлена присутствием в ней хлоридов, сульфатов и других растворимых солей кальция, магния и железа. Ее устраняют действием соды:
СаСl2 + Na2CO3 = СаСO3↓ + 2NaCl.
Водный раствор — разновидность раствора, в котором растворителем служит вода. Будучи превосходным растворителем, именно вода используется для приготовления большинства растворов в химии.
Вещества, которые плохо растворяются в воде, называют гидрофобными (‘боящимися воды’), а хорошо в ней растворяющиеся — гидрофильными (‘любящими воду’). Примером типичного гидрофильного соединения может служить хлорид натрия (поваренная соль).
Если вещество образует водный раствор, который хорошо проводит электрический ток, то он называется сильным электролитом; в противном случае — слабым.
Конспект урока по химии «Вода. Свойства воды. Водные растворы». Выберите дальнейшее действие:
Источник
Урок «Вода. Физические свойства воды»
Тема урока: Вода. Физические свойства воды.
Тип урока: урок обобщения и систематизации знаний (общеметодологической направленности)
Вид урока: урок смешанного типа
Технология урока: развивающее обучение;
Цели урока: Обобщение и расширение сведений о физических свойствах воды из курса основной школы на основе межпредметных связей с физикой, химией и биологией.
· систематизация знаний о воде, о физических свойствах воды; закрепление знаний учащихся о составе, строении и свойствах воды. Развивающая:
· продолжить развитие умений определять цели, задавать параметры и критерии, по которым можно определить, что цель
- продолжить развитие умений работать с текстом и иллюстрациями учебника, таблицами;
- развитие познавательного интереса учащихся, расширение их кругозора, развитие навыков самостоятельной работы с научно-технической, справочной литературой;
- формирование у учеников навыков самоконтроля
- развитие коммуникативных навыков
Планируемые результаты обучения: В ходе урока учащиеся систематизируют физические свойства воды в виде таблицы, расширят свой кругозор.
Основные термины, понятия : поверхностное натяжение воды, плотность, радиоактивность воды, сжимаемость воды, вязкость воды.
Оборудование: мультимедийный проектор, учебник.
1. Организационный момент. 1 мин.
2. Начальный этап. Мотивация 4 мин.
3. Актуализация знаний и фиксирование затруднений. 6 мин.
4. Составление плана. 3 мин.
5. Основной этап. Реализация плана. 10 мин.
6. Этап самостоятельной работы. 15 мин.
7. Рефлексия. Взаимное оценивание ответов. 5 мин.
8. Домашнее задание. 1 мин.
Проверяет готовность класса к уроку, настраивает учащихся на урок.
Приветствуют учителя. Проверяют готовность к уроку.
2. Начальный этап.
Мотивация. 4 мин.
Предлагает высказывание китайского философа Лао Цзы. Просит определить о чем пойдет речь на уроке.
Читает по одному высказыванию.
Хотя в мире нет предмета, который был бы слабее и нежнее ЕЕ, но ОНА может разрушить самый твердый предмет
ОНА — это самое мягкое и самое слабое существо в мире, но в преодолении твердого и крепкого ОНА непобедима, и на свете нет ей равного.
ОНА приносит пользу всем существам, и не борется (с ними). ОНА находится там, где люди не пожелали бы быть.
Чтобы быть сильным, надо быть как ОНА. Нет препятствий – ОНА течёт; плотина – ОНА остановится; прорвётся плотина – ОНА снова потечёт; в четырёхугольном сосуде ОНА четырёхугольна; в круглом – кругла. Оттого, что ОНА так уступчива, ОНА нужнее всего и сильнее всего.
Помогает сформулировать цель урока.
Слушают высказывание. Определяют о чем пойдет речь на уроке. Формулируют цель урока с помощью учителя.
3. Актуализация знаний и фиксирование затруднений. 6 мин.
Итак, что мы знаем о воде?
Фиксирует затруднения, дополняет, резюмирует:
К основным физическим свойствам воды относят цвет, запах, вкус, прозрачность, температуру, плотность, сжимаемость, вязкость, теплопроводность, высокие удельная теплоемкость удельная теплота плавления и парообразования, высокое поверхностное натяжение. радиоактивность, электропроводность.
Вы молодцы, назвали некоторые свойства воды, как вы думаете, от чего зависят физические свойства вещества?
Хорошо, но что мы знаем о строении молекулы воды?
Отвечают на вопрос.
Предположительно называют формулу воды, свойства, агрегатные состояния, температуру кипения и кристаллизации, молекулярную массу, удельную теплопроводность.
Отвечают на вопрос.
Свойства вещества зависят от состава и строения молекул, от их взаимного расположения.
Предлагают узнать больше о строении молекулы воды.
4. Составление плана. 3 мин.
Предлагает составить план работы.
Предлагает включить в план работы заполнение таблицы «Физические свойства воды» пользуясь учебником приложение 1
Составляют план работы.
Планируют изучить строение молекулы воды по учебнику параграф 28.
Планируют заполнить таблицу «Физические свойства воды» приложение 1
5. Основной этап. Реализация плана.
Выводит на экран рисунок молекулы воды.
Сейчас мы запишем в тетрадь «скелет» нашей воды. На доске рисуется или проецируется проектором структурная формула молекулы воды.
Что означают линии соединяющие атомы водорода с атомами кислорода? Найдите соответствующий рисунок в учебнике, параграф 28.
О каких связях в молекуле воды идет речь?
Почему молекулярная масса обычной воды обычно больше чем 18 (расчетное значение)?
Чем отличается взгляд физиков и химиков на межмолекулярную водородную связь?
Работают с учебником. Зарисовывают молекулу воды. Описывают ее.
Отвечают на вопросы.
Делают записи в тетради.
6.Этап самостоятельной работы Самостоятельная работа с учебником по систематизации физических свойств воды. 15 мин.
Сообщает о начале следующего этапа – самостоятельной работе по систематизации физических свойств воды. Предлагает оформить таблицу и сравнить ее с эталоном. Пустую таблицу высвечивает проектор.
Заполняют таблицу с помощью учебника. Параграф 28 и с помощью интернета.
Через 15 минут осуществляют самопроверку по эталону.
Что нового о воде вы узнали сегодня?
Все ли свойства воды вы отметили в таблице?
Есть ли свойства, которые не отмечены в таблице?
Отвечают на вопросы. Обмениваются ответами. Получают дополнительные баллы.
8. Домашнее задание.
Озвучивает домашнее задание.
Прочитать п. 28 учебника до химических свойств.
Написать эссе на темы:
1.Планетарное значение свойств воды.
2. Вода в организме человека.
3. Аномальные свойства воды.
4. Экология воды.
5. Вода и ее роль в экологии человека.
Благодарит за урок.
Записывают домашнее задание.
Благодарят за урок.
Список используемой литературы:
1. Учебник «Естествознание» 10 класс. О. С. Габриелян
2. «Тайны вселенной» № 6, 2016. «Какую информацию нам несет вода».
3. И.В.Галыгина и др. Современные технологии преподавания химии 8-11 классы УМП, М. Издательский Центр «Вентана-Граф» 2009г.
4. О.С.Габриелян и др. Химия. Вода в нашей жизни. Методическое пособие М. Дрофа, 2011г.
5. Естествознание. Базовый уровень. 10 класс. Книга для учителя. Габриелян О.С., Сладков С.А., Остроумов И.Г.
6. Естествознание. 10–11 классы. Рабочие программы. Габриелян О.С., Сладков С.А.
7. http://bioenc.ru/
Физические свойства воды
Цвет зависит от их химического состава и механических примесей. Желтоватый цвет характерен для вод болотного происхождения, содержащих гуминовые вещества.
Ощущение запаха свидетельствует или о наличии газов биохимического происхождения (сероводород и др.), или о присутствии гниющих органических веществ. Характер запаха выражают описательно: без запаха, сероводородный, болотный, гнилостный, плесневелый и т.д.
Зависит от количества растворенных в них минеральных веществ, содержания механических примесей, органических веществ и коллоидов. Для указания степени прозрачности подземных вод служит следующая номенклатура: прозрачная, слабопалесцирующая, опалесцирующая, слегка мутная, мутная, сильно мутная. Подземные воды обычно бывают прозрачными.
За единицу плотности воды принята плотность дистиллированной воды при температуре 4°С. Плотность воды зависит от температуры, количества растворенных в ней солей, газов и взвешенных частиц и изменяется от 1 до 1,4 г/см 3 .
Незначительна и характеризуется коэффициентом сжимаемости β = (2,7-5)10 -5 Па.
В основном бесвкусна.
Зависит от состава растворенных веществ. Соленый вкус вызывается хлористым натрием, горький — сульфатом магния, ржавый — солями железа. Сладковатый вкус имеют воды, богатые органическими веществами, наличие свободной углекислоты придает приятный освежающий вкус.
Вязкость воды характеризует внутреннее сопротивление частиц жидкости ее движению, количественно она выражается коэффициентами динамической и кинематической вязкости.
Сушествует в трех агрегатных состояниях одновременно при одной температуре. Высокие температуры кипения и плавления.
Высокая удельная теплоемкость, удельная теплота плавления и парообразования.
Высокий коэффициент поверхностного натяжения.
Зависит от количества растворенных в них солей. Пресные воды обладают незначительной электропроводностью. Дистиллированная вода является изолятором.
Электропроводность воды оценивают по удельному электрическому сопротивлению, которое выражается в Ом . м и изменяется от 0,02 до 1,0 Ом . м.
Определяется содержанием в ней радона, эманации радия. За редким исключением подземные воды в той или иной степени радиоактивны.
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Общая информация
Международная дистанционная олимпиада Осень 2021
Похожие материалы
Урок. Практическая работа «Измерение удельной теплоемкости воды»
Урок «Биосфера» (10 класс)
Урок «Введение в естествознание»
Презентация к уроку «Биосфера»
Проектная задача по окружающему миру » Кошкин дом» ( 3 класс)
Научно-практическая работа «Зачем нужны кормушки»
Методическая разработка для студентов «Проведение термометрии, регистрация результатов»
ОУД Технологическая карта тема : «Птицы,которые не улетают.»
Не нашли то что искали?
Воспользуйтесь поиском по нашей базе из
5220985 материалов.
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
В школах Ростовской области осенние каникулы начнутся раньше срока
Время чтения: 1 минута
Российским школьникам проведут бесплатные профориентационные тесты
Время чтения: 1 минута
Рособрнадзор оставил за регионами решение о дополнительных школьных каникулах
Время чтения: 1 минута
В Госдуме предложили установить предельно допустимые цены за обучение в вузах
Время чтения: 1 минута
В России объявлены нерабочие дни с 30 октября по 7 ноября
Время чтения: 2 минуты
В школе в Пермском крае произошла стрельба
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник