Добыча нефти и газа
Изучаем тонкости нефтегазового дела ВМЕСТЕ!
Состав и физико-химические свойства пластовой воды
По мере эксплуатации нефтяных месторождений скважины постепенно обводняются. Содержание пластовой воды в скважинной продукции растёт и может достигать 95%. Поэтому важно знать, какое влияние оказывает пластовая вода на процесс добычи нефти и газа.
Состав пластовых вод разнообразен и зависит от природы эксплуатируемого нефтяного пласта, физико-химических свойств нефти и газа. В пластовых водах всегда растворено некоторое количество солей. Больше всего в воде содержится хлористых солей (до 80-90% от общего содержания солей).
Виды пластовых вод:
— подошвенные (вода, заполняющая поры коллектора под залежью);
— краевые (вода, заполняющая поры вокруг залежи);
— промежуточные (между пропластками);
— остаточные (оставшаяся со времён образования залежи вода).
Все эти виды вод представляют собой единую гидродинамическую систему. Пластовая вода часто является агентом, вытесняющим нефть из пласта, следовательно, её свойства влияют на количество вытесненной нефти.
3.2.1. Физико-химические свойства пластовых вод
Плотность пластовых вод сильно зависит от минерализации, т.е. содержания растворённых солей. В среднем плотность пластовой воды составляет 1010-1210 кг/м3.
Тепловое расширение воды характеризуется коэффициентом теплового расширения:

Из формулы следует, что коэффициент теплового расширения воды (Е) характеризует изменение единицы объёма воды при изменении её температуры на 1°С. По экспериментальным данным в пластовых условиях он колеблется в пределах (18-90)×10-5 1/°С. С увеличением температуры коэффициент теплового расширения возрастает, с ростом пластового давления – уменьшается.
Коэффициент сжимаемости воды характеризует изменение единицы объёма воды при изменении давления на единицу:

Коэффициент сжимаемости воды изменяется в пластовых условиях в пределах 3,7×10-10 – 5,0×10-10 Па-1. При наличии растворённого газа он увеличивается, и приближённо может рассчитываться по формуле:
bвг = bв (1+0,05×S), (3.31)
где S – количество газа, растворённого в воде, м3/м3.
Объёмный коэффициент пластовой воды характеризует отношение удельного объёма воды в пластовых условиях к удельному объёму воды в стандартных условиях:

Увеличение пластового давления способствует уменьшению объёмного коэффициента, а рост температуры – увеличению. Объёмный коэффициент изменяется в пределах 0,99-1,06.
Вязкость воды в пластовых условиях зависит, в основном, от температуры и минерализации. От давления вязкость зависит слабо. Наибольшую вязкость имеют хлоркальциевые воды (в 1,5-2 раза больше чистой воды).
Минерализация воды – содержание растворённых солей в г/л. По степени минерализации пластовые воды делятся на четыре типа:
Минерализация пластовой воды растёт с глубиной залегания пластов.
По типу растворённых в воде солей различают хлоркальциевые (хлоркальциево-магниевые) и гидрокарбонатные (гидрокарбонатно-натриевые, щелочные) пластовые воды. Тип пластовой воды определяется соотношением ионов растворённых солей:
— анионов: OH–; Cl–; SO42–; CO32–; HCO3–;
— катионов: H+; K+; Na+; NH4+; Mg2+; Ca2+; Fe3+;
— ионов микроэлементов: I–; Br–;
— коллоидных частиц SiO2; Fe2O3; Al2O3;
— нафтеновых кислот и их солей.
Состав воды определяет её жёсткость. Жёсткостью называется суммарное содержание растворённых солей кальция, магния, железа.
Жёсткость подразделяется на временную (карбонатную) и постоянную (некарбонатную).
Временная жёсткость или карбонатная (Жк) обусловлена содержанием в воде гидрокарбонатов двухвалентных металлов (кальция, магния, железа).
Постоянная жёсткость или некарбонатная (Жнк) обусловлена наличием в воде сульфатов и хлоридов двухвалентных металлов (кальция, магния, железа).
Общая жёсткость воды определяется как сумма карбонатной и некарбонатной:
Жо = Жк + Жнк (3.33)
Жёсткость воды оценивается содержанием в ней солей в миллиграмм-эквивалентах на литр 
Жк , Жнк оценивают как сумму жесткостей всех i-ых ионов (∑gi ):

где mvi – концентрация i-го иона в воде (мг/л);
эi – эквивалент i-го иона.

где Мi – молекулярная масса иона;
n – валентность иона.
Тип природной воды характеризуется в зависимости от содержания двухвалентных катионов:
— очень мягкая вода – до 1,5 мг-экв./л;
— мягкая вода – 1,5-3,0 мг-экв./л;
— умеренно жёсткая вода – 3,0-6,0 мг-экв./л;
— жёсткая вода – более 6 мг-экв./л.
Временную (карбонатную) жёсткость можно устранить термическим методом (длительным кипячением) или химическим методом – добавлением гидроксида кальция Са(ОН)2.
В обоих случаях выпадает в осадок карбонат кальция СаСО3.
Постоянную жёсткость устраняют химическим способом с помощью добавления соды или щёлочи.
Содержание водородных ионов в воде определяется параметром рН: 
Вода, находясь в контакте с нефтью, частично в ней растворяется. Коэффициент растворимости нефти в воде зависит от наличия в воде полярных составляющих. Чем легче нефть, тем меньше в ней растворено воды. Нефти парафинового основания содержат мало воды. С ростом в нефти содержания ароматических углеводородов и гетероатомных соединений, растворимость воды в нефти растёт.
За счёт растворения воды в нефти происходят изменения в зоне водонефтяного контакта. Чёткой границы вода-нефть не существует. За счёт растворения воды образуется т.н. «переходная зона», величина которой зависит от полярности нефти.
Источник
Состав и физико-химические свойства пластовой воды
СОСТАВ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПЛАСТОВОЙ ВОДЫ
По мере эксплуатации нефтяных месторождений скважины постепенно обводняются. Содержание пластовой воды в скважинной продукции растёт и может достигать 95-98 %. Поэтому важно знать, какое влияние оказывает пластовая вода на процесс добычи нефти и газа.
Состав пластовых вод разнообразен и зависит от природы эксплуатируемого нефтяного пласта, физико-химических свойств нефти и газа.
Различают следующие виды пластовых вод:
подошвенные (вода, заполняющая поры коллектора под залежью);
краевые (вода, заполняющая поры вокруг залежи);
промежуточные (между пропластками);
остаточные (вода оставшаяся со времён образования залежи).
Все эти виды вод представляют собой единую гидродинамическую систему. Как отмечалось выше в продуктивных горизонтах нефтяных и газовых залежей остаточная водонасыщенность составляет в среднем 6-35 % от объёма пор в коллекторах. С приближением к зоне водонефтяного контакта (ВНК) количество воды постепенно увеличивается за счет капиллярного подъема. Процентное содержание остаточной воды может быть и выше. При этом вода не вся находится в поровом пространстве, а образует так называемые переходные зоны (ПЗ), что наблюдается на некоторых месторождениях Западной Сибири: Советско-Соснинское (на границе Томской и Тюменской области), Суторминское (Ноябрьск), Приобское (Сургут) и др. Такие явления характерны для низкопроницаемых недонасыщенных пластов. Толщины ПЗ могут быть сопоставимы с толщинами продуктивных пластов, что создает серьезные проблемы в разработке месторождений.
Химические свойства пластовых вод
Химические свойства пластовых вод
Пластовые воды характеризуются набором свойств влияющие на процессы вытеснения нефти, так как она часто являясь вытесняющим агентом нефти из пласта, а следовательно, её свойства влияют на количество вытесненной нефти, на процессы подъема нефти на поверхность, на процессы сбора и подготовки скважинной продукции.
5.1.1. Минерализация пластовой воды
Минерализация пластовой воды
Минерализация воды характеризует содержание в ней растворённых солей в г/л, мг/л, г/м 3 , кг/м 3 . В пластовых водах всегда растворено некоторое количество (Q) солей. По степени минерализации пластовые воды делятся на четыре группы:
рассолы (Q > 50 г/л);
солёные (10 3 в пресной воде до 300 кг/м 3 в концентрированных рассолах.
В пластовой воде содержатся ионы растворённых солей:
катионы: H + ; K + ; Na + ; NH4 + ; Mg 2+ ; Ca 2+ ; Fe 3+ ;
ионы микроэлементов: I – ; Br – ;
нафтеновые кислоты и их соли.
Больше всего в воде содержится хлористых солей, до 80-90 % от общего содержания солей. В количественном отношении катионы солей пластовых вод располагаются в следующий ряд: Na + ; Ca 2+ ; Mg 2+ ; K + ; Fe 3+ .
Большое значение на растворимость солей и увеличение их концентрации в пластовых водах оказывает температура и парциальное давление СО2. Максимальная растворимость СаСО3 в воде наблюдается при 0 о С, с возрастанием температуры она падает. Максимальная растворимость гипса (СаSО4·2Н2О) в воде наблюдается при 40 о С. С дальнейшим возрастанием температуры она уменьшается. С увеличением парциального давления СО2 растворимость СаСО3 возрастает. Уменьшение пластового давления усиливает процесс выпадения солей СаСО3 и др. Изменение термобарической обстановки в пласте даже при небольшой минерализации пластовых вод влияет на растворимость солей и на процесс их выпадения.
5.1.2. Тип пластовой воды
Тип пластовой воды
По типу растворённых в воде солей различают хлоркальциевые (хлоркальциево-магниевые) и гидрокарбонатные (гидрокарбонатно-натриевые, щелочные) пластовые воды. Тип пластовой воды определяется анионом. Гидрокарбонатный тип воды определяется солями угольной кислоты, обусловленный наличием карбонат — CO3 2– , или бикарбонат — HCO3 – аниона. Соли всех остальных кислот относятся к хлоркальциевому типу. В основном, это соли соляной кислоты – хлориды, обусловленный наличием Cl – – аниона.
5.1.3. Жесткость пластовых вод
Жесткость пластовых вод
Соли пластовых вод влияют, и определяет её жёсткость. Жёсткостью называется суммарное содержание растворённых солей двухвалентных катионов: кальция, магния и железа.
Жёсткость различают временную (карбонатную) и постоянную (некарбонатную). Временная жёсткость или карбонатная (Жк) обусловлена содержанием в воде карбонатов или гидрокарбонатов двухвалентных металлов: кальция, магния, железа.
Постоянная жёсткость или некарбонатная (Жнк) обусловлена наличием в воде сульфатов или хлоридов (или соли других кислот) двухвалентных металлов: кальция, магния, железа.
Общая жёсткость воды определяется как сумма карбонатной и некарбонатной:
Жёсткость воды оценивается содержанием в ней солей в миллиграмм эквивалентах на литр 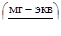
Жк, Жнк оценивают как сумму жесткостей всех i-ых ионов (∑gi):
Жесткость иона оценивается отношением массы иона к его эквиваленту:
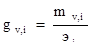
где mvi – концентрация i-го иона в воде (мг/л);
эi – эквивалент i-го иона.
Эквивалент иона оценивается отношением молекулярной массы иона (МI) к его валентности (n):
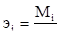
где Мi – молекулярная масса иона;
n – валентность иона.
Рассмотрим пример. В одном литре воды содержатся ионы в количестве: Mg +2 =21мг и Ca +2 = 56 мг. Найти общую жесткость?.
Решение. Определим жесткость обусловленную наличием в воде ионов магния и сальция. Воспользуемся формулами 5.1–5.4:
Ж =G (мг -экв/л), g = m / Э, Э = Mn / Nn,
где Mn — масса иона;
Nn — валентность иона.
ММg = 24,3; ЭMg = 24,3 /2 = 12,5 мг-экв;
МCa = 40,08; ЭCa = 40,08 / 2 = 20 мг-экв;
gMg = 21/12,15 = 1,72 мг-экв/л; ЖMg = 1,728 мг — экв/л;
gCa = m/э = 56/20,04 = 2,79 мг-экв/л; ЖCa = 2,79 мгэкв/л;
Жобщ = ЖСa + ЖMg = 2,79 + 1,728 = 4,5181 (мг — экв/л).
Природные воды в зависимости от содержания в них двухвалентных катионов кальция, магния, железа подразделяются на следующие группы:
очень мягкая вода – до 1,5 мг-экв./л;
мягкая вода – 1,5-3,0 мг-экв./л;
умеренно жёсткая вода – 3,0-6,0 мг-экв./л;
жёсткая вода – более 6 мг-экв./л.
Жесткость пластовой воды и ее группа по жесткости определяется экспериментально-расчетным путем (см. разд. «Практикум для самостоятельной работы»).
Временную (карбонатную) жёсткость можно устранить термическим методом, длительным кипячением или химическим методом – добавлением гидроксида кальция Са(ОН)2. В обоих случаях выпадает в осадок карбонат кальция СаСО3.
Постоянную жёсткость устраняют химическим способом с помощью добавления соды или щёлочи.
5.1.4. Показатель концентрации водородных ионов
Дата добавления: 2019-02-12 ; просмотров: 621 ; Мы поможем в написании вашей работы!
Источник




