- Химия, Биология, подготовка к ГИА и ЕГЭ
- свойства молекулы воды
- Оксид водорода
- Содержание
- Физические и химические свойства
- Физические свойства
- Агрегатные состояния
- Изотопные модификации воды
- Химические свойства
- Вода в природе
- Атмосферные осадки
- Виды воды
- Характеристики вод
- Исследования воды
- Гидрология
- Биологическая роль
- Применение
- Земледелие
- Питьё и приготовление пищи
- Растворитель
- Теплоноситель
- Пожаротушение
- Спорт
- Инструмент
Химия, Биология, подготовка к ГИА и ЕГЭ
Размышления ( не учебный материал . ) на тему
свойств молекулы воды
Автор статьи — Саид Лутфуллин
Самое распространенное вещество на нашей планете. Без нее не было бы жизни. Все живые структуры, за исключением вирусов, по большей части состоят из воды. На ее примере детям в школе объясняют строение молекул, химические формулы. Свойства, характерные только для воды, используются в живой природе, а так же в хозяйственной жизни человека.
С детства нам знакомое вещество, никогда не вызывавшее каких-то вопросов. Ну вода, и что? А в таком простом, казалось бы, веществе скрыто много загадок.
свойства молекулы воды
Вода — основной природный растворитель. Все реакции в живых организмах так или иначе протекают в водной среде, вещества реагируют в растворенном состоянии.
У воды отличная теплоемкость, но довольно малая теплопроводность. Это позволяет использовать воду как транспорт тепла. На этом принципе основан механизм охлаждения многих организмов. А в атомной энергетике и воду, благодаря этому свойству, используют в качестве теплоносителя.
В воде не только протекают реакции, она сама вступает в реакции. Гидратация, фотолиз и т. д.
Это только некоторые свойства, ни одно вещество не может похвастаться таким наборов свойств. Поистине это вещество уникально.
Ну а теперь ближе к теме.
Всегда, везде, даже в школе на уроках химии ее называют просто «вода».
А вот какое химическое называние и свойства молекулы воды?
На просторах интернета и учебной литературы можно встретить такие называния: оксид водорода, гидроксид водорода, гидроксильная кислота. Это самые наиболее часто встречающиеся.
Так к какому все таки классу неорганических веществ относится вода?
Давайте разберемся в этом вопросе.
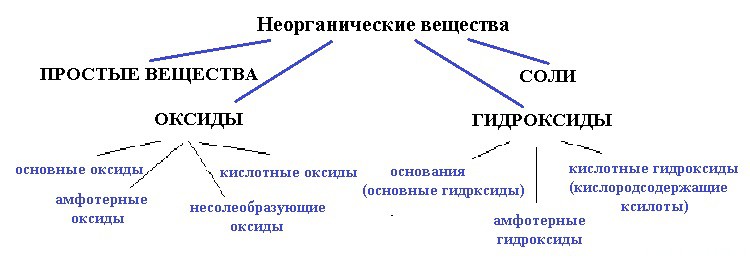
Ниже приведена схема:
вода — точно не простое вещество, так как образована атомами разных элементов;
и не соль, так как связь в солях между катионом и анионом должна быть ионной, катионом должен быть металл, а в молекуле воды связи только ковалентные и катион — водород (неметалл).
Для начала разберемся — оксид это или гидроксид. Что с уверенностью можно сказать, так это то, что вода — это точно не оксид.
Хотя, если поверхностно посмотреть, то вода, в принципе, попадает под определение оксида водорода. Образуется в результате реакции полного окисления водорода: 2H2 + O2 → 2H2O, кислород в низшей степени окисления.
Рассмотрим по свойствам :
Свойства основных оксидов:
Взаимодействие с кислотами.
Взаимодействие с кислотными оксидами.
Взаимодействие с амфотерными оксидами.
Молекула воды обладает только одним свойством основного оксида — это взаимодействие с кислотными оксидами.
Свойства кислотных оксидов:
Взаимодействие со щелочами.
Взаимодействие основными оксидами.
Взаимодействие амфотерными оксидами.
Молекула воды так же проявляет только одно свойство: взаимодействие основными оксидами.
По свойствам молекула воды проявляет двойственную природу : реагирует с кислотными и основными оксидами.
Но воду нельзя отнести к амфотерным оксидам, так как амфотерные оксиды образуют металлы, а водород — неметалл.
Выходит, если вода — все таки оксид, значит несолеобразующий.
Но, может это будет сенсацией, ВОДА ОБРАЗУЕТ СОЛИ!
Но об этом немного позже.
Из приведенных выше доказательств следует, что вода — не оксид. Еще один аргумент «против оксида»: ни один оксид не диссоциирует на ионы, а одно из свойств молекулы воды — частичная диссоциация на катион H + и анион OH — .
Исходя из предыдущего: в воде два «разных» водорода. Один в катионе, другой — в анионе.
И формулу воды следует писать не так как мы привыкли: H2O, а
HOH
Следовательно, вода — это гидроксид.
Эта версия более правдоподобна: гидроксильная группа явно намекает на что-то подобное. Но какой гидроксид? Давайте опять разберем по свойствам гидроксиды:
Свойства основных гидроксидов (оснований):
Для растворимых оснований (щелочей):
Для растворимых оснований (щелочей) характерны реакции ионного обмена.
Взаимодействие растворимых оснований (щелочей) с кислотными основаниями.
Взаимодействие с амфотерными гидроксидами.
Нерастворимые основания разлагаются при нагревании.
Молекула воды не проявляет ни одного свойства, только разве что, при сильном нагревании, она подвергнется разложению, ну а это со всеми веществами так — есть определенный порог температуры, выше которого связи не могут больше существовать и разрушаются.
Так же аргумент, «против» амфотерного и основного гидроксида — основные и амфотерные гидроксиды образуют только металлы.
Теперь подходим к самой интересной части. Выходит, что вода — это
кислотный гидроксид, то есть кислородосодержащая кислота.
Рассмотрим по свойствам.
Для кислотных гидроксидов характерны:
Реакции с металлами.
Реакции с основными и амфотерными оксидами.
Реакции с основаниями и амфотерными гидроксидам.
Реакции с солями.
Для сильных кислот так же реакции ионного обмена.
Вытеснение более слабых, а так же летучих кислот из солей.
Для молекулы воды характерны почти все эти свойства.
- Реакции с металлами. Не все металлы способны реагировать с водой. Вода как кислота — очень слабая, но, тем не менее, это свойство она проявляет:
HOH + Na → NaOH + H2↑ — из воды вытесняется водород — вода ведет себя, как большинство кислот.
- Реакции с основными и амфотерными оксидами. С амфотерными оксидами не реагирует, так как кислотные свойства слабые, но реагирует с основными оксидами (не со всеми правда, это объясняется слабыми кислотными свойствами):
HOH + Na2O → 2NaOH
- Реакции с основаниями и амфотерными гидроксидам. Тут вода не может похвастаться такими реакциями — из-за своей слабости как кислоты.
- Реакции с солями. Некоторые соли подвергаются гидролизу — как раз таки реакции с водой.
Эта реакция так же иллюстрирует последнее свойство — вытеснение кислоты, у воды получается вытеснить сероводород.
Из определения: «кислота — это сложное вещество, состоящее из водорода и кислотного остатка, при диссоциирующее на катион H + и катион кислотного остатка«.
Все подходит. И получается, что кислотный остаток — это гидроксильная группа OH.
И, как я и говорил раньше, вода образует соли, выходит, что соли воды-кислоты — это основные и амфотерные гидроксиды: металл, соединенный с кислотным остатком (OH).
И схемы реакций:
кислота + металл → соль + водород (в общем случае)
HOH + Na → NaOH + H2↑
кислота + основный оксид → соль вода
HOH + Na2O → 2NaOH (соль образуется, только воды не образуется, да и с чего бы это вдруг в результате реакции с водой, должна образовываться вода)
соль + кислота → другая кислота + другая соль
Итак, мы пришли к выводу, что амфотерные и основные гидроксиды — это соли воды — кислоты.
Тогда как их называть?
Весть термин «гидроксид» также применим к кислородосодержащим кислотам. По правилам получается:
название иона + ат = Гидрокс + ат.
Соли воды — гидроксаты.
Вода настолько слабая кислота, что проявляет некоторые амфотерные свойства, например реакции с кислотными оксидами.
И в воде нейтральная среда, а не кислая, как во всех кислотах — это исключение из правила.
Но в конце концов, как говорил замечательный русский химик-органик «Неосуществимых реакций нет, а если реакция не идет, то еще не найден катализатор».
Сформулируем основные положения теории «Вода — кислота»:
Молекула воды по свойствам — слабая (очень слабая) кислота.
Вода настолько слабая, что проявляет амфотерные свойства и у нее нейтральная реакция среды.
Вода как кислота образует соли — гидроксаты.
К гидроксатам относятся амфотерные и основные гидроксиды.
Формула воды: HOH.
Правильные названия воды: гидроксид водорода, гидроксильная кислота.
Источник
Оксид водорода
Оксид водорода
| Вода | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид водорода |
| Традиционные названия | вода |
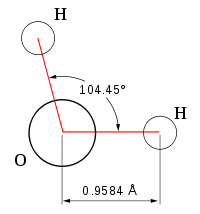
| Химическая формула | Н2O |
| Молярная масса | 18,01528 г/моль |
| Физические свойства | |
| Плотность вещества | 0,9982 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Динамическая вязкость (ст. усл.) | 0,00101 Па·с (при 20 °C) |
| Кинематическая вязкость (ст. усл.) | 0,01012 см²/с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 0 °C |
| Температура кипения | 99,974 °C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Критическая точка | 374 °C, 22,064 MПа |
| Молярная теплоёмкость (ст. усл.) | 75,37 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | 0,56 Вт/(м·K) |
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Содержание
Физические и химические свойства
Физические свойства
Вода обладает рядом необычных особенностей:
- При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
- При нагревании от 0 °C до 4 °C (3,98 °C — точно) вода сжимается. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода, как менее плотная, остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
- Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг [1] ), по сравнению с соединениями водорода с похожим молекулярным весом.
- Высокая теплоёмкость жидкой воды.
- Высокая вязкость.
- Высокое поверхностное натяжение.
- Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а так же того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект слабее, чем обычное тепловое расширение; при испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. [2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O + ) и гидроксильных ионов HO — составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чем основан принцип действия микроволновой печи.
Агрегатные состояния
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находится в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).
Химические свойства
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода в природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде. Роль воды в клетке — см. статью
Атмосферные осадки
Осадки согласно направлению
| «Вертикальные» осадки | «Горизонтальные» осадки | Свободно-парящие структуры |
|---|---|---|
| Дождь | Роса | Облака |
| Дождь со снегом | Иней | Туман |
| Изморось | Атмосферное оледенение | Морская пена |
| Переохлаждённая морось | Гололёд | |
| Снег | ||
| Снежная крупа | ||
| Снежные зерна | ||
| Ледяная крупа | ||
| Ледяной дождь | ||
| Град | ||
| Ледяные кристаллы |
Осадки согласно состоянию
| Жидкие осадки | Твёрдые осадки |
|---|---|
| Дождь | Снег |
| Дождь со снегом | Снежная крупа |
| Изморось | Снежные зерна |
| Переохлаждённая морось | Ледяная крупа |
| Роса | Ледяной дождь |
| Град | |
| Ледяные кристаллы | |
| Иней | |
| Атмосферное оледенение | |
| Гололёд |
Виды воды
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и в свою очередь приобретать самые разные формы, которые зачастую соседствуют друг с другом. Водный пар и облака в небе, морская вода и айсберги, горные ледники и горные же реки, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни» её нередко подразделяют на типы.
Характеристики вод
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Исследования воды
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Биологическая роль
Вода играет уникальную роль, как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Применение
Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90% в некоторых странах.
Питьё и приготовление пищи
Живое человеческое тело содержит от 55% до 78% воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить от 1 до 7 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и пр.
Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель
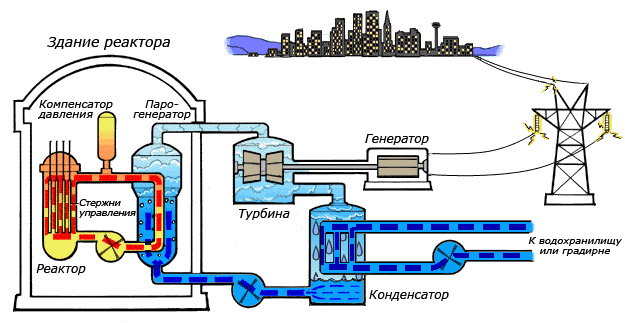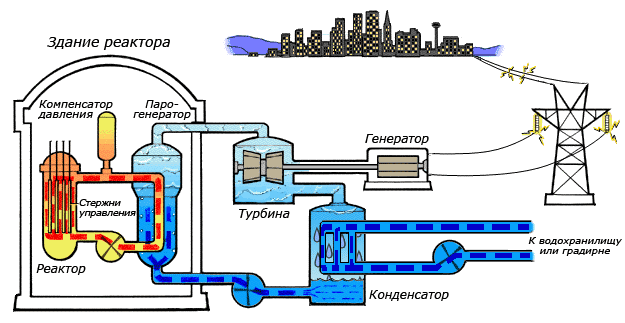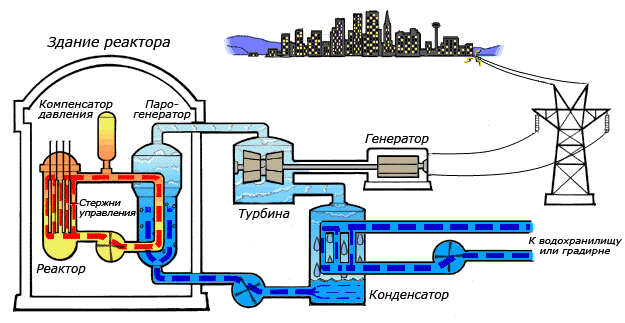
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции от огня в составе пены.
Спорт
Многие вида спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
Инструмент
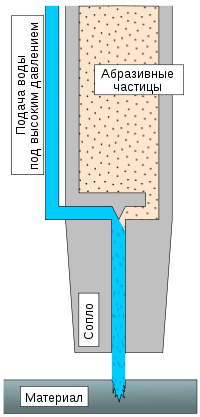
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Источник