- Кислородсодержащие соединения галогенов
- Хлорная вода: состав, получение, химическая формула, использование хлора для очистки
- Что собой представляет
- Характеристики хлоридсодержащих жидкостей
- Формулы
- Химическая
- Структурная
- Ионная
- Электронная
- Нормы примесей
- Обеззараживание
- Вред повышенного содержания хлора в воде для здоровья человека
- Чем избыток хлорной воды вреден для бытового оборудования
- Воздействие на коммуникации
- Способы получения хлорной воды
- Известь с Cl
- Диоксид хлора
- Дехлорирование
- Использование хлорной жидкости и хлорноватистой кислоты
Кислородсодержащие соединения галогенов
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее — оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным элементом.
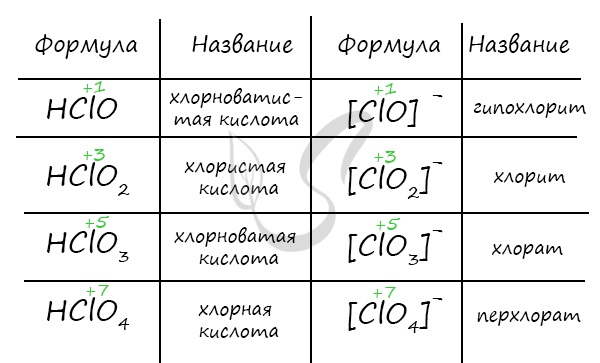
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к брому, и к йоду. Так например HBrO — бромноватистая кислота (соли гипобромиты), HIO — иодноватистая кислота (соли гипоиодиты).
HIO3 — иодноватая кислота (соли иодаты), HBrO3 — бромноватая кислота (соли броматы). По аналогии несложно составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Хлористая кислота может быть получена из собственных солей — хлоритов, а также в реакции с оксидом хлора IV.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Самая сильная кислота в природе — хлорная кислота — может быть получена реакцией перхлората калия или натрия с концентрированной серной кислотой.
Химические свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная — к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
Разложение кислот и солей
И кислоты, и их соли разлагаются схожим образом.
KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Кислородсодержащие соединения галогенов
HBrO2 — бромистая кислота, слабая
HClO4 — хлорная кислота, сильная
Бертолетова соль — KClO3
HClO3 — хлорноватая кислота, сильная
Источник
Хлорная вода: состав, получение, химическая формула, использование хлора для очистки
С помощью этого элемента повсеместно очищают питье, что позволяет решить многочисленные проблемы с ее качеством. Он помогает избавиться практически ото всех известных вирусов и бактерий, оказывающих пагубное влияние на человеческий организм. На сегодняшний день не существует другого средства, способствующего столь эффективной дезинфекции. Поэтому в нашей статье мы поговорим о хлорной воде: что это такое, состав, химическая формула, применение.
Что собой представляет
По сути, это растворенный в H2O хлор. В растворе, помимо молекул Cl, содержатся также хлорноватистая и хлороводородная кислоты.
Почти во всех водопроводных системах жидкость, предназначенная для питья, подлежит хлорированию. Объясняется это присутствием большого количества вредоносных микроорганизмов, способных спровоцировать возникновение тяжелейших заболеваний. Уничтожить опасные для человека примеси можно еще тремя способами: облучением, окислением или кипячением. Однако кипятить и облучать довольно нерационально, а окислять — опасно.
Существует и четвертая методика очистки — озонирование, но и в этом случае возникающие проблемы не позволяют эффективно применять ее на практике. Озон почти мгновенно улетучивается. Поэтому в момент, когда чистое питье достигнет водопроводных кранов в квартирах и домах, результат обработки окажется ничтожным.
Характеристики хлоридсодержащих жидкостей
В природной среде элемент находится в связанной форме (хлорид). Его присутствие зафиксировано в ряде минералов, к ним относятся: галит, карналлит и сильвит. Соединение вода плюс хлор возникает там, где подземные потоки проходят через пласты хлорсодержащих отложений. Также образование возможно в морях и некоторых озерах.
Большая часть веществ без проблем растворяется при контакте с H2O. Так образуются свободные подвижные ионы, благодаря которым солевые растворы обладают гораздо большей электропроводностью по сравнению с продуктом дистилляции.
Проводя анализ качественного состава в каком-либо водоеме, в первую очередь учитывают концентрацию хлоридных объединений. Так, в регионах с холодными климатическими условиями количество хлоридов в наземных и подземных потоках может равняться 10 мг/л. В южных зонах показатель способен достигать 100 мг/л. Большую угрозу экологии и здоровью человека представляют несанкционированно организованные или оборудованные ненадлежащим образом свалки. При сгорании хлорсоединения выделяют не меньше вредных соединений, чем при растворении.
Использование хлора для очистки воды сейчас повсеместное явление. Его избыток не лучшим образом сказывается на вкусовых качествах питья. Но использовать для бытовых и хозяйственных нужд такую жидкость можно. А вот задействовать ее в сельском хозяйстве — неверное решение.
Формулы
Являясь сильнейшим окислителем, она способна растворять даже золото. Представить ее наглядно можно по-разному.
Химическая
Вариант формулы требует указания всех составляющих.
Cl2 + H2O = HCl + HClO.
Структурная
Графическая вариация упрощает понимание, каким образом происходит слияние. Связь атомов в теле молекулы становится более наглядной. Так как хлорная вода содержит несколько соединений, следует рассмотреть их все.
MBFT-75 Мембрана на 75GPD
SF-mix Clack до 0,8 м3/ч
SF-mix Runxin до 0,8 м3/ч
Ионная
Хлорная и хлороводородная кислоты представляют собой электролиты. Поэтому они способны распадаться на ионы в жидкостном растворе. Течение реакций можно проследить по формулам:
Электронная
Эта версия демонстрирует размещение электронов в атоме, расположенных на энергетических подуровнях:
Это подтверждает то, что Cl причисляется к р-семейству элементов и показывает количество валентных электронов.
На рисунке ниже укажем формулу хлороводородной кислоты:
Нормы примесей
При растворении хлора в воде она обогащается ионами кальция и магния, что объясняет ее чрезмерную жесткость. Хлоридионы появляются в процессе образования раствора жидкость + вещество, являющегося сильнейшим электролитом MgCl2. В природе на их возникновение влияют естественные факторы, такие как вымывание хлорсодержащих пород. В водопроводной жидкости, которую мы используем для повседневных нужд, наполнения бассейнов, в качестве питья ионы возникают благодаря хлорированию. Этот процесс осуществляется с целью дезинфекции.
При этом очень важно, чтобы концентрация элемента не превышала установленную норму. Так, для употребления подходит H2O, в которой содержится не более 350 мг/л хлора. Для технического использования показатель может быть и 700 мг/л. Избавиться от лишней хлорки в воде чаще всего удается с помощью простого метода — отстаивания.
Обеззараживание
Как мы уже выяснили — очень важно соблюдать нужную дозировку. Если вещества в определенном объеме жидкости будет мало, она в короткие сроки обзаведется множеством опасных для здоровья микроорганизмов, при его переизбытке может превратиться в яд для человека. Кроме того, большая концентрация Cl наделяет питье неприятным вкусом и придает жесткость.
Оптимальное количество окислителя приблизительно 0,5 мг/л. Смешивание с реагентом производится с особой тщательностью. Употреблять питьевой раствор после реакции можно не ранее, чем через 30 минут.
SF-mix ручной до 0,8 м3/ч
АМЕТИСТ — 02 М до 2 куб.м./сут.
Аэрационная установка AS-1054 VO-90
Гипохлорид натрия выступает самым надежным средством для дезинфекции. Благодаря своим свойствам он эффективно устраняет вредоносные бактерии, а также является вполне безопасным по части взрывоопасности. Этот элемент более активный и не отличается токсичностью.
Вред повышенного содержания хлора в воде для здоровья человека
Мы уже разобрались, что это соединение используют для обеззараживания. В отношении человеческого организма это, конечно, не самая полезная добавка. Здесь важно осознавать степень его вреда и полезности.
В виде газа он без труда растворяется, в том числе и в дыхательных органах человека, а также на слизистых его носа и глаз. В процессе растворения элемента происходит образование соляной кислоты. Именно оказывает столь пагубное воздействие на телесную оболочку. Хлорные пары поражают сердце и легкие, заставляют задыхаться. Нарушается функционирование абсолютно всех тканей в организме.
Растворимость хлора (хлорки) в воде позволяет ему беспрепятственно проникать в тело живых существ. Организм ощущает его присутствие как сильный болевой синдром. Дополнительную опасность представляет атомарный кислород. Высокая активность дает ему возможность оказывать разрушительное воздействие не только на слизистые, но и на БЖУ систему. При контакте с кожей такая «живительная влага» высушивает ее, повреждая жировую подкожную прослойку. Особо тяжких последствий при этом не будет, но масса неприятных ощущений — гарантирована.
Глаза отличаются особой чувствительностью. При попадании паров Cl появляется непрекращающееся жжение и раздражение, словно при глазной болезни. Оказавшись в такой ситуации, нужно помнить, что влияние атомарного кислорода на них невозможно предвидеть. Ухудшение самочувствия может наступить внезапно. К сожалению, слишком часто происходят такие неприятные и небезопасные для человека случаи.
Воды без хлора в системе водоснабжения практически не бывает. Набирая ванну, вы даже не замечаете, что она вместе с ним испаряется и попадает в легкие, на слизистые. Впоследствии вещество оседает на внутренних органах и выводит их из строя, также, как при употреблении такого питья.
Поэтому несмотря на выраженные обеззараживающие свойства, элемент имеет перечень противопоказаний для:
- беременных и кормящих женщин;
- маленьких детей в возрасте до 3 лет;
- людей, страдающих астмой;
- аллергиков.
Избыточное количество Cl способно спровоцировать:
- раздражение слизистой и повреждение кожного покрова;
- распад эмали зубов;
- различные экземы и высыпания;
- расстройство функционирования почек и печени;
- переход простудных заболеваний в хроническую форму;
- не проходящее чувство усталости.
Чем избыток хлорной воды вреден для бытового оборудования
Это вещество в больших количествах оказывает разрушительное воздействие не только на человеческий организм. Немалый вред оно наносит и технике. Слишком жесткая жидкость провоцирует выпадение характерного осадка, который скапливается на нагревательных элементах. Из-за этого в несколько раз возрастает вероятность поломки стиральных машин, посудомоечных аппаратов, котлов для подогрева H2O.
Воздействие на коммуникации
Коррозии вследствие избытка хлора, к сожалению, подвержены многие металлы. В системах водоснабжении хлорка выступает одной из ведущих причин возникновения разрывов и трещин в трубах, что зачастую приводит к масштабным протечкам.
Способы получения хлорной воды
Выбор методики во многом зависит от предназначения процесса и качества очищаемой среды. Большое значение имеет количество вредоносных примесей и их активность.
Диспенсер магистральный настольный AquaPro 919H/RO (горячая и холодная вода)
Диспенсер магистральный настольный AquaPro 929CH/RO (охлаждение/нагрев)
Диспенсер напольный AquaPro 311 (пустой, без охлаждения)
Известь с Cl
Довольно распространенный метод обеззараживания систем водоснабжения. Это вещество перевозят и хранят в емкостях из дерева или железобетона. Изнутри их в обязательном порядке отделывают кислотоупорным материалом (специальной плиткой) или цементом. Хлорирование известью производится с задействованием 2% раствора из расчета 5 кг/100 л. Существенным минусом такого способа выступают производственные затраты на изготовление очищающего средства и его большой расход.
Диоксид хлора
Он отличается рядом серьезных преимуществ:
- обладает выраженными бактерицидными и дезодорирующими свойствами;
- позволяет добиться высокого качества пить
- необходимость перевозить Cl в жидком виде отпадает;
- в очищенной составе отсутствуют продукты распада;
При этом хлорная вода, ее цвет, вкус и запах соответствуют всем нормам. Однако, есть у представленного способа и свои недостатки. Он отличается дороговизной и довольно взрывоопасен, что немаловажно.
Дехлорирование
Когда концентрация превышает установленные нормы, проводят очищение от избытка элемента. Делают это посредством добавления в уже хлорсодержащую жидкость веществ, связывающих излишки и удаляющих их из состава. К таковым помощникам относятся: сульфит, гипосульфит натрия, сернистый газ.
Оптимальный вариант решения проблемы — использование угольного фильтра. Приобрести подходящее очистное средство сейчас совсем несложно. Рынок наводнен многочисленными экземплярами, с помощью которых можно эффективно избавиться от всех нежелательных примесей. Так, компания «Вода Отчества» уже много лет осуществляет успешную разработку и производство водоочистного оборудования для бытовых и промышленных нужд потребителей. Остановить свой выбор на их продукции — по-настоящему правильное решение. Ведь забота о здоровье наших родных и близких — первостепенная задача каждого.
Угольные элементы в приборе фильтрации устраняют неприятный запах, вкус, избавляют от излишков Cl, а также нежелательной органики. В процессе дехлорирования углем происходит реакция окисления. Продолжительность очистки варьируется от 2 до 8 минут. Наибольшей эффективности удастся достичь путем обратной промывки.
Вышеперечисленные методы удаления излишков хлорида можно применять как в домах, так и для очистки колодцев. Проводя обработку, следует строго соблюдать необходимые меры предосторожности.
Использование хлорной жидкости и хлорноватистой кислоты
Использовать вещества, содержащие активный Cl, начали очень давно, еще несколько столетий назад. Элемент был обозначен в далеком 1774 году химиком Бертолле. Он обнаружил, что вода, в состав которой входит хлор, способна отбеливать хлопковые и льняные ткани, удаляя с них въевшиеся желтоватые пятна. Тогда же этот выдающийся человек открыл собственное предприятие по отбеливанию материи и бумаги. Первым и единственным работником на фабрике в тот момент был только его сын.
При растворении хлора в воде появляется хлорноватистая кислота, которая не отличается высокой устойчивостью. В растворе ее обычно не больше 30%. Медленное течение реакции обеспечивает, как правило, кислая среда и температурный режим, приближенный к комнатному. Наличие соляной кислоты позволяет установиться равновесию. А при повышенных температурах в слабокислой основе процесс значительно ускоряется.
В XIX веке по результатам многочисленных исследований подтвердили дезинфицирующие свойства хлорки. В то время уже стало ясно, что аналогов, способных сравниться с данным веществом по части устранения различного рода загрязнений, не существует. Очередное же полезное качество сделало хлор еще более популярным.
Впервые с целью дезинфекции его стали задействовать в венской больнице в 1846 году. Доктора омывали им ладони перед контактом с пациентами и после. Проходивший в то время в Вене конгресс подтвердил, что подавляющее большинство болезней, характеризующихся как эпидемии, активно распространяются в водоемах. Cl в одночасье был признан одним из лучших средств для устранения заражающих бактерий из водной среды. Оказался он как нельзя кстати и при сооружении первых систем водоснабжения. На сегодняшний день продолжает занимать ведущее место среди современных средств дезинфекции.
Пожалуй, ни у кого теперь не осталось вопросов: растворим ли хлор в воде, чем опасен его избыток и как избежать связанных с ним проблем. Надеемся, что наша статья оказалась для вас действительно полезной.
Источник