- Почему вода расширяется при замерзании?
- Действительно ли вода расширяется при замерзании?
- Почему объем воды увеличивается, когда она замерзает?
- Является ли вода полярной или неполярной?
- Почему лед плавает по воде
- Почему вода при замерзании расширяется. Что за напасть?
- Аномалия плотности при охлаждении
- Что происходит на «атомном» уровне
- Почему лёд плавает в воде?
- Исследование свойств воды при кристаллизации
- Вступление
- Введение
- 1. Подготовка к исследованию
- 1.1 Анализ основных свойств воды
- 1.2 Значение кристаллизации воды для флоры и фауны
- 1.3 Выбор и обоснование опытов для проведения исследования
- 2. Проведение исследования
- 2.1 Подготовка материальной части
- 2.2 Проведение опытов с описанием основных результатов
- 1. Замерзание соленой воды.
- 2. Расширение воды при замерзании.
- 3. Замерзание жидкости при внешнем воздействии снега.
- 4. Замерзание мыльных пузырей.
- 5. Срастание сосульки.
- 6. Скрип сухого снега.
- 7. Примерзание к поверхности.
- 2.3 Предложения по проведению опытов
- Заключение
Почему вода расширяется при замерзании?
Когда вода замерзает, ее молекулы выстраиваются в кристаллическую структуру, тем самым приобретая определенную форму. Эта кристаллическая структура менее плотная, и поскольку между отдельными молекулами в структуре есть промежутки, общий объем увеличивается, и вода «расширяется».
С беглого взгляда фраза «вода расширяется, когда она замерзает» может не иметь смысла, потому что в жидкой форме вода не имеет определенной формы или очертаний и поэтому, кажется, занимает больше места. Кроме того, когда вода замерзает, она принимает четко определенную форму, которая кажется совершенно противоположной «расширению».
Действительно ли вода расширяется при замерзании?
Да, вода расширяется при замерзании. Обратите внимание, что слово «расширяется» в этом предложении означает увеличение объема. Поэтому технически правильно было бы сказать так: объем воды увеличивается при замерзании.
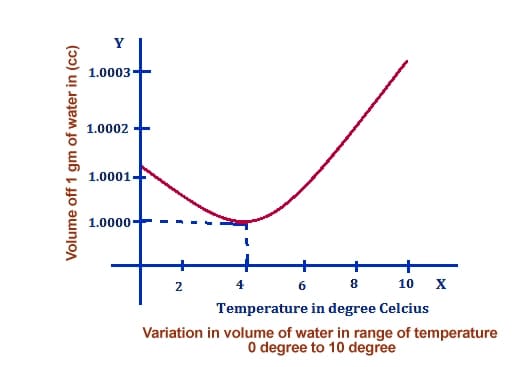
Это утверждение является точным, и вы можете проверить его правомерность с помощью простого эксперимента: если вы снизите температуру воды, вы заметите, что объем воды уменьшается, поскольку она становится все более и более «нетронутой».
Вы можете обратиться к следующей диаграмме, чтобы представить эту зависимость графически:
Обратите внимание, что объем воды начинает увеличиваться при понижении температуры ниже 4 градусов Цельсия.
Теперь давайте поговорим о том, почему увеличивается объем воды или почему она расширяется, когда замерзает и достигает твердой формы.
Почему объем воды увеличивается, когда она замерзает?
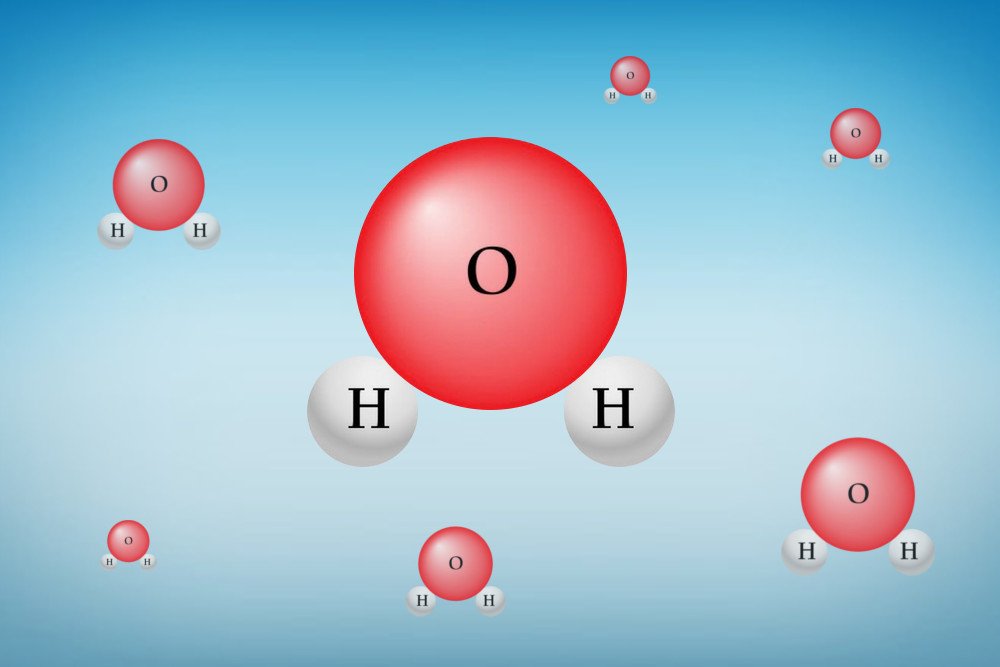
Это явление связано с химическим составом воды. Видите ли, молекула воды состоит из двух атомов водорода и одного атома кислорода. Расположение этих атомов совершенно уникально, что придает воде некоторые особые свойства, такие как высокая теплоемкость воды, поверхностное натяжение, адгезия и когезия.
Является ли вода полярной или неполярной?
Химическая структура молекулы воды.
Такое расположение молекулы воды создает положительно заряженную сторону возле атомов водорода и отрицательно заряженную сторону возле атома кислорода.
Когда две молекулы воды сближаются, положительная сторона одной молекулы цепляется за отрицательную сторону другой молекулы. Когда это происходит в больших масштабах (т.е. с миллионами молекул воды), получается уникальная структура, которая объясняет некоторые химические свойства воды.
В жидком состоянии молекулы воды могут свободно перемещаться, образуя и разрывая водородные связи, что объясняет неправильную форму воды (или любой другой жидкости, если на то пошло). Некоторые молекулы воды часто «уложены» друг на друга, что объясняет более высокую плотность воды по сравнению со льдом.
Расположение молекул воды в жидком состоянии.
Однако по мере снижения температуры и охлаждения воды межмолекулярные силы увеличиваются, свобода движения молекул воды уменьшается, и они становятся все менее энергичными (с понижением температуры).
Когда вода достигает точки замерзания, движение ее молекул становится незначительным, и они приобретают более определенную форму, располагаясь в виде шестигранных решеток.
Ниже приведен упрощенный вариант расположения молекул воды в кристаллической форме во льду:
Расположение молекул воды в твердой форме.
Это кристаллическое расположение молекул воды менее плотное, поскольку оно не позволяет молекулам скапливаться (как это происходит в жидкой форме) из-за более сильных межмолекулярных сил.
Такое расстояние между молекулами и их фиксация в таком положении увеличивает объем воды, поэтому говорят, что вода расширяется при замерзании.
Почему лед плавает по воде
Вода расширяется, когда становится льдом, и, поскольку объем обратно пропорционален плотности вещества, лед менее плотен, чем вода. По этой причине лед, вещество, которое кажется более тяжелым, чем его жидкая форма, плавает на воде.
Если бы вода не расширялась при замерзании, лед был бы плотнее воды. Подумайте о влиянии на экосистему планеты! Лед на поверхности озер, морей и океанов утонет, и эти водоемы будут постепенно заполняться снизу вверх. С замерзшими озерами и океанами на Земле не было бы водной жизни.
С этой точки зрения очень хорошо, что вода расширяется в твердой форме!
Источник
Почему вода при замерзании расширяется. Что за напасть?
Все мы помним, что согласно молекулярно-кинетической теории тела при нагревании расширяются, а при охлаждении сжимаются . Это объясняется тем, что при увеличении температуры количество соударений частичек увеличивается, что и заставляет конструкцию «растянуться». Ну а при замерзании процесс обратный.
И всё бы ничего. Но вода. Она такая вода! Если оставить на морозе банку с водой, то как только вода замерзнет, то банку разорвет в клочья. Может быть вам доводилось слышать, как где-то на балконе в сильные морозы лопаются банки. А ещё на морозе лопаются и более серьезные предметы. Так, может лопнуть и расширительный бак, труба водоснабжения или водонапорная башня.
Всё это происходит потому, что вода при кристаллизации расширяется. Если вода расширяется сильнее, чем ей это позволяет сделать имеющийся объем, то вода разворотит этот объем. И всё бы ничего. Но почему вода обладает такой странной особенностью?
Аномалия плотности при охлаждении
Оказывается, это хитрое свойство называется аномалией плотности . Подобная картина характерна не только для воды, но и некоторых других веществ, таких как германий, кремний, галлий, сурьма, висмут, церий .
Если же вернуться к воде, то тут всё довольно интересно. Сначала вода действительно становится всё плотнее при охлаждении и достигает максимальной плотности при температуре +4 градуса по шкале Цельсия . Всё это время объем охлаждаемой воды действительно уменьшается. Но а потом объем охлаждаемой воды начинает увеличиваться даже несмотря на охлаждение, она кристаллизуется и лёд тоже увеличивается в объеме, который превышает объем исходной жидкости.
Это хитрая особенность делает воду идеальным вариантом для заполнения водоема. Ведь будь в реках и озерах другая жидкость, кристаллизация этой жидкости привела бы к тому, что куски того «льда» тонули.Ну а лёд из обычной воды, легче, чем сама вода, потому прекрасно и плавает по поверхности. Так водоем может покрыться коркой льда, а под ним останется вода, которая не будет промерзать и позволит подводным жителям пережить морозы.
Что происходит на «атомном» уровне
Ответ на вопрос «почему» уже существует. Давайте вспомним, как выглядит молекула воды. Её рисуют чуть ли не на каждом заборе.
Источник
Почему лёд плавает в воде?
Тот парадоксальный факт, что лёд, т.е. твёрдая форма воды, легче самой воды, общеизвестен, хотя мы редко задумываемся о его парадоксальности. Действительно, у подавляющего большинства веществ твёрдая фаза плотнее жидкой. Вода – одно из редких исключений.
Причина кроется в строении атома воды и взаимодействии этих атомов между собой.
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Так происходит потому, что кислороду не хватает двух электронов до «совершенства» — заполнения внешней орбитали, и он «одалживает» их у атомов водорода (у которых их как раз по одному). Почему так происходит – отдельный вопрос, несколько выходящий за пределы темы нашего разговора.
Атом кислорода значительно больше атома водорода, который вообще является самым маленьким из всех (1 протон, 1 электрон). Поэтому атом кислорода очень сильно притягивает «водородные» электроны – настолько сильно, что почти «отрывает» их от «родного» атома, который в итоге почти лишается их, превращаясь в «голый» протон с зарядом +1. Кислород же, до реакции нейтральный, получает два «лишних» электрона и, соответственно, заряд -2. Получается как бы треугольничек, одна из вершин которого заряжена отрицательно, а две других – положительно. Кстати, угол у вершины этого треугольничка составляет 104 градуса (это немаловажно)
Если мы «набросаем» рядом друг с другом большое множество таких треугольничков, то увидим, что они начнут особым образом ориентироваться в пространстве: положительно заряженные «уголки» одних молекул начинают притягиваться к отрицательно заряженным «уголкам» других. В итоге каждая молекула воды стремится образовать связи с четырьмя другими: каждый атом водорода хочет «приклеиться» к атому кислорода другой молекулы, а к атому кислорода стремятся приклеиваются две молекулы водорода двух других атомов.
Это особое притяжение, возникающее между молекулами воды, называется водородной связью. Эта связь характерна тем, что она срабатывает на существенно больших расстояниях (примерно равных размеру молекулы воды), чем обычные ковалентные связи между молекулами, однако является значительно (на порядок) менее прочной.
Для того, чтобы – с учётом вышеизложенного – понять, почему же лёд легче воды, посмотрим, что будет происходить с водой при её постепенном охлаждении.
Молекулы воды (как и молекулы любой другой жидкости) находятся в постоянном движении, причём чем теплее вода, тем быстрее движутся такие молекулы. Опять же, как и в любой другой жидкости, расстояния между молекулами воды меньше их размеров. То есть, они находятся достаточно близко к друг другу для того, чтобы между ними возникали водородные связи –и они возникают. Однако, как мы уже говорили, эти связи ещё и очень непрочные – их энергия примерно равна энергии теплового движения молекул жидкости. А потому, даже возникнув, такие связи сразу рвутся просто из-за того, что двум связанным молекулам «пришло в голову» разлететься в разные стороны.
Тем не менее, какая-то часть молекул воды в каждый момент времени связана водородными связями, что определяет другие аномальные свойства этого вещества – например, очень большую теплоёмкость, а также ряд других.
Но вот мы охладили жидкость до той температуры, при которой энергия кинетического движения её молекул уже ниже энергии водородной связи. То есть, единожды «попавшись в сети» водородной связи, молекула воды уже не сможет их покинуть, а возникнувшая связь не разрывается. Начинают возникать цепочки сцепленных водородной связью молекул, которые затем объединяются между собой в группы, те – в ещё более крупные объединения. В результате образуется устойчивая структура – кристаллическая решётка. Вода замерзает и превращается в лёд.
Кстати говоря, именно из-за этого кристаллы льда имеют такую форму, какую они имеют – форму, основанную на гексагональной призме (т.е. призме, в сечении представляющей собой правильный шестиугольник). Несложно видеть, что именно такая фигура представляет собой простейший способ упаковки молекул в трёхмерную структуру с учётом того, что каждая из них должна быть связана с четырьмя другими.
Кстати, другие модификации льда, имеющие другое строение кристаллической решётки (а всего таких модификаций 18 штук!) возникают в условиях, когда атомы в решётке удерживаются не только водородными, но и обычными ковалентными связями. Правда, для этого нужны другие температуры и не встречающиеся на Земле давления — либо очень большие, либо, наоборот, слишком маленькие.
А вообще, не будь водородных связей, физические свойства воды существенно бы отличались. Так, вода вскипала бы уже -80 градусах Цельсия, а обращалсь бы в лёд при -100. Ну и, конечно, плотность льда была бы больше плотности воды, и плавать в ней он бы не мог.
К слову, вода – редкое, но не единственное вещество с подобными свойствами. Во фтористом водороде, например, водородные связи имеют даже более сильный характер, отчего теплоёмкость этого вещества даже выше, чем у воды.
Водородные связи играют роль в органической химии и биохимии – например, именно водородные связи стабилизируют спирали ДНК, а также формируют вторичные и третичные структуры многих белков. Полимерные материалы (например, нейлон) также часто обретают свои свойства именно из-за водородных связей между их молекулами.
Так что можно сказать, что самим своим существованием мы с вами обязаны такому явлению, как водородная связь!
Источник
Исследование свойств воды при кристаллизации
Вступление
Вода является не только одним из самых необходимых, но и самых удивительных явлений на нашей планете. Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Введение
Большая часть поверхности Земли покрыта водой (океаны, моря, озёра, реки, льды). На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % – ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках, которые образуются из взвешенных в воздухе частиц льда и жидкой воды.
Вода при нормальных условиях находится в жидком состоянии, однако при температуре в 0 °C она переходит в твердое состояние – лед и кипит (превращается в водяной пар) при температуре 100 °C.
Значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию».
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного), а также в виде снега, инея, изморози. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды.
Общие запасы льда на Земле около 30 млн. км³. Основные запасы льда сосредоточены в полярных шапках (главным образом, в Антарктиде, где толщина слоя льда достигает 4 км).
В мировом океане вода солёная и это препятствует образованию льда, поэтому лёд образуется только в полярных и субполярных широтах, где зима долгая и очень холодная. Замерзают некоторые неглубокие моря, расположенные в умеренном поясе.
Кроме того, имеются данные о наличии льда на планетах Солнечной системы (например, на Марсе), их спутниках, на карликовых планетах и в ядрах комет.
Исследование свойств воды необходимо для человечества.
При этом процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней школе.
Актуальность работы использование на уроках физики, для знакомства учащихся со свойствами воды при кристаллизации.
Объектом исследования является кристаллизация воды.
Предмет исследования – изучения свойств воды при кристаллизации.
Цель работы провести опыты по кристаллизации воды и подготовить предложения по их проведению.
Главной задачей является изучение свойств воды при кристаллизации.
Для решения главной задачи необходимо:
- Повести анализ основных свойств воды.
- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.
- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.
Теоретическая значимость работы заключается в систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли.
Практическая значимость работы – изучение процесса кристаллизации воды во время проведение опытов, а также подготовка предложений по проведению опытов на уроках в средней школе.
1. Подготовка к исследованию
1.1 Анализ основных свойств воды
Вода является одним из самых удивительных веществ на планете Земля. Встретить воду можно практически везде в естественных условиях как на поверхности планеты, так и в ее недрах в трех возможных физических состояниях для веществ: жидкое, твердое, газообразное (то есть вода, лед, водяной пар).
Конечно, существуют вещества, которые можно получить в виде жидкости, твердого тела или газа. Однако, не существует подобного химического вещества, которое именно в естественных условиях встречается в указанных выше трех физических состояниях.
- Вода является веществом, которое не имеет ни цвета, ни запаха, ни вкуса.
- Вода является единственным на планете Земля известным науке веществом, встречающимся в природных условиях в трех физических состояниях: твердое тело, жидкость, газ.
- Вода является универсальным растворителем, имея возможность растворять большее количество солей, а также других веществ, чем какие-либо другие вещества.
- Вода с большим трудом поддается окислению. Вода — достаточно химически устойчива, то есть разложить ее на составные части или сжечь достаточно проблематично.
- Окислению водой поддаются практически все естественные металлы, так же под ее воздействием разрушаются особо твердые горные породы.
- При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
- Вода, как физическое вещество, характеризуется большим сродством сама с собой. Такое сродство у воды является самым большим среди всех жидкостей. Вследствие этого вода на поверхности размещается в виде капель сферической формы, поскольку сфера обладает наименьшей при заданном объеме поверхностью.
- Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды. Однако, замерзание морской воды происходит при более низких температурах: минус 1,9 градусов Цельсия, при солености 35%.
- Вода обладает очень высокой теплоемкостью, относительно мало нагреваясь при этом. Также вода обладает достаточно высокой скрытой теплотой плавления (порядка 80 кал/г), а также испарения ( порядка 540 кал/г). Вода способна поглощать значительные объемы дополнительного тепла. Температура же в процессе замерзания или при кипении остается неизменной.
- Дистиллированная вода практически не проводит электрический ток, однако наличие в воде даже небольшого количества солей значительно увеличивает ее токопроводящие свойства.
- При смешивании соли со снегом наблюдается два процесса: разрушение кристаллической структуры соли, которое происходит с поглощением тепла, и гидрация ионов. Последний процесс происходит с выделением тепла в окружающую среду. Для поваренной соли и хлористого кальция первый процесс превалирует над вторым. Поэтому при смешивании снега с этими солями происходит активный отбор тепла из окружающей среды. Ещё одна особенность соляных растворов состоит в том, что их точка замерзания ниже 0 градусов. Чтобы снег на тротуарах таял при температуре ниже 0 градусов, его посыпают этими солями.
- Снег обладает удивительным свойством – памятью. Он сохраняет следы. По следам можно, например, изучать физику. Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
1.2 Значение кристаллизации воды для флоры и фауны
Мы любим снег не только за то, что он дарит нам великолепные зимние пейзажи. У нашей любви к снегу немало рациональных причин. «Снег на полях — хлеб в закромах», «Зима без снега – лето без хлеба», – справедливо утверждают старинные русские пословицы. Снежный покров — это огромный запас влаги, столь необходимый полям, в то же время это своеобразное гигантское одеяло, защищающее поверхность земли от холодных ветров. Академик Б. И. Вернадский подчеркивал, что снежный покров — «не просто теплая покрышка озимых, это живительная покрышка», весной он дает талые воды, насыщенные кислородом. Известно, что количество азотистых соединений летом в почве пропорционально высоте сошедшего снежного покрова. Недаром снежная мелиорация рассматривается сегодня как одно из важнейших условий получения высоких и устойчивых урожаев.
Запасы снега существенно влияют на уровень воды в реках, определяют изменения климата на больших территориях.
Кроме того, снег является хорошим строительным материалом для различных построек на севере — от иглу (жилищ эскимосов) до больших складских помещений. Существует самая большая в мире гостиница, полностью сделанная изо льда и снега, находится она в шведской Лапландии в 200 километрах от Северного полярного круга.
Он служит основой зимних дорог и даже аэродромов.
Благодаря снегу мы каждый год любуемся сказочными зимними пейзажами, играем в снежки, строим снежные городки, крепости, катаемся на лыжах, санках, в снежном уборе приходит к нам прекрасный новогодний праздник.
Значение льда трудно недооценить. Лёд оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Покрывая воду сверху, лед играет в природе роль своего рода плавучего экрана, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Лёд может вызывать ряд стихийных бедствий с вредными и разрушительными последствиями – обледенение летательных аппаратов, судов, сооружений, дорожного полотна и почвы, град, метели и снежные заносы, речные заторы с наводнениями, ледяные обвалы и др. Природный лёд используется для хранения и охлаждения пищевых продуктов, биологических и медицинских препаратов, для чего он специально производится и заготавливается.
1.3 Выбор и обоснование опытов для проведения исследования
Для проведения опытов с водой необходимо выбрать те, которые наиболее полно характеризуют и подтверждают свойства воды.
Проведенный анализ показал, что лучше всего это будет реализовано при выполнении следующих опытов:
- Замерзание соленой воды.
- Расширение воды при замерзании.
- Замерзание жидкости при внешнем воздействии снега.
- Замерзание мыльных пузырей.
- Срастание сосульки.
- Скрип сухого снега.
- Примерзание к поверхности.
2. Проведение исследования
2.1 Подготовка материальной части
Для проведения опытов были взяты:
- предметы – кастрюля, стеклянная бутылка, пластиковая бутылка, одноразовые стаканы, тонкая медная проволока, трубочка;
- вещества – снег, сосулька, соль, вода, мыльный раствор, сок.
2.2 Проведение опытов с описанием основных результатов
1. Замерзание соленой воды.
Налейте в две формочки воду – чистую и очень солёную. Вынесите формочки на мороз или поставьте в морозильную камеру. Вы заметите, что чистая пресная вода превратилась в лёд, а солёная замёрзнет при очень сильном морозе.
Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды.
При этом, морской лед отличается от пресноводного в ряде отношений. У соленой воды температура замерзания понижается по мере увеличения солености. В диапазоне солености от 30 до 35 промилле точка замерзания меняется от -1.6 до -1.9 град. Образование морского льда можно рассматривать как замерзание пресной воды с вытеснением солей в ячейки морской воды внутри толщи льда. Когда температура достигает точки замерзания, образуются ледяные кристаллы, которые «окружают» не замерзшую воду.
2. Расширение воды при замерзании.
Наполните водой пластиковый стакан, пластиковую бутылку и стеклянную бутылку. Выставьте их на мороз. Замерзая, вода увеличивается в объёме, «вылезает» из стакана, стеклянную бутылку разрывает даже в том случае, когда она заполнена наполовину. Пластиковая бутылка остаётся без видимых изменений.
При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
Зимой из-за этого свойства воды происходят аварии на водопроводах. В сильные морозы основная причина таких аварий – замерзание текучей воды. Происходит ее расширение, так что образующийся лед легко разрывает трубы, так как плотность льда – 917 кг/м3, а плотность воды – 1000 кг/м3, то есть объем увеличивается в 1,1 раза, что довольно существенно.
3. Замерзание жидкости при внешнем воздействии снега.
Налейте в пластиковый стакан (пробирку) сок и поставьте его в кастрюлю с солёным снегом. Сок замёрзнет, и очень скоро вы будете лакомиться фруктовым льдом.
При смешивании соли со снегом наблюдается разрушение кристаллической структуры соли, которое происходит с поглощением тепла. Поэтому при смешивании снега с солью происходит активный отбор тепла из сока и сок превращается в лед.
4. Замерзание мыльных пузырей.
Приготовьте мыльный раствор. Раствор на морозе держите в рукавице, чтобы он не замёрз. Выдувайте пузыри трубочкой для сока. Из-за разности температур изнутри пузыря и снаружи возникает большая подъёмная сила, мгновенно уносящая пузыри вверх. Тонкая мыльная плёнка на морозе быстро замерзает, превращая пузыри в ледяные шарики.
Таким образом, тончайшая пленка мыльного пузыря замерзает за считанные секунды.
5. Срастание сосульки.
Возьмите сосульку. Перекиньте через неё тонкую проволоку, концы которой утяжелите грузиками. Наблюдайте, как проволока растапливает лёд, проникает всё глубже в сосульку. Вода над сосулькой вновь замерзает.
Это подтверждает свойство поглощения тепла большей массой льда.
Лед нарастает снизу, сразу над проволокой, так как стекающая вниз талая вода замерзает при соприкосновении с холодными стенками сосульки.
6. Скрип сухого снега.
Насыпьте в тарелку сахарный песок горкой и начните давить его ложкой. Вы услышите характерный скрип. Намочите песок и вновь разотрите. Скрип исчез. В морозные дни звук распространяется на большие расстояния.
Снег скрипит только в мороз (ниже -5°C), и звук скрипа меняется в зависимости от температуры воздуха – чем крепче мороз, тем выше тон скрипа. При достаточном опыте можно оценивать температуру воздуха по звуку, который издает скрипящий снег. Скрип образуется из-за того, что при давлении разрушаются мельчайшие кристаллики снега. Причем каждый из них по отдельности очень мал, чтобы издавать звук, доступный уху человека, но вместе они ломаются довольно громко. Усиление морозов делает ледяные кристаллики более твердыми и хрупкими. При каждом шаге ледяные иглы ломаются. При температуре воздуха ниже -50°C скрип снега становится таким сильным, что его можно слышать через тройные стекла (этому способствует также большая плотность морозного воздуха).
7. Примерзание к поверхности.
Добавьте в кастрюлю со снегом поваренную соль в соотношении примерно 1 к 6. Тщательно размешайте смесь. Если теперь вы захотите переставить кастрюлю, то её придётся поднять вместе с табуретом.
Это также подтверждает поглощение тепла из окружающей среды.
При смешивании соли со снегом происходит образование раствора, сопровождающееся сильным охлаждением вследствие большого поглощения теплоты льдом при его плавлении и солью при ее растворении. Так, например, температура смеси из 29 грамм соли и 100 грамм льда понижается до – 21°С. А если взять 143 грамма соли и 100 грамм льда, то температура может быть понижена до – 55°С.
2.3 Предложения по проведению опытов
Опыты по изучению свойств воды целесообразно проводить на уроках в средней и начальной школе.
При этом для детей начальной школы рекомендуется проведение опытов № 1 и 2 в домашних условиях под присмотром родителей.
Для учеников средней школы возможно проведение опытов № 3, 6 и 7 на уроках под руководством учителя, а опыты № 4 и 5 – факультативно или самостоятельно в домашних условиях.

Заключение
Таким образом, исследование свойств воды необходимо для человечества.
Процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней и начальной школе.
В работе удалось решить следующие задачи:
- Повести анализ основных свойств воды.
- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.
- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.
Значимость работы по систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли подтвердилась.
Источник