Оксид кремния (IV)
В природе:
SiO2 — кварц, горный хрусталь, аметист, агат, яшма, опал, кремнезём (основная часть песка)
Al2O3 •2SiO2 • 2H2O — каолинит (основная часть глины)
K2O • Al2O3 • 6SiO2 — ортоклаз (полевой шпат)
Физические свойства
Твёрдое, тугоплавкое вещество, t°пл.= 1728°C, t°кип.= 2590°C, атомная кристаллическая решетка.
Химические свойства оксида кремния
SiO2 — кислотный оксид, ему соответствует кремниевая кислота Н2SiO3
1) При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов с образованием солей — силикатов:
2) С водой не реагирует
3) С плавиковой кислотой (гексафторкремниевая кислота):
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + 6HF → H2[SiF6] + 2H2O
(реакции лежат в основе процесса травления стекла)
Окислительно — восстановительные реакции
Взаимодействие с металлами
При температуре выше 1000 °С реагирует с активными металлами,
при этом образуется кремний:
Источник
Оксид кремния (IV)
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) SiO2 – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Источник
Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
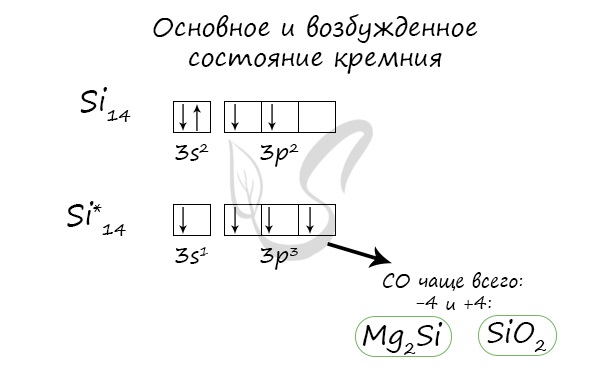
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Диоксид кремния
| Диоксид кремния | |
|---|---|
 | |
| Систематическое наименование | оксид кремния (IV) |
| Традиционные названия | кремнезём |
| Хим. формула | SiO2 |
| Рац. формула | SiO2 |
| Температура | |
| • плавления | 1600 °C |
| • кипения | 2950 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| ГОСТ | ГОСТ 9428-73 |
| Рег. номер CAS | 7631-86-9 |
| PubChem | 24261 |
| Рег. номер EINECS | 231-545-4 |
| SMILES | |
| Кодекс Алиментариус | E551 |
| RTECS | VV7565000 |
| ChEBI | 30563 |
| ChemSpider | 22683 |
| Токсичность | Пыль SiO2 чрезвычайно токсична и канцерогенна при вдыхании, поражает лёгкие, приводит к силикозу |
| Пиктограммы ECB |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Диоксид кремния (кремнезём, SiO2; лат. silica ) — оксид кремния (IV). Бесцветные кристаллы с температурой плавления +1713…+1728 °C, обладающие высокой твёрдостью и прочностью.
Диоксид кремния — главный компонент почти всех земных горных пород, в частности, кизельгура. Из кремнезёма и силикатов состоит 87 % массы литосферы. В крови и плазме человека концентрация кремнезёма составляет 0,001 % по массе.
Содержание
Свойства
- Относится к группе кислотных оксидов.
- При нагревании взаимодействует с основными оксидами и щелочами.
- Молярная масса: 60,084 г/моль
- Реагирует с плавиковой кислотой.
- SiO2 относится к группе стеклообразующих оксидов, то есть склонен к образованию переохлаждённого расплава — стекла.
- Диэлектрик (электрический ток не проводит, если не имеет примесей и не нагревается).
Полиморфизм
Диоксид кремния имеет несколько полиморфных модификаций.
Самая распространённая из них на поверхности земли — α-кварц — кристаллизуется в тригональной сингонии. При нормальных условиях диоксид кремния чаще всего находится в полиморфной модификации α-кварца, которая при температуре выше +573 °C обратимо переходит в β-кварц. При дальнейшем повышении температуры кварц переходит в тридимит и кристобалит. Эти полиморфные модификации устойчивы при высоких температурах и низких давлениях.
В природе также встречаются формы — опал, халцедон, кварцин, лютецит, аутигенный кварц, которые относятся к группе кремнезёма. Опал (SiO2·nH2O) в шлифе бесцветен, изотропен, имеет отрицательный рельеф, отлагается в морских водоёмах, входит в состав многих кремнистых пород. Халцедон, кварцин, лютецит — SiO2 — представляют собой скрытокристаллические разновидности кварца. Образуют волокнистые агрегаты, розетки, сферолиты, бесцветные, голубоватые, желтоватые. Отличаются между собой некоторыми свойствами — у халцедона и кварцина — прямое погасание, у лютецита — косое, у халцедона — отрицательное удлинение.
При высоких температуре и давлении диоксид кремния сначала превращается в коэсит (который в 1953 году был синтезирован американским химиком Лорингом Коэсом), а затем — в стишовит (который в 1961 году был синтезирован С. М. Стишовым, а в 1962 году был обнаружен в кратере Бэрринджера (кратере Аризонского метеорита). Согласно некоторым исследованиям, стишовит слагает значительную часть мантии, так что вопрос о том, какая разновидность SiO2 наиболее распространена на Земле, пока не имеет однозначного ответа.
Также имеет аморфную модификацию — кварцевое стекло.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с газообразным фтороводородом:
и плавиковой кислотой:
Эти две реакции широко используют для плавления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идёт об одном и том же веществе).
Например, может быть получен ортосиликат натрия:
или смешанный силикат кальция и натрия:
Из силиката Na2CaSi6O14 (Na2O·CaO·6SiO2) изготовляют оконное стекло.
Большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют жидким стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
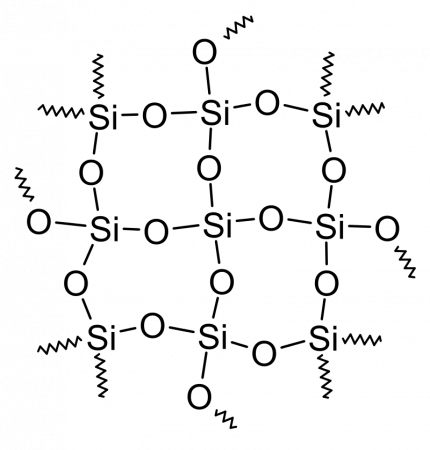
Главным структурным элементом как твёрдого диоксида кремния, так и всех силикатов, выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырёх атомов кислорода О. При этом каждый атом кислорода соединён с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Получение
Синтетический диоксид кремния получают нагреванием кремния до температуры +400…+500 °C в атмосфере кислорода, при этом кремний окисляется до диоксида SiO2. А также термическим оксидированием при больших температурах.
В лабораторных условиях синтетический диоксид кремния может быть получен действием кислот, даже слабой уксусной, на растворимые силикаты. Например:
кремниевая кислота сразу распадается на воду и SiO2, выпадающий в осадок.
Натуральный диоксид кремния в виде песка используется там, где не требуется высокая чистота материала.
Применение
Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E551, препятствующего слёживанию и комкованию, в парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство фармакопей), для стабилизации суспензий и линиментов, в качестве загустителя мазевых основ, наполнителя таблеток и суппозиториев. Он входит в состав композиции пломбировочных материалов, снижает гигроскопичность сухих экстрактов, замедляет выход БАВ из различных лекарственных форм; в качестве пищевых добавок и сорбента, а также матриц для создания лекарственных форм с заданными свойствами – так как нет кристаллической структуры (аморфен) – безопасен, а также в качестве пищевой добавки или лекарственного препарата в качестве энтеросорбента Полисорб МП с широким спектром применения с учётом высокой удельной поверхности сорбции (в интервале 300-400 м² ) на 1 г основного вещества.
Диоксид кремния применяют в производстве стекла, керамики, абразивов, бетонных изделий, для получения кремния, как наполнитель в производстве резин, при производстве кремнезёмистых огнеупоров, в хроматографии и другом.
Кристаллы кварца обладают пьезоэлектрическими свойствами и поэтому используются в радиотехнике, ультразвуковых установках, в зажигалках.
Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей. Используется чистый плавленый диоксид кремния с добавкой в него некоторых специальных ингредиентов.
Кремнезёмная нить также используется в нагревательных элементах электронных сигарет, так как хорошо впитывает жидкость и не разрушается под нагревом спирали.
Также диоксид кремния нашёл наиболее широкое применение в шинной промышленности, производстве РТИ и пластмасс, химической промышленности, машиностроении, а в ряде конкретных операций:
- как носитель катализаторов и химических средств защиты растений;
- в качестве сорбентов и фильтровальных порошков для регенерации нефтепродуктов;
- как высококачественный флюс в процессах цветной металлургии;
- как сырьё для производства экологически чистого стекла, стеклотары и хрусталя;
- как наполнитель в бумагу и картон для получения гигиенически чистых упаковочных материалов для пищевой промышленности;
- фильтрующие порошки для пива, масел, соков, матирующие добавки в лаки и краски;
- для получения карбида кремния в машиностроении – керамические двигатели, детали для авиастроительного комплекса;
- для получения кристаллического кремния в электронной и электротехнической промышленностях, керамические электроизоляторы, стекловолокна, волоконная оптика, супертонкое волокно;
- для синтеза искусственных цеолитов в нефтехимии — крекинг нефти и прочее.
Крупные прозрачные кристаллы кварца используются в качестве полудрагоценных камней; бесцветные кристаллы называют горным хрусталём, фиолетовые — аметистами, жёлтые — цитрином.
В микроэлектронике диоксид кремния является одним из основных материалов. Его применяют в качестве изолирующего слоя, а также в качестве защитного покрытия. Получают в виде тонких плёнок термическим окислением кремния, химическим осаждением из газовой фазы, магнетронным распылением.
Пористые кремнезёмы
Пористые кремнезёмы получают различными методами.
Силохром получают путём агрегирования аэросила, который, в свою очередь, получают сжиганием силана (SiH4). Силохром характеризуется высокой чистотой, низкой механической прочностью. Характерный размер удельной поверхности 60—120 м²/г. Применяется в качестве сорбента в хроматографии, наполнителя резин, катализе.
Силикагель получают путём высушивания геля кремниевой кислоты. В сравнении с силохромом обладает меньшей чистотой, однако может обладать чрезвычайно развитой поверхностью: обычно от 300 м²/г до 700 м²/г .
Кремниевый аэрогель приблизительно на 99,8 % состоит из воздуха и может иметь плотность до 1,9 кг/м³ (всего в 1,5 раза больше плотности воздуха).
Токсичность
Хотя и сам диоксид кремния считается нетоксичным, однако его пыль является токсичной и канцерогенной при вдыхании (как и пыль асбеста) . Вдыхание пыли приводит к бронхиту, воспалению лёгких (силикоз) и онкологическим заболеваниям.
Источник