- IT News
- Почему в кипящей воде образуются пузыри пара?
- Рождение и гибель пузырей
- Камень для предупреждения выплескивания
- Откуда в кипящей воде пузыри?
- Что такое кипение?
- Фазы кипения
- Почему в кипящей воде образуются пузыри?
- Что такое пузыри в кипящей воде? — 2021
- Настя и сборник весёлых историй
- Быстрые факты: пузыри кипящей воды
- Что внутри пузырьков кипящей воды?
- Состав пузырьков в других кипящих жидкостях
- Кипение без пузырей
- Как сделать замороженные пузыри на сухом льду
- Стоит ли пускать мыльные пузыри при плавании?
- Как сделать пузыри, которые не поп
- Из чего образуются пузыри при закипании воды?
- Химические свойства молекул воды
- Растворенные вещества в воде
- Последовательность событий при кипении воды
IT News
Last update Вс, 29 Янв 2017 11pm
Почему в кипящей воде образуются пузыри пара?
Любая жидкость при нагревании со временем достигает температуры, при которой она начинает кипеть. Во время кипения пузыри пара образуются во всем объеме жидкости, поднимаются на ее поверхность и лопаются, высвобождая горячий пар в воздух. Вода кипит при температуре 100°С (212°F).
При температуре кипения каждая молекула имеет достаточно энергии для преодоления сил, удерживающих ее вместе с другими молекулами в виде жидкости. Например, сосуд с кипящей водой содержит воду в жидком состоянии, которая превращается в водяной пар. Поверхностный водяной пар сразу же покидает кипящую воду. Что касается парообразования в толще воды, то там водяной пар формирует пузыри, каждый из которых, поднимаясь вверх, несет в себе миллиарды молекул воды.
Кипящая вода совершает фазовый переход из жидкого состояния в газообразное в процессе, называющемся парообразованием. Жидкости превращаются в пар и при температурах, меньших температуры кипения, в процессе, называющемся испарением. В отличие от кипения испарение происходит только с поверхности в том случае, когда молекулы имеют достаточно энергии, чтобы покинуть жидкость. Хотя испарение с ростом температуры интенсифицируется, пузыри пара образуются только во время кипения.
Рождение и гибель пузырей
- Вода содержит в себе воздух, растворенный или прилипший к попавшим внутрь частицам пыли (рисунок слева). При увеличении температуры воды растворимость воздуха уменьшается, в результате происходит формирование небольших воздушных пузырьков, большинство из которых быстро поднимается вверх и покидает жидкость. Этот процесс не является кипением.
- Когда вода приближается к точке кипения, пузыри водяного пара формируются на пылевых частицах и других примесях (так называемых ядрах парообразования). В этих пузырях температура превышает температуру кипения.
- Все больше водяного пара проникает в первые пузыри. Но так как окружающая вода все еще слишком холодна, эти пузыри конденсируются во время своего подъема и не достигают поверхности.
- Пузыри пара формируются во всем объеме кипящей воды, увеличиваясь в размерах по мере подъема к поверхности. Достигнув поверхности, пузыри лопаются и водяной пар выходит в атмосферу.
Камень для предупреждения выплескивания
Используемые в лабораторной практике дистиллированная вода и другие чистые жидкости, будучи свободными от пыли, недодержат ядер парообразования. В таких жидкостях могут формироваться большие, похожие на пленку пузыри пара, приводящие к опасному выплескиванию кипящей жидкости из сосуда. Специальный пористый камень (снимок справа) предупреждает такое выплескивание, предоставляя свою поверхность для образования многочисленных, постепенно растущих пузырьков пара.
Источник
Откуда в кипящей воде пузыри?
Появление быстро лопающихся, бурлящих пузырей на поверхности указывает нам на то, что вода закипела. Стоит разобраться, что такое кипение, из каких фаз оно состоит и почему в воде образуются пузыри.
Что такое кипение?
Кипение – это процесс активного образования пара, который происходит внутри и на поверхности жидкости. Он может возникать только при условии определенного давления и температуры жидкости.

Исходя из этого, температура, при которой закипает жидкость, называется ее температурой или точкой кипения. У всех веществ данный показатель разный. Например, вода кипит при 100℃, спирт – при 78℃, ртуть – при 357℃.
Фазы кипения
Самый простой пример кипения – постепенное нагревание кастрюли с водой на кухонной плите. В скором времени можно заметить множество мелких пузырьков, которые поднимаются на поверхность. Они состоят из воздуха, газов, которые присутствуют в воде. Если кастрюля накрыта крышкой, на ней изнутри появится пар. Это значит, что жидкость нагревается – первая фаза (60-75℃).
Логично, что на самом дне емкости вода будет нагреваться быстрее, так как ближе всего находится к источнику тепла. Срабатывает режим конвекции: нагретая жидкость поднимается вверх, а более прохладная – опускается вниз. Происходит смешивание воды.
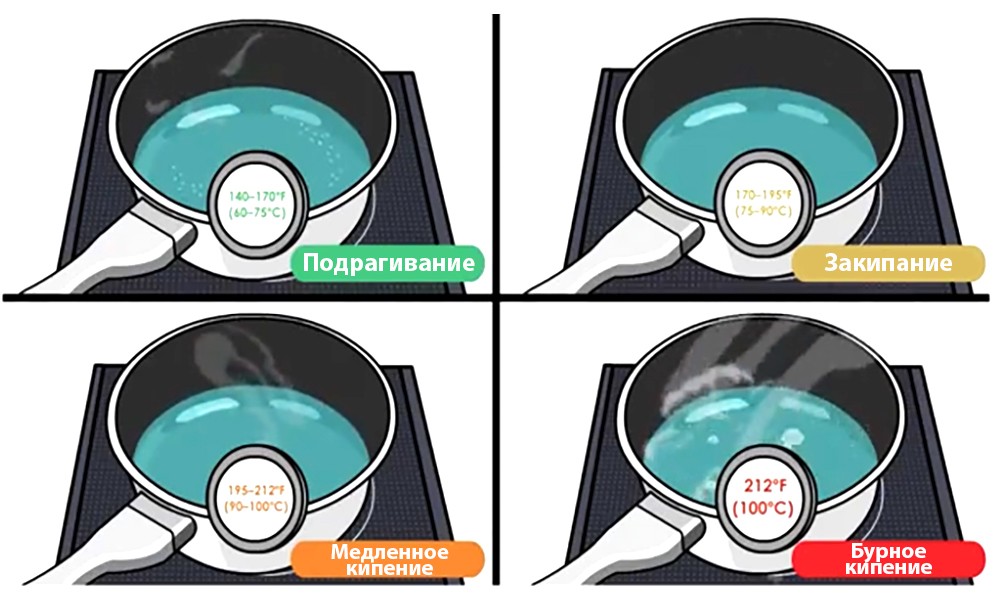
Далее нижний слой жидкости начинает понемногу испаряться – вторая фаза (75-90℃). Этот процесс сопровождается характерными звуками в виде жужжания, отрывистых гудков и т.п. Исходят они как раз из лопающихся в массе воды пузырей, которые уже стали намного крупнее. Поднимаясь со дна кастрюли, они соприкасаются с холодной водой и пар внутри пузырька конденсируется.
Если подача тепла не прекращается, вся вода становится примерно одинаковой температуры, начинается третья фаза. Теперь пузыри не конденсируются, могут свободно достигать поверхности и взрываться там. До этого момента шум воды нарастает, а затем начинает стихать. Лишь сейчас можно говорить о том, что жидкость кипит (100℃).
Интересно, что в бытовых условиях невозможно перейти к следующей фазе. Температура кипения достигнута, и вода будет просто испаряться. Но, например, в лаборатории можно продолжить повышение температуры с помощью горелки. При этом количество пузырьков станет настолько огромным, что все вместе они образуют столбы пара.
В данном случае говорят о пузырьковом кипении. Последующий нагрев запускает переходный режим. Что интересно, чем сильнее при этом повышается температура, тем медленнее происходит передача тепла воде. Дело в том, что на дне кастрюли формируется слой пара, который хуже передает тепло.

Постепенно он становится сплошным. Запускается фаза пленочного кипения – вода над слоем пара получает тепло очень медленно. Яркий пример этого явления – капля воды, пролитая на очень хорошо разогретую сковородку. Если температура емкости превышает температуру кипения воды, то капля не испарится мгновенно, а свернется в шарик и сможет просуществовать около минуты.
Данное явление описано немецким ученым Иоганном Готлобом Лейденфростом в 1756 г., поэтому сейчас оно так и называется – эффект Лейденфроста. Секрет бегающих по сковороде капель довольно прост. Попадая на разогретую поверхность, нижняя часть капли мгновенно испаряется и образует слой пара, который изолирует остальную жидкость на некоторое время.
Почему в кипящей воде образуются пузыри?
Что же вызывает появление пузырей в кипящей воде? В емкости имеются микроскопические трещины и впадины. Они служат центрами парообразования. Именно на этих шероховатых участках разрушаются водородные связи между молекулами.
Наружу высвобождается определенный объем пара. Пузырек постепенно увеличивается и отрывается от поверхности, однако на его месте образуется новый. Если поверхность емкости очень гладкая, вода может нагреться до 100℃, но так и не перейдет в стадию кипения. Такую жидкость называют перегретой. Она может вскипеть мгновенно в случае попадания примесей или толчка посуды.
Пузыри в кипящей воде – это растворенный в ней воздух. Его молекулы собираются в центрах парообразования, которыми служат микротрещины на дне емкости. Постепенно пузыри увеличиваются в размерах, отрываются от дна и лопаются на поверхности, а на их месте возникают новые.
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
Что такое пузыри в кипящей воде? — 2021
Настя и сборник весёлых историй
Пузыри образуются при кипячении воды. Задумывались ли вы, что внутри них? Формируются ли пузырьки в других кипящих жидкостях? Вот посмотрите на химический состав пузырьков, отличаются ли пузырьки кипящей воды от тех, которые образуются в других жидкостях, и как кипятить воду без образования каких-либо пузырьков вообще.
Быстрые факты: пузыри кипящей воды
- Первоначально пузырьки в кипящей воде представляют собой пузырьки воздуха.
- Пузырьки в воде, доведенные до кипения, состоят из водяного пара.
- Если вы кипятите воду, пузырьки могут не образовываться. Это может привести к взрывному кипению!
- Пузыри образуются и в других жидкостях. Первые пузырьки состоят из воздуха, за которым следует паровая фаза растворителя.
Что внутри пузырьков кипящей воды?
Когда вы впервые начинаете кипятить воду, пузырьки, которые вы видите, в основном пузырьки воздуха. Технически, это пузырьки, образованные из растворенных газов, которые выходят из раствора, поэтому, если вода находится в другой атмосфере, пузырьки будут состоять из этих газов. При нормальных условиях первые пузырьки — это в основном азот с кислородом и немного аргона и углекислого газа.
Когда вы продолжаете нагревать воду, молекулы приобретают достаточно энергии для перехода из жидкой фазы в газовую фазу. Эти пузырьки являются водяным паром. Когда вы видите воду при «кипящем кипении», пузырьки являются полностью водяным паром. На местах зарождения начинают образовываться пузырьки водяного пара, которые часто представляют собой крошечные пузырьки воздуха, поэтому, когда вода начинает кипеть, пузырьки состоят из смеси воздуха и водяного пара.
Как пузырьки воздуха, так и пузырьки водяного пара расширяются, поскольку они поднимаются, потому что на них оказывается меньше давления. Вы можете увидеть этот эффект более четко, если вы будете пускать пузыри под водой в бассейне. Пузырьки становятся намного больше к тому времени, когда они достигают поверхности. Пузырьки водяного пара начинают увеличиваться по мере повышения температуры, поскольку в газ превращается больше жидкости. Кажется, что пузырьки исходят от источника тепла.
В то время как пузырьки воздуха поднимаются и расширяются, иногда пузырьки пара сжимаются и исчезают, когда вода переходит из состояния газа обратно в жидкую форму. Два места, где вы можете увидеть пузырьки, находятся на дне кастрюли непосредственно перед тем, как вода закипит, и на верхней поверхности. На верхней поверхности пузырь может разбиться и выпустить пар в воздух, или, если температура достаточно низкая, пузырь может сжаться. Температура на поверхности кипящей воды может быть ниже температуры нижней жидкости из-за энергии, которая поглощается молекулами воды при смене фаз.
Если вы дадите кипяченой воде остыть и сразу же кипятите ее, вы не увидите пузырьков растворенного воздуха, потому что вода не успела растворить газ. Это может представлять угрозу безопасности, потому что пузырьки воздуха разрушают поверхность воды в достаточной степени, чтобы предотвратить ее взрывное кипение (перегрев). Вы можете наблюдать это с водой в микроволновке. Если вы кипятите воду достаточно долго для выхода газов, дайте воде остыть, а затем сразу же кипятите ее, поверхностное натяжение воды может предотвратить кипение жидкости, даже если ее температура достаточно высока. Тогда столкновение с контейнером может привести к внезапному сильному кипению!
Люди часто думают, что пузыри сделаны из водорода и кислорода. Когда вода кипит, она меняет фазу, но химические связи между атомами водорода и кислорода не нарушаются. Единственный кислород в некоторых пузырьках поступает из растворенного воздуха. Там нет никакого газообразного водорода.
Состав пузырьков в других кипящих жидкостях
Если вы кипятите другие жидкости, кроме воды, происходит тот же эффект. Начальные пузырьки будут состоять из любых растворенных газов. По мере приближения температуры к точке кипения жидкости пузырьки станут паровой фазой вещества.
Кипение без пузырей
В то время как вы можете вскипятить воду без пузырьков воздуха, просто кипятив ее, вы не сможете достичь точки кипения, не получив пузырьков пара. Это верно для других жидкостей, в том числе расплавленных металлов. Однако ученые обнаружили способ предотвращения образования пузырьков. Метод основан на эффекте Лейденфроста, который можно увидеть, разбрызгивая капельки воды на горячей сковороде. Если поверхность воды покрыта высокогидрофобным (водоотталкивающим) материалом, образуется паровая подушка, которая предотвращает образование пузырьков или взрывное кипение. Техника не имеет большого применения на кухне, но она может быть применена к другим материалам, потенциально уменьшая поверхностное сопротивление или управляя процессами нагрева и охлаждения металла.
Как сделать замороженные пузыри на сухом льду
Давайте сделаем замороженные пузырьки, используя сухой лед и пузырьковую палочку. Вы можете подобрать замороженные пузырьки, чтобы внимательно изучить их.
Стоит ли пускать мыльные пузыри при плавании?
Некоторые пловцы пускают мыльные пузыри, а другие нет. Вот несколько советов о том, как дышать во время плавания, которые могут помочь вам во время следующей тренировки.
Как сделать пузыри, которые не поп
Если вы устали от пузырьков, которые появляются, как только вы их дуете, попробуйте этот рецепт для неразрушимых пузырьков.
Источник
Из чего образуются пузыри при закипании воды?
Если вы когда-нибудь кипятили воду, то наверняка заметили, что при нагревании воды образуются очень маленькие пузырьки, которые поднимаются снизу вверх. Сначала пузырьки немногочисленны, но по мере нагревания воды начинает образовываться все больше пузырьков больших размеров. Дальнейшее повышение температуры приводит к появлению еще более крупных пузырьков, которые образуются довольно часто и сразу же поднимаются вверх. Эта эскалация достигает пика, когда вода начинает кипеть.
Но почему кипящая вода образует пузырьки?
Ответ на этот вопрос связан с химией самой воды. Точнее, это связано со всеми растворенными в воде веществами, а также с характером связи между молекулами воды.
Химические свойства молекул воды
Каждая молекула воды состоит из двух атомов водорода (H) и одного атома кислорода (O). Оба атома H ковалентно связаны с единственным атомом O. Каждый элемент в природе стремится достичь состояния с минимально возможной энергией. Это состояние достигается путем потери или приобретения электронов для достижения ближайшей конфигурации инертного газа.
Иллюстрация молекулы воды
Атом кислорода имеет шесть электронов в своей валентной (внешней) оболочке. Ближайший инертный газ, неон, имеет восемь электронов в своей валентной оболочке. Таким образом, O имеет сильную тенденцию получить два электрона и достичь стабильной электронной конфигурации (перейти в состояние с наименьшей энергией). Водород имеет один электрон в своей валентной оболочке, в то время как ближайший благородный газ, гелий, имеет два электрона на своей валентной оболочке. Таким образом, H стремится получить один электрон, чтобы достичь стабильной электронной конфигурации.
Оба атома H делят по одному электрону с O, а O делит два электрона, по одному на каждый H. Это ковалентная связь. Кислород имеет сильную тенденцию притягивать к себе общие электроны благодаря свойству, называемому электроотрицательностью. Таким образом, электроны проводят больше времени возле атома O, чем возле атома H, что приводит к частичному отрицательному заряду на O и частичному положительному заряду на H.
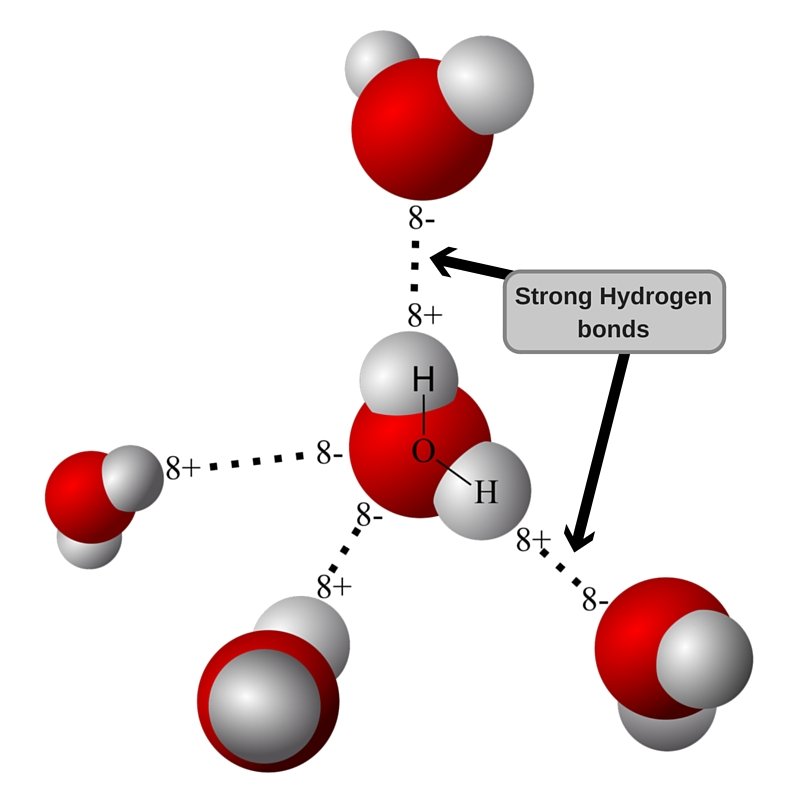
Геометрия молекулы воды такова, что заряды не компенсируются, и есть разделение центров заряда (поляризация). Когда две молекулы воды с небольшой поляризацией приближаются друг к другу, частично отрицательный O одной молекулы притягивает частично положительный H другой молекулы, образуя слабую межмолекулярную связь. Это называется водородной связью, и это сила, отвечающая за удержание молекул воды вместе.
Визуализация водородной связи.
Поскольку водородная связь слабая, вода остается жидкой при комнатной температуре, а при повышении температуры молекулы получают больше энергии для преодоления межмолекулярной водородной связи. При 100 °C энергии достаточно для того, чтобы молекулы вырвались на свободу.
Растворенные вещества в воде
Растворение одного вещества в другом возможно только при наличии взаимодействия между молекулами двух веществ. Подобным образом, некоторые газы, например, O2, CO2, N2, NH3 и SO2, растворяются в воде, потому что между молекулами воды и молекулами газа существует притягательное взаимодействие.
Есть два способа растворения газов в воде: ван-дер-ваальсова связь и водородная связь.
Гетероядерные молекулы (т.е. имеющие атомы из разных элементов), такие, как NH3 или CO2, имеют разницу в электроотрицательности между атомами. N и O более электроотрицательны, чем H и C, соответственно. Таким образом, N и O остаются частично отрицательными, а H и C становятся частично положительными. Это приводит к частичной поляризации молекул NH3 и CO2.
Отрицательные концы (N и O) притягиваются к частично положительному H воды; в то же время положительные концы (H и C) притягиваются к частично отрицательному O воды. Это и есть водородная связь. Чем больше поляризация газообразной молекулы, тем лучше она растворяется в воде.
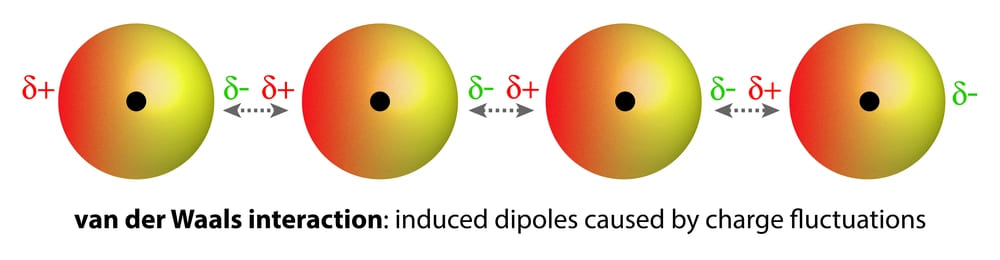
Гомоядерные молекулы (т.е. имеющие атомы одного и того же элемента), такие, как O2 и N2, неполярны и плохо растворимы (очень низкая растворимость) в воде. Слабые ван-дер-ваальсовы силы притяжения удерживают эти газы с молекулами воды. Они намного слабее, чем диполь-дипольные взаимодействия.
Слабые силы Ван-дер-Ваальса возникают из-за изменения распределения заряженных электронов вокруг атомов, что приводит к временной индуцированной поляризации.
Растворимость газов в воде уменьшается при повышении температуры.
Последовательность событий при кипении воды
Возьмем жидкую воду при комнатной температуре (25 °С). При этой температуре растворимость O2 составляет 8,27 мг/л, а CO2 — 1,5 г/л. При повышении температуры молекулы газа и воды приобретают больше кинетической энергии. Благодаря этой энергии всем молекулам легче преодолеть межмолекулярное притяжение. При температуре 50 °С растворимость O2 уменьшается до 2,75 мг/л, а растворимость CO2 — до 0,75 г/л. Это снижение растворимости означает, что газообразные молекулы могут преодолеть слабое межмолекулярное притяжение. Поскольку плотность молекул газа ниже плотности воды, они поднимаются наверх в виде пузырьков. Гомоядерные молекулы, такие как N2 и O2, всплывают при низких температурах из-за слабых ван-дер-ваальсовых сил. Дальнейшее повышение температуры приводит к выделению пузырьков полярных молекул, таких как CO2 и NH3, которые удерживаются диполь-дипольными взаимодействиями.
Молекулы газа, вырывающиеся из воды.
Это бульканье продолжается до тех пор, пока не будет достигнута точка кипения воды. Нагревание воды происходит не совсем равномерно, то есть существуют области более высоких и более низких температур. При температуре выше 90 °С некоторые молекулы воды вблизи дна получают достаточно энергии для перехода в парообразную фазу. Образуются области газообразной воды, о чем свидетельствуют огромные пузыри, поднимающиеся со дна. Кроме того, из-за энергичного движения молекул конвективный нагрев еще больше повышает температуру. При температуре 100 °С почти все молекулы воды обладают достаточной кинетической энергией для перехода в парообразное состояние, и пузырьки водяного пара начинают стремительно подниматься вверх!
Источник