- Универсальный растворитель – определение и характеристики
- Универсальное определение растворителя
- Характеристики универсального растворителя
- полярность
- Высокая удельная теплоемкость
- Уникальные свойства плотности и температуры
- викторина
- Универсальное определение растворителя — 2021
- «Ил-2 Штурмовик» нового поколения — «Битва за Сталинград» и «Битва за Москву» #13
- Ключевые выводы: универсальный растворитель
- Универсальное определение растворителя
- Почему вода называется универсальным растворителем
- Алкахест как универсальный растворитель
- Другие важные растворители
- Почему нет универсального растворителя
- источники
- Экспоненциальный спад: определение и функция
- Универсальное желание: «Приятного аппетита»
- Хиллари Клинтон и Универсальное Здравоохранение
- Общеклинические исследования
- 1. Вода — универсальный биологический растворитель
Универсальный растворитель – определение и характеристики
Универсальное определение растворителя
Вода это вещество, которое мы называем универсальным растворитель, Растворитель – это просто жидкость, в которой могут растворяться другие вещества, и причина, по которой вода получила ярлык универсального растворителя, заключается в том, что никакой другой растворитель не может растворить столько веществ, сколько может. Это в основном то, что делает его таким важным для жизни на земле. Кроме того, удивительно, что каждый водоем, найденный на земле, включая лед, поддерживает ту или иную форму жизни, которая адаптировалась к температуре и давлению, обнаруженному в этой форме воды.
Тот простой факт, что ученым всегда интересно находить воду, связанную с жизнью, на других планетах, многое говорит об этом, казалось бы, простом веществе. Вода является наиболее распространенным веществом в организмах и клетках. Конечно, есть много очевидных применений для воды, таких как питье, мытье и тушение пожаров, и это благодаря характеристикам, которыми он обладает, которые делают его универсальным растворителем. Вода очень важна для жизни, потому что для многих важных реакций в организме организмов необходима водная среда. Например, вода необходима для переваривания белков в аминокислоты, И в фотосинтез и пищеварение.
Характеристики универсального растворителя
полярность
Это большая часть того, почему вода является универсальным растворителем. Полярность – это неравномерность распределения электронов в молекула, что приводит к одной молекуле, имеющей две противоположные стороны; один отрицательный и один положительный. Теперь вода имеет молекулярную формулу H2O, поэтому каждая молекула воды имеет два атома водорода и один атом кислорода, как вы можете видеть на диаграмме ниже. Атомы водорода не находятся на противоположных сторонах друг друга, и они несут частичный положительный заряд. Это означает, что они создают положительно заряженную часть молекулы, в то время как кислородный конец создает отрицательно заряженную часть. Эта полярность означает, что вода может присоединяться и, следовательно, растворять полярные и ионные (заряженные) вещества.
Высокая удельная теплоемкость
Количество энергии, необходимое для повышения температуры одного грамма воды на 1 градус Цельсия, является ее удельной теплотой, и при одной калории на грамм она намного выше, чем удельная теплоемкость большинства жидкостей. Это хорошая новость для нас, так как мы на 60% состоим из воды, и мы не смогли бы выжить, если бы наши тела сильно и быстро остыли и нагрелись. Это также имеет решающее значение для выживания всех других организмов, в том числе водных организмов. Это означает, что океаны и реки не замерзают постоянно или не испаряются при изменении температуры. Если вода не может стабилизировать свою температуру, энергия, которая выделяется во время обмена веществ в живых организмах, может привести к перегреву и смерти.
Уникальные свойства плотности и температуры
Когда мы помещаем кубик льда в воду, он плавает, и, к счастью, то же самое относится и к айсбергу. Если бы лед был более плотным, чем вода, он бы постоянно замерзал наверху, а затем опускался, пока все водоемы не превратятся в лед, уничтожая всю жизнь. Вода также существует в виде газа, жидкости и твердого вещества в очень небольшом диапазоне температур, что означает, что мы можем найти ее во всех трех формах на Земле в зависимости от того, где мы находимся, и часто в одном и том же месте. Это не часто встречающаяся собственность.
- растворенное вещество – Это вещество, которое растворяется в другом растворителе.
- Ковалентная связь – Распределение электронов между атомами с образованием молекулы.
- Круговорот воды – Процесс циркуляции воды между различными элементами земли – атмосферой, землей и океанами.
- метаболизм – Все химические реакции, происходящие внутри живых организмов.
викторина
1. Вода считается полярной, потому что:A. У этого есть одна отрицательная сторона и другая, которая является положительной.B. Это универсальный растворитель.C. У него два атома водорода.D. Это самый плотный в твердой форме.
Ответ на вопрос № 1
верно. У воды есть сторона, которая немного положительна, и сторона, которая слегка отрицательна.
2. Что из следующего является силой, которая удерживает молекулы воды вместе?A. Ковалентные связи B. Ионные связиC. Полярные связиD. Водородные связи
Ответ на вопрос № 2
D верно. Водородные связи образуются между атомами кислорода и атомами водорода различных молекул воды.
3. Какое свойство относится к слипшимся молекулам воды?A. прилипание B. полярностьC. когезияD. Быть универсальным растворителем
Ответ на вопрос № 3
С верно. Силы сцепления, вызванные водородными связями, делают воду эластичной.
Источник
Универсальное определение растворителя — 2021
«Ил-2 Штурмовик» нового поколения — «Битва за Сталинград» и «Битва за Москву» #13
Технически, растворитель является компонентом раствора, присутствующего в большем количестве. Напротив, растворенные вещества присутствуют в меньшем количестве. В обычном использовании растворитель — это жидкость, которая растворяет химические вещества, такие как твердые вещества, газы и другие жидкости.
Ключевые выводы: универсальный растворитель
- Универсальный растворитель теоретически растворяет любой другой химикат.
- Истинного универсального растворителя не существует.
- Воду часто называют универсальным растворителем, потому что она растворяет больше химикатов, чем любой другой растворитель. Однако вода растворяет только другие полярные молекулы. Он не растворяет неполярные молекулы, включая органические соединения, такие как жиры и масла.
Универсальное определение растворителя
Универсальный растворитель — это вещество, которое растворяет большинство химических веществ.Вода называется универсальным растворителем, потому что она растворяет больше веществ, чем любой другой растворитель. Однако ни один растворитель, включая воду, не растворяет все химические вещества. Как правило, «подобное растворяет подобное». Это означает, что полярные растворители растворяют полярные молекулы, такие как соли. Неполярные растворители растворяют неполярные молекулы, такие как жиры и другие органические соединения.
Почему вода называется универсальным растворителем
Вода растворяет больше химикатов, чем любой другой растворитель, потому что ее полярная природа дает каждой молекуле гидрофобную (боязливую воду) и гидрофильную (любящую воду) сторону. Сторона молекул с двумя атомами водорода имеет небольшой положительный электрический заряд, а атом кислорода несет небольшой отрицательный заряд. Поляризация позволяет воде привлекать много разных типов молекул. Сильное притяжение к ионным молекулам, таким как хлорид натрия или соль, позволяет воде разделить соединение на его ионы. Другие молекулы, такие как сахароза или сахар, не разрываются на ионы, а равномерно диспергируются в воде.
Алкахест как универсальный растворитель
Алкахест (иногда пишется alcahest) является гипотетическим истинно универсальным растворителем, способным растворять любое другое вещество. Алхимики искали легендарный растворитель, так как он мог растворить золото и найти полезное лекарственное применение.
Считается, что слово «алкахест» было придумано Парацельсом, который основывался на арабском слове «щелочь». Парацельс приравнивал алкахеста к философскому камню. Его рецепт для алкаэста включал едкую известь, спирт и карбонат калия (карбонат калия). Рецепт Парацельса не мог растворить все.
После Парацельса алхимик Франциск ван Гельмонт описал «ликер алкахест», который представлял собой своего рода растворяющуюся воду, способную разбить любой материал на его основное вещество. Ван Гельмонт также писал о «соляной щелочи», которая представляла собой едкий калиевый раствор в спирте, способный растворять многие вещества. Он описал смешивание соляной щелочи с оливковым маслом для получения сладкого масла, вероятно, глицерина.
Хотя alkahest не является универсальным растворителем, он все еще находит применение в химической лаборатории. Ученые используют рецепт Парацельса, смешивая гидроксид калия с этанолом для очистки лабораторной посуды. Затем посуду ополаскивают дистиллированной водой, чтобы она оставалась чистой.
Другие важные растворители
Растворители делятся на три широкие категории. Есть полярные растворители, такие как вода; неполярные растворители, такие как ацетон; и затем есть ртуть, специальный растворитель, который образует амальгаму. Вода — безусловно самый важный полярный растворитель. Существует несколько неполярных органических растворителей. Например, тетрахлорэтилен для химической чистки; ацеторы, метилацетат и этилацетат для клея и лака для ногтей; этанол для парфюмерии; терпены в моющих средствах; эфир и гексан для точечного удаления; и множество других растворителей, специфичных для их назначения.
Хотя чистые соединения могут быть использованы в качестве растворителей, промышленные растворители, как правило, состоят из комбинаций химических веществ. Этим растворителям присваиваются названия alphanumeroc. Например, растворитель 645 состоит из 50% толуола, 18% бутилацетата, 12% этилацетата, 10% бутанола и 10% этанола. Растворитель П-14 состоит из 85% ксилола и 15% ацетона. Растворитель RFG сделан с 75% этанолом и 25% бутанолом. Смешанные растворители могут влиять на смешиваемость растворенных веществ и улучшать растворимость.
Почему нет универсального растворителя
Алкахест, если бы он существовал, поставил бы практические проблемы. Вещество, которое растворяет все остальные, не может храниться, потому что контейнер будет растворен. Некоторые алхимики, включая Philalethes, обошли этот аргумент, заявив, что alkahest будет растворять материал только до его элементов. Конечно, по этому определению алкахест не сможет растворить золото.
источники
- Гутман В. (1976). «Влияние растворителя на реакционную способность металлоорганических соединений». Коорд. Химреагент оборот , 18 (2): 225. doi: 10.1016 / S0010-8545 (00) 82045-7.
- Лейнхард, Джон «No.1569 Алкахест». Университет Хьюстона.
- Philalethes, Eirenaeus. «Секрет бессмертного ликера под названием Алкахест или Игнис-Аква»
- Тиноко, Игнасио; Зауэр, Кеннет и Ван, Джеймс С. (2002) Физическая химия , Прентис Холл р. 134 ISBN 0-13-026607-8.
Экспоненциальный спад: определение и функция
Узнайте об экспоненциальном затухании, экспоненциальной функции, которая описывает, когда первоначальная сумма уменьшается на постоянную ставку в течение определенного периода времени.
Универсальное желание: «Приятного аппетита»
«Приятного аппетита» — это всеобщее желание, когда человек собирается есть. Это может буквально означать «хороший аппетит», но его цель — «приятного аппетита».
Хиллари Клинтон и Универсальное Здравоохранение
Узнайте, где Хиллари Клинтон стоит на здравоохранении. Посмотрите, какой план медицинского обслуживания она предложила в прошлом.
Источник
Общеклинические исследования
1. Вода — универсальный биологический растворитель
Растворителем, в котором работают почти все известные живые системы, служит окись водорода, или вода (H 2O). В молекуле воды атом кислорода соединен с двумя атомами водорода одинарными ковалентными связями. Чтобы понять, почему это важно и на что это влияет, нам придется ввести несколько дополнительных понятий из общей химии.
Электроотрицательность — сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Это понятие ввел Лайнус Полинг (Linus Carl Pauling). Самый электроотрицательный элемент — фтор, за ним на шкале электроотрицательности следует кислород. Иными словами, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора (который в биологической химии практически не встречается). Запомним этот факт.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующие ее электроны никуда не смещены (в рамках старинной планетарной модели атома можно сказать, что они находятся точно посредине между атомами, как на картинке). Такая ковалентная связь называется неполярной.
Если ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого выше электроотрицательность. Такая связь называется полярной. При очень большой разнице в электроотрицательности она может даже стать ионной — это случится, если один атом полностью “отберет” у другого общую пару электронов.
Связь между водородом и кислородом в молекуле воды — типичный пример ковалентной полярной связи. Электроотрицательность кислорода намного выше, поэтому общие электроны смещены к нему. В результате на кислороде возникает маленький отрицательный заряд, а на водороде маленький положительный; эти заряды принято обозначать буквой δ (“дельта”).
Связи кислорода с водородом или углеродом (H-O или C-O) — всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде. В то же время связь между углеродом и водородом (C-H) считается неполярной: разница в электроотрицательности между этими элементами так мала, что смещение электронов незаметно. Например, молекулы углеводородов в силу этого полностью неполярны, они не несут никаких частичных зарядов ни на каких атомах.
При наличии полярных связей между водородом и кислородом частичные заряды на этих атомах (отрицательные на кислороде и положительные на водороде) притягиваются друг к другу, образуя водородные связи. Эти связи гораздо слабее ковалентных, но могут давать сильный эффект, если их много. Например, именно из-за колоссального количества водородных связей у воды очень высокая теплоемкость — ее трудно нагреть и трудно остудить. Строго говоря, водородная связь может образоваться не только с кислородом, но и с другими электроотрицательными атомами (например, с азотом или фтором).
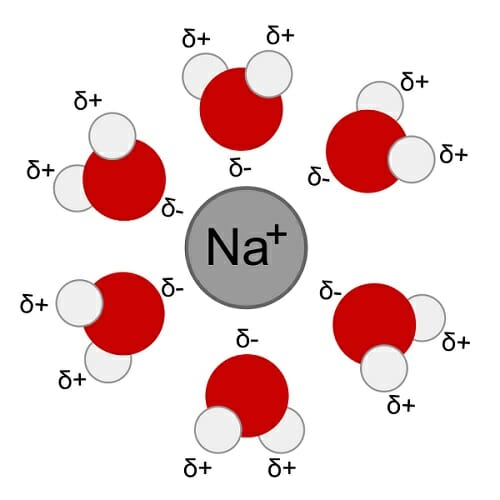
Любые заряженные частицы в водном растворе гидратируются, то есть окружаются молекулами воды — конечно, по-разному ориентированными в зависимости от того, положительная это частица или отрицательная. Любые ионы, растворенные в воде, на самом деле присутствуют там в гидратированном состоянии, то есть с водной оболочкой. На картинке для примера показана растворенная поваренная соль (NaCl) — образец чисто ионного вещества.
Полярные молекулы (а тем более ионы) хорошо взаимодействуют с водой, образуя с ней водородные связи и (или) подвергаясь гидратации. Такие вещества хорошо растворяются в воде и называются гидрофильными. Неполярные молекулы взаимодействуют с водой гораздо слабее, чем друг с другом. Такие вещества плохо растворяются в воде и называются гидрофобными. Типичные гидрофобные вещества — углеводороды. Типичные гидрофильные вещества — спирты, такие как этанол или показанный на картинке глицерин. Вообще кислородсодержащие соединения углерода, как правило, гидрофильны, если только в них нет совсем уж огромных углеводородных радикалов.
Могут ли подойти для жизни другие растворители, кроме воды? Ответ — да. Например, двуокись углерода (CO 2) при более высоких давлениях, чем наше атмосферное, становится жидкостью и представляет собой хороший гидрофильный растворитель, в котором успешно идут многие биохимические реакции. В этом растворителе могут жить даже земные микроорганизмы: например, на дне Окинавского желоба в Восточно-Китайском море обнаружено целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии (Inagaki et al., 2006).
Некоторые исследователи предполагают, что океаны жидкой двуокиси углерода могут существовать на планетах-“суперземлях” с массой, в несколько раз превосходящей массу Земли (Budisa, Schulze-Makuch, 2014). На картинке — художественное изображение планеты GJ1214b в созвездии Змееносца.
На крупнейшем спутнике Сатурна — Титане — есть углеводородные озера и даже моря, состоящие из метана (CH 4), этана (C 2H 6) и пропана (C 3H 8). Это гидрофобный растворитель, в котором тоже иногда предполагают существование жизни, хотя прямых подтверждений тому пока нет. На картине — пейзаж Титана. Жидкой воды на поверхности Титана нет, там слишком холодно.
Аммиак (NH 3) — гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом, и напоминающий воду по физико-химическим свойствам. На более холодных планетах, чем Земля, аммиак находится в жидком состоянии и вполне может быть средой для жизни.
Теоретически возможно существование холодных землеподобных планет с аммиачными океанами (на картинке художественное изображение такой планеты). Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть сомнения, то углеродную жизнь в неводном растворителе представить гораздо легче.
Можно придумать и другие экзотические варианты — например, океан из плавиковой кислоты (HF) на планете, описанной в фантастической повести Ивана Ефремова “Сердце Змеи”. “Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…” Возвращаясь к земной биохимии, будем помнить, что она — не единственная теоретически возможная.
Источник