Поглощение оксида серы (VI)



Абсорбция оксида серы (VI) представляет собой обратимую экзотермическую реакцию и описывается уравнением:
В зависимости от соотношения количества оксида серы (VI) и воды может быть получен продукт различной концентрации:
при n > 1, олеум;
при n = 1, моногидрат (100%-ная серная кислота);
б) Применение 100%-ной серной кислоты или олеума приводит к снижению степени абсорбции.
Во-вторых, в связи с тем, что абсорбция оксида серы (VI) сопровождается большим количеством выделения теплоты для более полного поглощения оксида серы (VI) процесс ведут при:
а) охлаждении газа и абсорбента до 80ºС;
б) используют аппараты с большим абсорбционным объёмом;
в) процесс абсорбции ведут в две стадии.
Такие условия обеспечивают интенсивный отвод тепла.
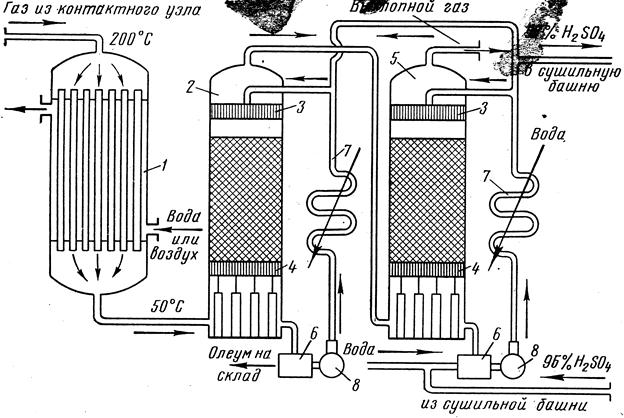
Технология процессаабсорбциипредставленана рисунке 3.8:
Для снижения температуры до 80 ºС контактный газ после последнего слоя катализатора охлаждается в теплообменнике, затем в воздушном холодильнике и только после этого он поступает в адсорбер.
Адсорберы представляют собой поглотительные насадочные башни, заполненные керамическими кольцами, которые орошаются серной кислотой, текущей сверху вниз противотоком к поднимающемуся контактному газу.
Первая поглотительная башня орошается 20%-ным олеумом, который подаётся в таком количестве, чтобы содержание в нём оксида серы (VI) при прохождении через башню повысилось на 0,5% — 1,5%.
В первую поглотительную башню помимо олеумапостоянно подаётся 98,5%-ная серная кислота, вытекающая из второй башни, чтобы предупредить повышение концентрации олеума выше 20%. Снижение концентрации олеума обусловлено тем, что содержащаяся в кислоте вода соединяется с оксидом серы (VI) олеума. Это и позволяет поддерживать концентрацию олеума на уровне 20%.
Продуктом этого процесса является 20%-ный олеум.
Вторая поглотительная башня орошается кислотой, с концентрацией 98,3% H2SO4. При этом кислоту подают в такомизбытке,чтобы её концентрация за один цикл взаимодействия с контактным газом повысилась в среднем лишь на 0,2% H2SO4,т. е. в качестве продукта образуется98,5%-ная серная кислота.
Рис. 3.8. Схема поглотительного отделения:1 — холодильник; 2 — олеумная поглотительная башня; 3 — желоба, распределяющие кислоту по насадке; 4 — колосниковая решётка, поддерживающая насадку; 5 — поглотительная башня с 98-процентной кислотой; 6 — сборник кислоты; 7 — оросительные холодильники; 8 — центробежные наносы.
После охлаждения в холодильниках, только небольшая часть кислоты поступает в виде продукции. Большая часть кислоты после добавки воды или слабой кислоты возвращается на абсорбцию.
3.6. Получение серной кислоты серы путём сжигания серы
В печном газе при сжигании серы отсутствуют пыль и каталитические яды, технологическая схема производства серной кислоты из серы не содержит отделения очистки газа, отличается простотой и получила название «короткой схемы».
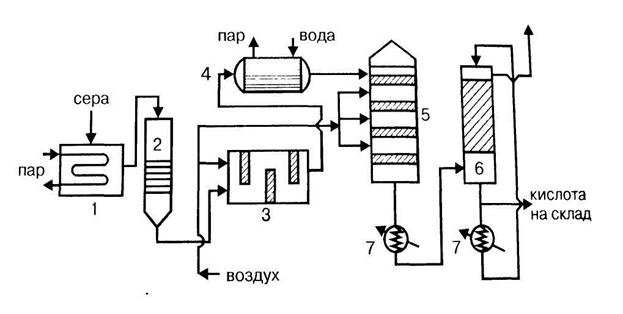
Принципиальная схемапроизводства серной кислоты из серы: плавление серы, сжигание серы в избыточном токе воздуха, охлаждение газа, контактирование, адсорбция триоксида серы (Рис. 3.9).
Лучшим сырьём для производства серной кислоты является природная сера, так как при её сжигании может быть получен газ с более высокой концентрацией, более чистый, не нуждающийся в специальной очистке, что имеет большое значение в контактном способе получения кислоты.

Рис. 3.9. Схема производств серной кислоты, сжиганием серы.1 — плавильная камера, 2 — фильтр жидкой серы, 3 — печь для сжигания серы, 4 — котел-утилизатор, 5 — контактный аппарат, 6 — система абсорбции SO3 , 7 — холодильники серной кислоты.
Технологический процесс производства серной кислоты из элементарной серы контактным способом, отличается от процесса производства из колчедана рядом особенностей.
К ним относятся:
1) особая конструкция печей для получения обжигового газа;
2) повышенное содержание оксида серы в обжиговом газе;
3) отсутствие стадии предварительной очистки обжигового газа.
Горение серы представляет собой гомогенную экзотермическую реакцию, которой предшествует процесс перехода серы в жидкое состояние и последующее испарение серы.
Таким образом, процесс горения протекает и газовой форме в потоке предварительно высушенного воздуха и описывается уравнением:
Перед подачей в печь серупредварительнорасплавляютпаром в плавильном котлеиотфильтровываютотпримесей. Так как температура плавления серы сравнительно низка, то путем отстаивания и последующей фильтрации от серы легко отделить механические примеси, не перешедшие в жидкую фазу, и получить исходное сырье достаточной степени чистоты.
Для сжигания чистой серы в настоящее время применяются циклонные печи(Рис. 3.11). Печь представляет собой стальной цилиндр диаметром 1,5 метра, выложенный огнеупорным кирпичом.
Воздух и сера подаются в печь тангенциально, т. е. по касательной, что приводит к образованию завихрений в обоих потоках. Это позволяет обеспечить исключительно сильное перемешивание паров серы с воздухом и интенсивность сгорания серы увеличивается.
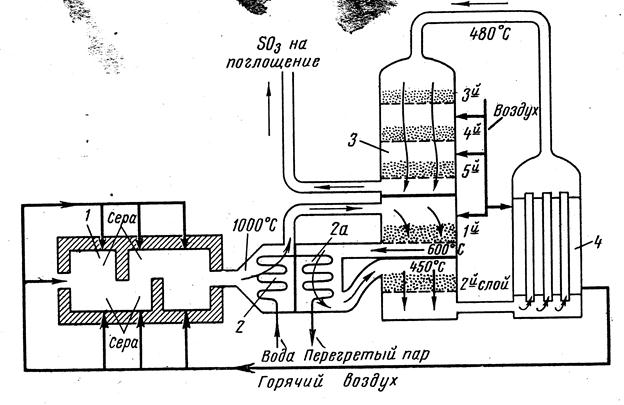
Рис. 3.10. Производство серной кислоты из серы по «короткой схеме»:1 — печь для сжигания серы; 2 — котёл-утилизатор с пароперегревателем (2а); 3 — пятислойный контактный аппарат; 4 — наружный теплообменник.
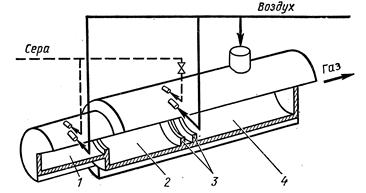 | Рис. 3.11. Циклонная печь для сжигания серы:1 — форкамера с форсункой для подачи серы и тангенциальным вводом воздуха; 2,4 — камеры сжигания; 3 — пережимные кольца для турбулизации воздуха |
Из печи обжиговый газ поступает в котел-утилизатор и далее в последующие аппараты. Концентрация диоксида серы в обжиговом газе зависит от соотношения серы и воздуха, которые подаются на сжигание. Как правило, воздух берут в избытке, так как в противном случае в печи будет слишком высокая температура. Обычно при сжигании серы получают обжиговый газ, содержащий до 16% SO2.
Производство серной кислоты из сероводорода стр. 176 Соколов т.1
Источник
Большая Энциклопедия Нефти и Газа
Поглощение — оксид — сера
Поглощение оксида серы ( VI) водой даже при наличии электрофильтра не приводит к получению достаточно концентрированной серной кислоты. Тем не менее работа по получению серной кислоты из серы или серного колчедана имеет большое практическое значение, так как в основном моделирует процессы, происходящие в промышленности при контактном способе производства серной кислоты. [1]
Поглощение оксида серы ( VI) должно осуществляться так, чтобы его потери с отходящими газами были наименьшими. Чистый оксид 5Оз хорошо соединяется с водой с выделением большого количества теплоты. Объясняется это тем, что пузырьки газов азота, кислорода и оксида серы ( VI), барботирующие через воду, насыщаются парами воды, с которыми SO3 дает серную кислоту в виде тумана. Аналогичное явление наблюдается, если пользоваться для поглощения разбавленной серной кислотой. [3]
Скорость поглощения оксида серы ( VI) повышается. Парциальное давление паров воды и S03 минимальное. Получается продукционная кислота большей концентрации. Не требует: я охлаждения продукционной серной кислоты. [4]
Почему для поглощения оксида серы ( VI) используется концентрированная серная кислота. [5]
Наиболее перспективны методы, основанные на поглощении оксида серы ( IV) известняком, раствором сульфита — гидросульфита аммония и щелочным раствором алюмината натрия. [6]
Для собирания ядовитых газов используют третий способ в. В колбу ( банку или цилиндр) вставляют пробку с двумя газоотводными трубками. Через одну, которая доходит почти до дна, впускают газ, конец другой опускают в стакан ( банку) с раствором, поглощающим газ. Так, например, для поглощения оксида серы ( IV) в стакан наливают раствор щелочи, а для поглощения хлороводорода — воду. После заполнения колбы ( банки) газом вынимают из нее пробку с газоотводными трубками и сосуд быстро закрывают пробкой или стеклянной пластинкой, а пробку с газоотводными трубками помещают в газопоглощающий раствор. [8]
Согласно принципиальной схеме аппаратуры Аэроника — SO2, изображенной на рис. 3.13, воздух после — поглощения SO2, пройдя через поглотитель 18, фильтр 19 и расходомер 20, улетучивается в атмосферу. Поглотитель 18 заполнен 10 % — м раствором едкого натра для поглощения йода, который уносится воздухом из поглотительного раствора. Фильтр 19, заполненный активированным углем марки АГ, улавливает возможные следы SO2 в отработанном газе. Газовая смесь из баллона поступает в сосуд с поглотительным раствором 16, где SO2 поглощается. Азот после поглощения оксида серы ( IV), пройдя через поглотитель 18, фильтр 19 и расходомер 20, попадает в атмосферу. Сосуд с поглотительным раствором 15 используется для предварительного задания расхода. Стойка аппаратуры помещена в кожух, выполненный в виде металлического каркаса и обшитый металлическими листами. На передней панели кожуха имеются раздвижные дверцы и окна для контроля за реометрами и температурой термостата. Пульт также выполнен в виде металлического каркаса с полками и обшит металлическими листами. [9]
Источник
Поглощение оксида серы водой
1) Запишите уравнение реакции, происходящей между раствором серной кислоты и амфотерным гидроксидом алюминия, в кратком ионном виде.
2) Как называется продукт, получаемый при поглощении оксида серы(VI) серной кислотой?
Прочитайте следующий текст и выполните задания 6—8.
Серная кислота (H2SO4) является одним из основных продуктов крупнотоннажной химии. Без неё невозможно производство удобрений, полимеров, лекарств, красителей. Ежегодно во всём мире производят примерно 220 млн тонн серной кислоты.
Разбавленная серная кислота обладает всеми общими свойствами кислот, реагирует с основаниями, основными и амфотерными оксидами, гидроксидами металлов, металлами и солями. Концентрированная серная кислота — сильное дегидратирующее средство, проявляет довольно сильные окислительные свойства и способна растворять некоторые малоактивные металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов («ряд напряжений металлов») после водорода.
В одном из способов получения серной кислоты первой стадией является обжиг пирита FeS2 в присутствии кислорода воздуха. Обжиг «в кипящем слое» ведут в печах специальной конструкции. Образовавшийся сернистый газ тщательно очищают и окисляют до оксида серы(VI), который поглощают концентрированной серной кислотой. Продукт поглощения после разбавления водой превращается в серную кислоту нужной концентрации.
1) В качестве примера дегидратирующего действия серной кислоты, отмеченного в тексте, приведите уравнение реакции, происходящей при действии концентрированной на муравьиную кислоту при нагревании.
2) Известно, что алюминий не взаимодействует с холодной концентрированной серной кислотой. Как называется это явление?
1.
Источник
Поглощение оксида серы водой
Репетитор по Химии и Биологии
Главная • Биология • Химия • Резюме • Цены • Контакты
Химия  | ||
Программа  | Конспекты  | Контрольные работы  |
Репетитор по Химии
Конспекты
На этой странице Вы можете найти конспект на тему «Производство серной кислоты» и оценить уровень подготовленного материала. Я надеюсь, что Вы, обращаясь ко мне за помощью, уже не будете покупать кота в мешке. Вы будете знать, что Вашего ребенка или Вас учит знающий свое дело специалист — репетитор по химии. Более подробную информацию обо мне Вы сможете прочитать здесь.
С уважением,
доктор биологических наук,
ведущий научный сотрудник НИИ акушерства и гинекологии им. Д.О.Отта
репетитор по химии и биологии
Соколов Дмитрий Игоревич
Производство серной кислоты .
Серную кислоту в промышленности производят двумя способами: контактным и нитрозным.
Контактный способ производства серной кислоты.
Серную кислоту контактным способом производят в больших количествах на сернокислотных заводах.
I. Сырьё, используемое для производства серной кислоты:
Самородная сера S
Пирит (серный колчедан) FeS2
Сульфиды цветных металлов ZnS , Cu2S
II. Подготовка сырья.
Разберём производство серной кислоты из пирита FeS2.
1) Измельчение пирита. Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ.
2) Очистка пирита. После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют .
III. Химизм производства.
Производство серной кислоты из пирита состоит из трёх стадий.
ПЕРВАЯ СТАДИЯ — обжиг пирита в печи для обжига в «кипящем слое».
Уравнение реакции первой стадии
4FeS2 + 11O2 
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в «подвешенном состоянии» из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом — сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется принцип химического производства — безотходность производства.
 |
Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка печного газа от твёрдых частичек огарка проводят в два этапа — в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
 |
Осушку печного газа проводят в сушильной башне — снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О 2 .
ВТОРАЯ СТАДИЯ — окисление SO2 в SO3 кислородом.
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO2 + O2 
Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3).
 |
Прямая реакция является экзотермической +Q, согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём химики-технологи установили, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO3 является температура 400-500°С. Это достаточно низкая температура в химических производствах. Для того , чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор. Экспериментальным путём установили, что наилучшим катализатором для этого процесса является оксид ванадия V2O5.
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO2 и 1V O2), а справа — 2V SO3. Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO3 из контактного аппарата. Попадая в контактный аппарат смесь SO2 и О 2 продолжает нагреваться до нужной температуры, проходя между трубками в контактном аппарате.
Температура 400-500 °С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO2 в SO3. Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO2 в SO3.
Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
ТРЕТЬЯ СТАДИЯ — поглощение SO3 серной кислотой.

А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2O 
Уравнение реакции этого процесса nSO3 + H2SO4 
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Нитрозный способ производства серной кислоты.
Технологическая схема производства серной кислоты контактным путём хорошо известна из школьных учебников. В нашей стране используется и другой, так называемый нитрозный, способ её получения.
На первой стадии, одинаковой для обоих методов, получают сернистый ангидрид SO 2 . Исходным сырьём может быть, в принципе, любое вещество, содержащее серу: природные сульфиды железа (прежде всего, пирит FeS 2 ), а также сульфиды меди и никеля, сульфидные полиметаллические руды, гипс CaSO 4 . 2 H 2 O и элементарные сера. Всё больше и больше используют газы, которые выделяются при переработке и сжигании горючих ископаемых (угля, нефти), содержащих соединения серы.
Полученный SO 2 окисляют до H 2 SO 4 , используется для этого в нитрозном методе используется окислы азота. С этой стадии оба метода отличаются друг от друга.
В специальной окислительной башне 3 смешивают окись азота NO и NO 2 с воздухом в таком соотношении, чтобы половина имеющихся NO и NO 2 .
В результате газовая смесь содержит равные NO и NO 2 . Она подаётся в башни 4 и 5, орошаемые 75% — ной серной кислотой; здесь смесь окислов азота поглощается с образованием нитрозиллерной кислоты:
Раствор нитрозиллерной кислоты в серной кислоте, называемый нитрозой, орошает башни 1 и 2, куда противотоком поступает SO 2 и добавляется вода. В результате гидролиза нитрозиллерной кислоты образуется азотная кислота:
Она — то и окисляет SO 2 по уравнению:
В нижней части башен 1 и 2 накапливается 75%-ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество её меряется с выхлопными газами, приходится добавлять в систему HNO 3 , служащую источником окислов азота.
Недостаток башенного метода состоит в том, что полученная серная кислота имеет концентрацию лишь 75% (при большей концентрации плохо идёт гидролиз нитрозиллерной кислоты). Концентрирование же серной кислоты упариванием представляет дополнительную трудность. Преимущество этого метода в том, что примеси содержащиеся в SO 2 , не влияют на ход процесса, так что исходный SO 2 достаточно очистить от пыли, т.е. механических загрязнений. Естественно, башенная серная кислота бывает недостаточно чистой, что ограничивает её применение.
Охрана окружающей среды,
связанная с производством серной кислоты.
Основным сырьем для производства серной кислоты, является сера. Она относится к числу наиболее распространенных числу химических элементов на нашей планете.
Производство серной кислоты происходит в три стадии на первой стадии получают SO 2 , путем обжига FeS 2 , затем SO 3 , после чего на третьей стадии получают серную кислоту.
Научно-техническая революция и связанный с ней интенсивный рост химического производства, вызывает существенные негативные изменения в окружающей среде. Например отравление пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В результате мир оказался в тисках экологического кризиса. Вредные выбросы сернокислых заводов следует оценивать не только по действию содержащегося в них оксида серы на расположенные вблизи предприятия зоны, но и учитывать другие факторы — увеличение количества случаев респираторных заболеваний человека и животных, гибель растительности и подавление ее роста, разрушение конструкций из известняка и мрамора, повышение коррозионного износа металлов. По вине “кислых” дождей повреждены памятники архитектуры ( Тадж-Макал ).
В зоне до 300 км от источника загрязнения ( SO 2 ) опасность представляет серная кислота, в зоне до 600 км . — с ульфаты. Серная кислота и сульфаты замедляют рост с/ х культур. Закисление водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб. Помимо экологического ущерба налицо экономический ущерб — громадные суммы каждый год теряются при раскисление почв.
Рассмотрим химические метода отчистки от наиболее распространенных газообразных загрязняющих воздух веществ. Известно более 60 методов. Наиболее перспективны методы, основанные на поглощение оксида серы известняком, раствором сульфита — гидросульфита аммония и щелочным раствором алюмината натрия. Интерес также представляют каталитические методы окисления оксида серы в присутствии оксида ванадия.
Особое значение имеет очистка газов от фторсодержащих примесей, которые даже в незначительной концентрации вредно влияют на растительность. Если в газах содержится фтороводород и фтор, то их пропускают через колоны с насадкой противотоком по отношению к 5-10% раствору гидроксида натрия. В течени и одной минуты протекают следующие реакции:
Образующийся фторид натрия обрабатывают для регенерации гидроксида натрия:
Источник