- Практ. 1
- Практическая работа № 2 Получение этилена и изучение его свойств.
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Современные образовательные технологии в преподавании химии с учетом ФГОС
- Оставьте свой комментарий
- Подарочные сертификаты
- Опыты по химии. Непредельные углеводороды
Практ. 1
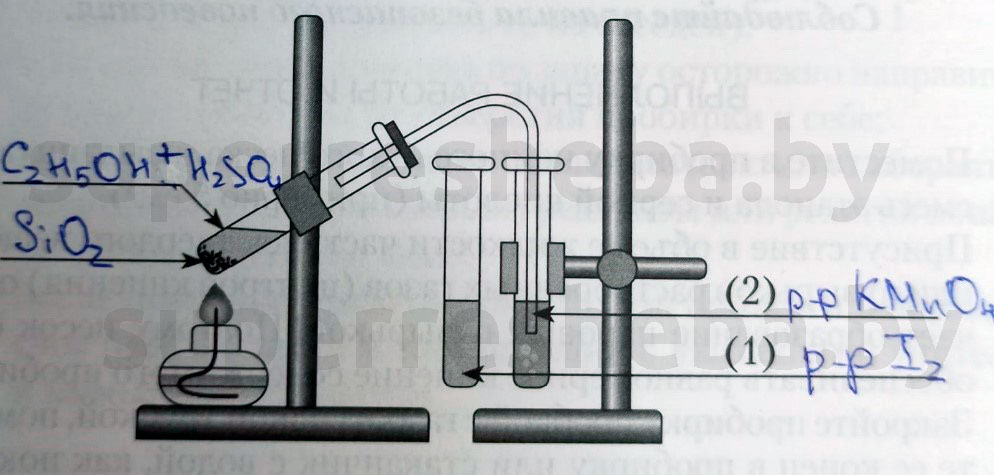
Напишите над стрелками формулы или названия веществ в пробирках.
Объясните явления, которые наблюдаются в процессе получения этилена.
В процессе получения мы наблюдали появление пузырьков газа и обесцвечивание растворов иода и перманганата калия. (Причины обесцвечивания приведены далее).
Приведите уравнение реакции получения этилена.
+ ° C 2 H 4 ↑ + H 2 O .
Объясните явления, наблюдаемые при пропускании этилена в пробирки с растворами иода (1) и перманганата калия (2).
В процессе получения этилена мы наблюдали обесцвечивание растворов иода и перманганата калия, потому что образовывались бесцветные продукты реакции. Раствор перманганата обесцвечивался, т.к. в ходе реакции перманганат переходил в щелочь и оксид марганца (IV), а раствора иода – потому что молекулы иода встраивались в молекулу этилена.
Приведите уравнения реакции этилена с раствором иода.
Приведите схему реакции этилена с раствором K M n O 4 \mathrm
Приведите уравнение реакции горения этилена.
1. Напишите, благодаря наличию какого структурного фрагмента в молекулах алкенов они вступают в реакции с иодной и бромной водой. К какому типу относятся данные реакции?
Алкены вступают в реакции с иодной и бромной водой благодаря наличию двойной связи. Эти реакции относятся к реакциям присоединения.
2. В каких условиях реагируют с бромом алканы? К какому типу относится реакция алканов с бромом?
Алканы реагируют с бромом на свету. Это реакция замещения.
3. Сравните отношение к бромной воде алканов и алкенов. Можно ли различить этан и этен при помощи бромной воды?
Да, можно. При пропускании этана через бромную воду раствор брома не будет обесцвечиваться, а при пропускании этена — будет.
Источник
Практическая работа № 2 Получение этилена и изучение его свойств.
Нечаев Дмитрий Валерьевич, учитель химии
ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ»
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
В пробирке начинается выделяться газ — этилен.
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
В третью пробирку налили 2-3 мл разбавленного раствора KMnO 4 , поодкисленного серной кислотой, и пропустили через него газ.
При пропускании газа через подкисленный раствор KMnO4 , происходит обесцвечивание раствора KMnO 4 .
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D (возд.) = Mr ( алкена)/Mr (воздуха);
Mr ( алкена) = D (возд.)* Mr (воздуха);
Mr ( алкена) = 1,45*29 = 42.
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D (Н2) = Mr ( алкена)/Mr (Н 2 );
Mr ( алкена) = 14*2 = 28.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
Номер материала: ДБ-1175165
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
В России объявлены нерабочие дни с 30 октября по 7 ноября
Время чтения: 2 минуты
У ямальских школьников на уроках начнут забирать телефоны
Время чтения: 1 минута
Рособрнадзор оставил за регионами решение о дополнительных школьных каникулах
Время чтения: 1 минута
В школе в Пермском крае произошла стрельба
Время чтения: 1 минута
Названы лучшие по качеству проведения ЕГЭ регионы России
Время чтения: 1 минута
Рособрнадзор планирует вернуть обязательную сдачу ЕГЭ по базовой математике
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник
Опыты по химии. Непредельные углеводороды
Постановка опытов и текст – к.п.н. Павел Беспалов.
Взаимодействие ацетилена с хлором
В цилиндр насыпаем небольшое количество кристаллов перманганата калия и бросаем кусочек карбида кальция. Затем приливаем в цилиндр соляную кислоту. В сосуде наблюдаются вспышки, стенки цилиндра покрываются сажей. При взаимодействии соляной кислоты с перманганатом калия выделяется газ хлор
16 HCI + 2KMnO4 = 5CI2 + 2 KCI + 2 MnCI2 + 8H2O
С соляной кислотой карбид кальция дает ацетилен
СаС2 + 2 HCI = С2Н2 + СаCI2
Хлор с ацетиленом взаимодействуют, образуя хлороводород и уголь
С2Н2 + CI2 = 2С + 2 НCI
Оборудование: цилиндр, шпатель.
Техника безопасности. Соблюдать правила работы с горючими газами. Опыт проводить только под тягой. После проведения опыта цилиндр залить водой.
Взаимодействие этилена с бромной водой
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Выделяющийся этилен пропустим через раствор брома в воде, который называют бромной водой. Бромная вода очень быстро обесцвечивается. Бром присоединяется к этилену по месту двойной связи. При этом образуется 1,2-дибромэтан.
СН2=СН2 + Br2 = CH2Br — CH2Br
Реакция обесцвечивания водного раствора брома служит качественной реакцией на непредельность органических соединений.
Оборудование: колба Вюрца, капельная воронка, промывалка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Взаимодействие ацетилена с бромной водой
Ацетилен получаем действием воды на карбид кальция. Пропустим выделяющийся ацетилен через бромную воду. Наблюдаем обесцвечивание бромной воды. Бром присоединяется к ацетилену по месту тройной связи. При этом образуется соединение с четырьмя атомами брома в молекуле — 1,1,2,2-тетрабромэтан.
СН ≡ СН + 2Br2 = CHBr2 — CHBr2
Обесцвечивание бромной воды доказывает непредельность ацетилена.
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила работы с горючими газами.
Взаимодействие ацетилена с раствором перманганата калия
Ацетилен получаем действием воды на карбид кальция. При пропускании ацетилена через подкисленный раствор перманганата калия наблюдаем быстрое обесцвечивание раствора. Происходит окисление ацетилена по месту разрыва тройной связи с образованием продукта окисления – щавелевой кислоты. В избытке перманганата калия щавелевая кислота окисляется до углекислого газа и воды.
Обесцвечивание раствора перманганата калия служит доказательством непредельности ацетилена.
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами.
Взаимодействие этилена с раствором перманганата калия.
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Опустим газоотводную трубку с выделяющимся этиленом в подкисленный раствор перманганата калия. Раствор быстро обесцвечивается. При этом этилен окисляется в двухатомный спирт этиленгликоль.
СН2=СН2 + [О] + Н-ОН = CH2ОН — CH2ОН
Эта реакция является качественной реакцией на двойную связь.
Оборудование: колба Вюрца, капельная воронка, промывалка, газоотводная трубка, стакан или пробирка, штатив.
Техника безопасности.
Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Взрыв смеси ацетилена с кислородом
Смесь ацетилена с кислородом при поджигании взрывается с большой силой. Поэтому безопасно экспериментировать только небольшими объемами смеси — в этом нам поможет раствор мыла. В фарфоровую ступку с водой и раствором мыла добавим немного пероксида водорода. К полученному раствору прибавим катализатор — диоксид марганца. Сразу же начинается выделение кислорода.
В эту смесь опустим небольшой кусочек карбида кальция. При взаимодействии с водой он дает ацетилен.
На поверхности раствора, благодаря присутствию мыла, образуются пузыри, заполненные смесью ацетилена с кислородом. При поджигании пузырей происходят сильные взрывы смеси ацетилена с кислородом.
Оборудование: фарфоровая ступка, лучина.
Техника безопасности. Соблюдать правила работы с горючими газами. Поджигать можно только небольшой объем смеси.
Горение ацетилена
Получим ацетилен из карбида кальция и воды. Закроем колбу пробкой с газоотводной трубкой. В конец газоотводной трубки вставлена игла для инъекций. Через некоторое время, когда ацетилен полностью вытеснит воздух из колбы, подожжем выделяющейся газ. Ацетилен горит белым ярким пламенем. При горении ацетилена образуется углекислый газ и вода.
Внесем пробирку в пламя горящего ацетилена. На пробирке оседает сажа. При недостатке кислорода ацетилен не успевает полностью сгорать и выделяет углерод в виде сажи. Светимость пламени объясняется большим процентным содержанием углерода в ацетилене и высокой температурой его пламени, в котором раскаляются несгоревшие частицы углерода.
Оборудование: круглодонная колба, пробка с иглой от медицинского шприца, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами. Поджигать ацетилен можно только после отбора пробы на чистоту.
Горение этилена
Получаем этилен нагреванием смеси этилового спирта с концентрированной серной кислотой. Смесь готовят из одной части спирта и трех частей серной кислоты. Серная кислота играет роль водоотнимающего средства. При нагревании смеси выделяется этилен.
Собираем этилен в цилиндр способом вытеснения воды. Этилен – бесцветный газ, малорастворимый в воде. Этилен сгорает на воздухе с образованием углекислого газа и воды.
Оборудование: колба Вюрца, делительная воронка, промывалка, газоотводная трубка, штатив, цилиндр.
Техника безопасности. Соблюдать правила работы с горючими газами, концентрированными кислотами и огнеопасными жидкостями.
Получение ацетиленида меди
Ацетилен получаем действием воды на карбид кальция. Атомы водорода в молекуле ацетилена обладают большой подвижностью. Поэтому они легко могут быть замещены металлами. Пропустим через аммиачный раствор хлорида меди (I) ацетилен. Выпадает красный осадок ацетиленида меди (I) .
СН ≡ СН + 2CuCI → CuC ≡ CCu ↓ + 2HCI
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, полипропиленовая воронка, фильтровальная бумага, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами. Получать только небольшие количества ацетиленида меди. Высушеный ацетиленид меди — очень опасное взрывчатое вещество. Его уничтожают обработкой концентрированной соляной кислотой.
Получение ацетиленида серебра
Ацетилен получаем действием воды на карбид кальция. Атомы водорода в молекуле ацетилена обладают большой подвижностью. Поэтому они легко могут быть замещены металлами. Пропустим через аммиачный раствор оксида серебра ацетилен. Выпадает осадок ацетиленида серебра.
СН ≡ СН + Аg2O → AgC ≡ CAg ↓ + H2O
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, полипропиленовая воронка, фильтровальная бумага, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами. Получать только небольшие количества ацетиленида серебра. Высушенный ацетиленид серебра — очень опасное взрывчатое вещество. Его уничтожают обработкой концентрированной соляной кислотой.
Непрочность ацетиленидов металлов
Ацетилениды металлов — неустойчивые соединения. Во влажном состоянии ацетиленид серебра устойчив, высушенный он легко взрывается. Поднесем к сухому ацетилениду серебра тлеющую лучинку — он взрывается. Проведем аналогичный эксперимент с ацетиленидом меди (I). Так же как и ацетиленид серебра, ацетиленид меди (I) во влажном состоянии устойчив, но легко разлагается, если его высушить. Горящая лучинка, поднесенная к сухому ацетилениду меди (I), приводит к взрыву. При этом появляется пламя, окрашенное в зеленый цвет.
Оборудование: огнезащитная прокладка, лучина.
Техника безопасности. Получать и разлагать можно только небольшие количества ацетиленида серебра и меди. Высушеные ацетилениды серебра и меди — опасные взрывчатые вещества. Ацетилениды уничтожают обработкой концентрированной соляной кислотой.
Источник