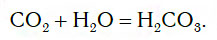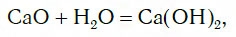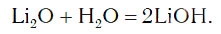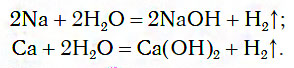- Урок 28. Химические свойства воды
- Взаимодействие с оксидами неметаллов
- Взаимодействие с оксидами металлов
- Взаимодействие с металлами
- Решите контрольную по химии пожалуйста
- Все химические реакции, которые необходимы для успешной сдачи ОГЭ
- Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
- Правило 1.2. Взаимодействие оксидов с водой
- Химические свойства воды
- Химические свойства воды
- Вода: строение и свойства
- Физические свойства
- Химические свойства
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
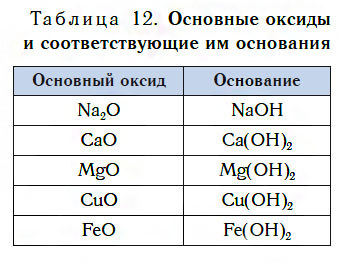
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Решите контрольную по химии пожалуйста
1.При обычных условиях вода может реагировать с каждым веществом пары
1)оксид серы (6),оксид меди
2)оксид железа (2),кальций
3)натрий, оксид кальция
4)кальций, оксид кальция
2.Сумма коэффициентов уравнения реакции полной нейтрализации, одним из продуктов которой будет хлорид железа (3), равна
1)8
2)6
3)4
4)10
3.Укажите вещества обозначающие X,Y,Z на схеме:
Feo—(+X)—Fe—(+Y)—FeCL2—(+Z)—Fe(OH)2
1)X—H2O, Y—HCL—, Z—H2O
2)X—H2, Y—HCL, Z—H2O
3)X—H2, Y—KCL, Z—KOH
4)X—H2, Y—HCL, Z—KOH
4.Соляная кислота будет взаимодействовать со всеми веществами группы
1)оксид магния, оксид цинка, оксид серы
2)серебро, оксид железа (3),гидроксид меди (2)
3)железо, магний, цинк
4)оксид железа (3),медь, оксид фосфора (5)
5.Сумма коэффициентов в уравнении реакции избытка гидроксида калия и оксида углерода (6) равна
1)4
2)5
3)6
4)8
6.Группа веществ, между которыми может протекать не менее двух химических реакций, записана под номером
1)углерод, медь, соляная кислота
2)оксид углерода (4),гидроксид натрия, соляная кислота
3)гидроксид натрия, гидроксид калия, оксид магния
4)гидроксид натрия, соляная кислота, медь
7.Среди реакций:
1)Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2)Cu(OH)2 = CuO + H2O
3)2Cu + O2 = 2CuO
4)CuCl2 + Fe = FeCl2 + Cu
реакции соединения, замещения, разложения и обмена соответственно
1)3,4,2,1
2)1,3,2,4
3)3,2,1,4
4)4,3,2,1
8.С какими веществами взаимодействует разбавленная серная кислота?
1)CaCO3
2)Ca(OH)2
3)HCl
4)FeO
5)FeCl2
6)Cu
9.Установите соответствие между левой и правой частью уравнения реакции. Ответ укажите в виде набора букв и цифр, Например А1, Б1
1)Fe2O3 + 6HCl = A.FeCl3 + 3H2O
2)Fe(OH)3 + 3HCl = Б. 2FeCl3 + 3H2O
3)Fe + 2HCl = B.FeCl2 + H2
10.Распределите на группы — (А) основные оксиды. (Б) кислотные оксиды, (В) амфотерные оксиды — вещества, формулы которых приведены. Ответ укажите в виде набора букв и цифр, например A135, Б246
1)CaO
2)BeO
3)CO2
4)N2O5
5)CuO
6)MgO
7)ZnO
8)P2O5
9)Al2O3
1.При обычных условиях вода может реагировать с каждым веществом пары
3)натрий, оксид кальция
4)кальций, оксид кальция
2.Сумма коэффициентов уравнения реакции полной нейтрализации, одним из продуктов которой будет хлорид железа (3), равна
1)8
3.Укажите вещества обозначающие X,Y,Z на схеме:
Feo—(+X)—Fe—(+Y)—FeCL2—(+Z)—Fe(OH)2
4)X—H2, Y—HCL, Z—KOH
4.Соляная кислота будет взаимодействовать со всеми веществами группы
3)железо, магний, цинк
5.Сумма коэффициентов в уравнении реакции избытка гидроксида калия и оксида углерода (4) равна
1)4
6.Группа веществ, между которыми может протекать не менее двух химических реакций, записана под номером
2)оксид углерода (4),гидроксид натрия, соляная кислота
7.Среди реакций:
1)Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2)Cu(OH)2 = CuO + H2O
3)2Cu + O2 = 2CuO
4)CuCl2 + Fe = FeCl2 + Cu
реакции соединения, замещения, разложения и обмена соответственно
1)3,4,2,1
8.С какими веществами взаимодействует разбавленная серная кислота?
1)CaCO3
2)Ca(OH)2
4)FeO
Источник
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
SiO2 + H2O → реакция не идет.
Источник
Химические свойства воды
Вода окружает нас повсюду, без неё человек не может жить. Мы на каждом шагу встречаемся с собственно водой и с водными растворами (например, морской водой или даже водопроводной). А может ли вода вступать в химические реакции и в каких случаях это происходит? Сейчас мы это и узнаем.
Химические свойства воды
1. Вода при высокой температуре или пропускании тока разлагается на газообразные водород кислород:
2. Вода взаимодействует с активными металлами с образованием гидроксидов и газообразного водорода. К активным металлам относятся металлы первой и второй групп таблицы Менделеева. С щелочными металлами (металлы первой группы) реакции идут довольно активно, поскольку газообразный водород выделяется бурно, поэтому проводить их нужно очень аккуратно. Уравнение реакции между щелочным металлом калием и водой выглядит так:
2К + 2Н2О = 2КОН + Н2
Аналогично протекают и реакции между щелочно-земельными металлами (металлами второй группы) и водой.
3. Вода взаимодействует с менее активными металлами с образованием оксидов и газообразного водорода. Например, цинк при взаимодействии с водой даёт оксид цинка и водород:
Zn + O2 = ZnO + H2
С инертными металлами (в ряду напряжений они стоят после водорода) вода не взаимодействует.
4. Вода взаимодействует с основными оксидами с образованием гидроксидов :
МgO + H2O = Mg(OH)2
5. Вода взаимодействует с кислотными оксидами с образованием кислот:
SO3 + H2O = H2SO4
А ещё воды является чуть ли не главным растворителем. В ней растворяются и газы, и жидкости и твёрдые вещества, причём в зависимости от условий можно получать самые разные растворы. С образованием растворов связано понятие массовой доли растворённого вещества . Понимать, как рассчитывать массовую долю растворённого вещества, очень важно, поскольку в неорганической химии много задач связано именно с этим.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Вода: строение и свойства
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Источник