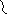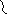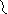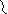- Почему при окислении 100 граммов жира образуется 107 мл воды?
- 3. Катаболизм жиров.
- Почему при окислении 100 граммов жира образуется 107 мл воды?
- Номенклатура жиров
- Физические свойства жиров
- Химические свойства жиров
- 1.1. Кислотный гидролиз
- 1.2. Щелочной гидролиз — омыление жиров
- 2. Гидрирование (гидрогенизация) ненасыщенных жиров
- 3. Мыло и синтетические моющие средства
Почему при окислении 100 граммов жира образуется 107 мл воды?
Почему при окислении 100 граммов жира образуется 107 мл воды?
Ты наверное под фразой «при окислении» имел в виду «при сжигании или при полном окислении», так как могут быть процессы частичного окисления жиров, в частности — ненасыщенных, при которых вообще не образуется вода. Так, что будем считать, что речь идет о сжигании (полном окислении) .
Жиры представляют собой полные сложные эфиры глицерина, с общей формулой:
R-C(=O)-O-CH2-CH(-O-C(=O)-R’)-CH2-O-C(=O)-R», где R, R’ и R» различные (или одинаковые) алкильные (или в той или иной степени ненасыщенные) группы.
Рассмотрим тристеарат глицерина (т. е R=R’=R»=C17H35). Полная формула С57Н110О6, молярная масса 890 г.
При полном сгорании 1 моля образуется 55 молей (990 г) воды. Значит, при сгорании 100 г образуется 990/8,9=111,236 г воды. Если же взять ненасыщенный жир, например триолеат глицерина (т. е R=R’=R»=C17H33), то при полном сгорании 1 моля (884 г) жира образуется 52 моля (936 г) воды, тогда, выход воды на 100 г жира будет 105,882 г. Для любого другого «жира» можешь посчитать сам, например, для трилинолената (эфира линоленовой кислоты) эта величина будет всего лишь 94,954 г.
Далее, если массу полученной воды разделить на плотность воды (а 1000 кг/м^3 или 1000 г/л или 1 г/мл она равна только при температуре +4 градуса Цельсия, а при любых других температурах она несколько меньше) , то получишь объем в мл. Естественно для каждого вида жира она будет различной, и приведенная тобой величина 107 мл не является абсолютной и относится к какому-то конкретному жиру.
Источник
3. Катаболизм жиров.
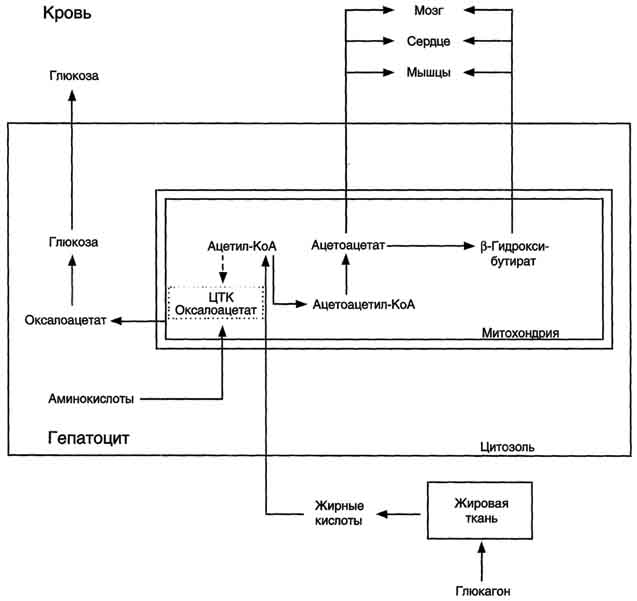
Использование жира в качестве источника энергии начинается с его выхода из жировых депо в кровяное русло. Этот процесс называется мобилизация жира. Мобилизация жира ускоряется под действием симпатической нервной системы и гормона адреналина.
В печени происходит гидролиз жира до глицерина и жирных кислот.
Глицеринлегко переходит вфосфоглицериновый альдегид. Это вещество является также промежуточным продуктом углеводов и поэтому легко вовлекается в углеводный обмен.
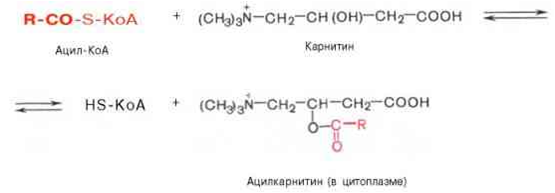
Жирные кислоты соединяются скоферментом А и образуют соединениеацилкофермент А (ацил-КоА)
R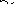
Жирная ‒ АМФ Ацилкофермент А
Образовавшийся комплекс жирная кислота + кофермент А – называется ацилкофермент А.
эти процессы происходят в цитоплазме. Далее ацил-КоА передает жирную кислоту корнетину. Корнетин переносит жирную кислоту внутрь митохондрии и вновь отдает ее коферменту А, но в этот раз митохондриальному.
Транспорт жирных кислот внутрь митохондрий.
В митохондриях окисление жирных кислот проходит в два этапа.
Первый этап – β-окисление. Окислению подвергается углеродный атом жирной кислоты, находящийся в положении «бета». От жирной кислоты, связанной с КоА, дважды отщепляется по два атома водорода, которые затем по дыхательной цепи передаются на молекулярный кислород. В итоге образуется вода и образуется пять молекул АТФ. Этот процесс повторяется многократно, пока жирная кислота полностью не превратится вацетил-КоА.
C
C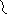
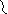
SKoA SKoA SKoA SKoA жирная
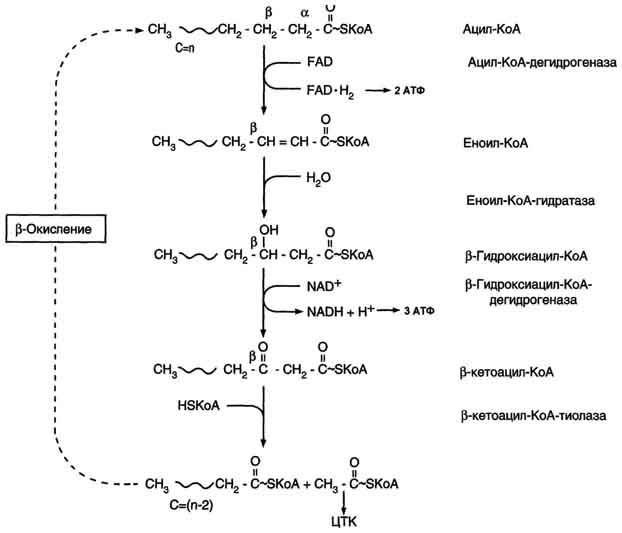
Второй этап окисления – цикл трикарбоновых кислот, в котором происходит дальнейшее окисление остатка уксусной кислоты, входящей в ацетилкофермент А, до углекислого газа и воды. При окислении одной молекулы ацетилкофермента А выделяется до 12 молекул АТФ. Таким образом, окисление жирных кислот до углекислого газа и воды дает большое количество энергии. Например, из одной молекулыпальмитиновой кислоты(С15 Н31СООН) образуется 130 молекул АТФ.
Окисление жирных кислот.
Однако, в силу особенностей строения жирных кислот (слишком много атомов углерода по сравнению с кислородом) их окисление существенно затруднено по сравнению с углеводами. Поэтому жир обеспечивает организм энергией при работе средней мощности, но зато продолжительной. Отсюда вывод, чтобы сжигать жир нужно осуществлять работу средней мощности, но продолжительную.
При продолжительных физических нагрузках и избыточном образовании ацетилкофермента А, происходит реакция конденсации уксусной кислоты с образованием кетоновых тел. В мышцах, почках и миокарде эти тела вновь переходят в ацетилкофермент А.Таким образом кетоновые тела играют важную роль при длительных спортивных тренировках. Однако при перетренировке они могут образовывать в крови ацетон, который выделяется с потом, мочой и выдыхаемым воздухом.
Источник
Почему при окислении 100 граммов жира образуется 107 мл воды?
Ты наверное под фразой «при окислении» имел в виду «при сжигании или при полном окислении», так как могут быть процессы частичного окисления жиров, в частности — ненасыщенных, при которых вообще не образуется вода. Так, что будем считать, что речь идет о сжигании (полном окислении) .
Жиры представляют собой полные сложные эфиры глицерина, с общей формулой:
R-C(=O)-O-CH2-CH(-O-C(=O)-R’)-CH2-O-C(=O)-R», где R, R’ и R» различные (или одинаковые) алкильные (или в той или иной степени ненасыщенные) группы.
Рассмотрим тристеарат глицерина (т. е R=R’=R»=C17H35). Полная формула С57Н110О6, молярная масса 890 г.
При полном сгорании 1 моля образуется 55 молей (990 г) воды. Значит, при сгорании 100 г образуется 990/8,9=111,236 г воды. Если же взять ненасыщенный жир, например триолеат глицерина (т. е R=R’=R»=C17H33), то при полном сгорании 1 моля (884 г) жира образуется 52 моля (936 г) воды, тогда, выход воды на 100 г жира будет 105,882 г. Для любого другого «жира» можешь посчитать сам, например, для трилинолената (эфира линоленовой кислоты) эта величина будет всего лишь 94,954 г.
Далее, если массу полученной воды разделить на плотность воды (а 1000 кг/м^3 или 1000 г/л или 1 г/мл она равна только при температуре +4 градуса Цельсия, а при любых других температурах она несколько меньше) , то получишь объем в мл. Естественно для каждого вида жира она будет различной, и приведенная тобой величина 107 мл не является абсолютной и относится к какому-то конкретному жиру.
Источник
Номенклатура жиров
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:
Физические свойства жиров
Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
Химические свойства жиров
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин |
1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия . |
2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
| Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина: |
| Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира. |
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca 2+ и Mg 2+ дают с высшими кислотами нерастворимые в воде соли.
| Например, тристеарат глицерина взаимодействует с сульфатом кальция |
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата .
Далее алкилсульфат гидролизуется щелочью:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Источник