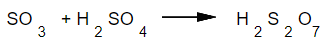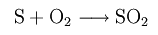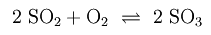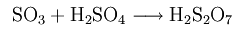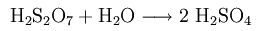Большая Энциклопедия Нефти и Газа
Разбавление — концентрированная серная кислота
При разбавлении концентрированной серной кислоты , при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением теплоты, можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой. [16]
При разбавлении концентрированной серной кислоты водой ( холодной) нужно приливать кислоту к воде тонкой струей при постоянном помешивании. [17]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты. [18]
При разбавлении концентрированной серной кислоты водой следует постепенно вливать кислоту в холодную воду, постоянно помешивая. [19]
При неосторожном разбавлении концентрированной серной кислоты она может легко разбрызгиваться. [20]
Запомните твердо правило разбавления концентрированной серной кислоты : нужно кислоту медленной струей приливать к воде, а не воду к кислоте. [21]
Именно поэтому при разбавлении концентрированной серной кислоты нужно приливать небольшими порциями кислоту к воде, но ни в коем случае не наоборот. [22]
Твердо выполнять указанное выше правило разбавления водой концентрированной серной кислоты , а также олеума. [23]
Чем объяснить, что при разбавлении концентрированной серной кислоты водой сразу же уменьшается электропроводность раствора. Чем объяснить, что при разбавлении концентрированной серной кислоты водой электропроводность раствора вначале повышается, потом понижается. В каком вопросе допущена ошибка. [24]
Следует помнить, что при разбавлении концентрированной серной кислоты водой выделяется большое количество тепла. [25]
В следсгвие выделения большого количества тепла при разбавлении концентрированной серной кислоты водой и разложении нефелина серной кислотой температура массы поднимается до 105 С и жидкая — масса — кипит. [26]
По мере перемешивания отходов происходит непрерывная противоточная промывка их горячей водой, поступающей через штуцер 17 и служащей в дальнейшем для разбавления концентрированной серной кислоты , вводимой через штуцер 12, до процентного содержания, оптимального для данного процесса. [28]
Работая с концентрированной серной кислотой, необходимо помнить, что разбавление ее водой протекает чрезвычайно бурно и в некоторых случаях может сопровождаться разбрызгиванием или даже выбросом жидкости. Поэтому разбавление концентрированной серной кислоты производят путем постепенного добавления кислоты к воде, а ни в коем случае не наоборот. Надо также иметь в виду, что при случайном попадании воды или небольших кусочков льда в реакционную смесь, содержащую концентрированную серную или хлорсульфонововую кислоту, реакция может выйти из-под контроля и произойдет выброс реакционной массы. [29]
Работая с концентрированной серной кислотой, необходимо помнить, что разбавление ее водой протекает чрезвычайно бурно и в некоторых случаях может сопровождаться разбрызгиванием или даже выбросом жидкости. Поэтому разбавление концентрированной серной кислоты производят путем постепенного добавления кислоты к воде, а ни в коем случае не наоборот. Надо также иметь в виду, что при случайном попадании воды или небольших кусочков льда в реакционную смесь, содержащую концентрированную серную или хлорсульфонововую кислоту, реакция может выйти. [30]
Источник
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной и азотной кислотами. Кислоты имеются в продаже в виде концентрированных растворов, процентное содержание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу. Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11%’ хлористого водорода.
Разбавление кислоты проводят по расчету, описайному выше.
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3. По справочнику узнаем, что 5%,-ный раствор нмеет плотность 1,024 г/см3; следовательно, 1 л ее будет весить 1,024*1000 = 1024 г. В этом количестве должно содержаться чистого хлористого водорода:

Кислота с плотностью 1,19 г/см3 содержит 37,23% HCl (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:

или 137,5/1,19 = 115,5 кислоты с плотностью 1,19 г/см3, Отмерив 116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислотук воде
, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SO3. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и SO3 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавлива-ния при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твердые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
Точные растворы. Точные растворы кислот готовят так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точно, по расчету, разбавить. Для точных растворов берут только химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.
Пример. Нужно приготовить 0,1 и. раствор H2SO4. Это значит, что в I л раствора должно содержаться:

Кислота с плотностью 1,84 г\смг содержит 95,6% H2SO4 н для приготовления 1 л 0,1 н. раствора нужно взять следующее количество (х) ее (в г):

Соответствующий объем кислоты составит:

Отмерив из бюретки точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи п устанавливают нормальность полученного раствора. Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора H2SO4 содержит не 0,0049 г H2SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:

Расчет показывает, что этот объем равен 1041 мл раствор нужно добавить 1041 — 1000 = 41 мл воды. Следует еще учесть то количество раствора, которое взято для титрования. Пусть взято 20 мл, что составляет 20/1000 = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41 — (41*0,02) = = 41 —0,8 = 40,2 мл.
* Для отмеривания кислоты пользуются тщательно высушенной бюреткой с притертым краном. .
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения. Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах, В пробку сосуда обязательно нужно вставлять хлоркальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2COs. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCO3, высушенным в эксикаторе над CaCl2.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу, и стандартных растворов, кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.
Источник
Серная кислота
Серная кислота представляет собой бесцветную вязкую жидкость. Относится к минеральным кислотам и к 20 наиболее важным химическим веществам современной химической промышленности. Представляет собой маслянистую, бесцветную, очень агрессивную жидкость.
Описание
Серная кислота с эмпирической формулой H2SO4 является сильной неорганической кислотой.
Концентрированная серная кислота является мощным окислителем и обладает гигроскопическим эффектом и поэтому может использоваться для сушки газов и жидкостей.
100% (чистую) серную кислоту готовят путем введения триоксида серы до тех пор, пока кислота не станет безводной. Серная кислота может связывать триоксид серы в больших количествах, а получающаяся жидкость называется олеумом (раствор серного ангидрида в 100% серной кислоте), из-за своей высокой вязкости. Олеум состоит из смеси серной и полисерной кислот (H2S2O7, H2S3O10 и т.д.).
Разбавление концентрированной серной кислоты водой приводит к моментальному выделению тепла. При разбавлении необходимо вводить в воду кислоту тонкой струйкой, а не наоборот (НЕЛЬЗЯ ЛИТЬ ВОДУ В КОНЦЕНТРИРОВАННУЮ СЕРНУЮ КИСЛОТУ)! Иначе это может привести к взрывному испарению воды и неконтролируемому разбрызгиванию жидкости.
При растворении перманганата калия в серной кислоте образуется темно-зеленая маслянистая жидкость (димангангептоксид), которая является мощным окислителем. В ней моментально обугливаются органические вещества, такие как древесина, а при добавлении ацетона или другого воспламеняющегося вещества происходит самовоспламенение.
Свойства
При растворении в воде вызывает бурную реакцию с генерированием большого количество тепла, действуя как абсорбент. И хотя не является легковоспламеняющимся соединением, но может генерировать кислород для сжигания других материалов.
Взрывается при контакте с пара-нитротолуолом и перманганатом калия. Это соединение очень опасно соединять с бромистыми карбидами, хлоратами и металлическими порошками.
При смешивании его с хлорной кислотой, получается соляная кислота.
Взаимодействие с металлами
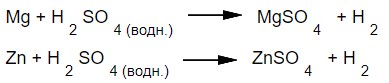
Разбавленная серная кислота реагирует с основными металлами с образованием водорода и соответствующих солей металлов. В итоге получаются сульфаты (соли серной кислоты):
Разбавленная серная кислота не реагирует с медью. Только концентрированная (безводная) реагирует с металлом, но не с выделением водорода, а с образованием сульфата меди, диоксида серы и воды:
Драгоценные металлы золото и платина, а также железо и свинец не подвергаются воздействию концентрированной серной кислоты.
Чистая, 100% серная кислота растворяет газообразный триоксид серы SO3 с образованием дисульфокислоты:
Производство
Производство серной кислоты алхимиками предположительно восходит к 13 веку. С использованием сульфата железа или меди получали дымящую серную кислоту, а при сжигании серы с селитрой или нитратом калия — разбавленную.
Оба варианта производства были описаны Андреасом Либавиусом (родился около 1540 года) в его опубликованной в 1597 году работе « Алхимия».
С 1774 года серную кислоту стали производить в промышленном масштабе. Смесь диоксида серы, воздуха и оксидов азота нагревали до примерно 400 C. Полученная газовая смесь затем попала в свинцом футерованные, каскадные резервуары, в которых смесь опрыскивали водой и тем самым получали 60-70% серную кислоту.
Сегодня производство серной кислоты происходит в основном по контактному методу.
В современном технологическом процессе получение серной кислоты осуществляется в три этапа. На первом этапе получается диоксид серы (SO2) из элементарной серы (S) при взаимодействии с кислородом (O2) :
Далее диоксид серы реагирует с пятиокисью ванадия (V2O5) в качестве катализатора до триоксида серы (SO3):
Триоксид серы является ангидридом серной кислоты. Из-за низкой растворимости в воде его вводят не непосредственно в воду, а в концентрированную серную кислоту.
Образующаяся серная кислота непрерывно разбавляется водой.
Количество произведенной серной кислоты является показателем эффективности химической промышленности страны.
Фазы развития химической промышленности:
I. Преобладающее потребление едкого натра
II. Преобладающее потребление серной кислоты
III. Преобладающее потребление хлора
Применение
Серная кислота является одним из наиболее часто используемых химических веществ. По всему миру производится более 150 миллионов тонн. Применяется:
- для производства сульфатов;
- для производства других кислот (например, плавиковой и фосфорной);
- для производства удобрений;
- для производства поверхностно-активных веществ;
- в качестве катализатора;
- как осушитель (адсорбент);
- при производстве автомобильных аккумуляторов;
- при производстве диоксида титана;
- при приготовлении косметических средств и фармацевтических препаратов, требующих процесса сульфирования, к примеру мыла.
В пищевой промышленности серная кислота используется в качестве технического вспомогательного вещества для производства модифицированного крахмала и казеина, а также для очистки питьевой воды.
В пустынных районах Соединенных Штатов используется в сельском хозяйстве для восстановления засушливых и неплодородных почв.
Опасность для здоровья
Пары этой кислоты крайне токсичны и при вдыхании могут привести к серьезному повреждению легких.
Попадание в глаза вызывает полную потерю зрения, а на кожу — серьезные ожоги.
При приеме внутрь (даже если это капля) — может привести к мучительной смерти.
Обращение с серной кислотой должно осуществляться с большой осторожностью и в соответствии с мерами промышленной безопасности.
Источник