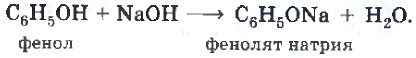Фенолы
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
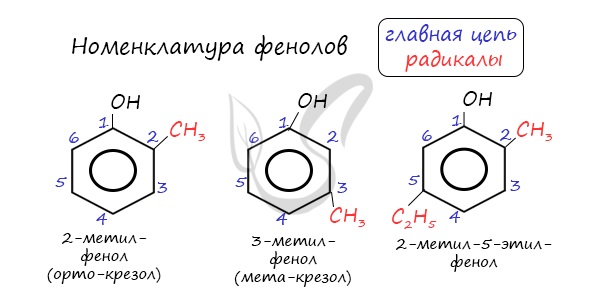
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
Химические свойства фенолов
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей — фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)
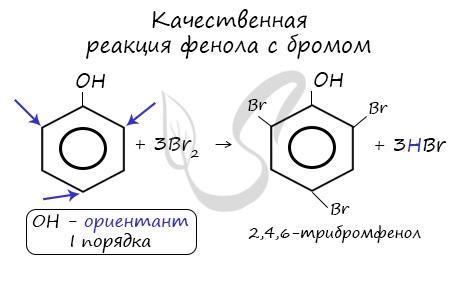
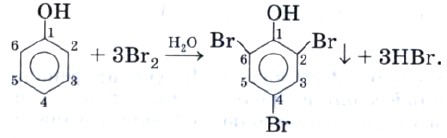
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал — нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
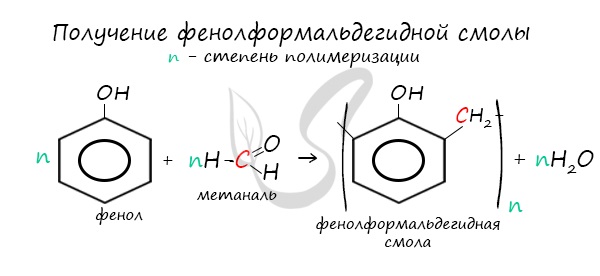
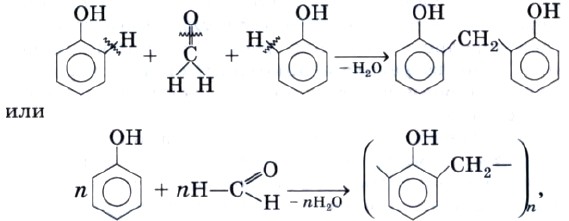
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Опыты по химии. Фенолы
Взаимодействие фенола с бромной водой
К раствору фенола в воде прильем немного бромной воды. В растворе появляется белая взвесь — выпадает осадок трибромфенола. В результате взаимного влияния атомов в молекуле фенола происходит замещение не одного, а трех атомов водорода бромом. Эта реакция является одной из качественных реакций на фенол.
Оборудование: пробирки, штатив для пробирок, шпатель.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Фенол вызывает ожог кожи. Не допускать попадания фенола на кожу.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие фенола с металлическим натрием
Также как и спирты, фенол взаимодействует со щелочными металлами. В пробирку поместим немного фенола. Нагреем фенол до плавления. При контакте металлического натрия с расплавленным фенолом происходит энергичное взаимодействие. В результате реакции образуется фенолят натрия, и выделяется водород. Эта реакция доказывает сходство фенола с одноатомными спиртами.
2С6Н5ОН + 2Na = 2C6H5ONa + H2
Оборудование: пробирка, скальпель, пинцет, фильтровальная бумага, горелка.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Фенол вызывает ожог кожи. Не допускать попадания фенола на кожу. Соблюдать правила работы со щелочными металлами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие фенола с раствором щелочи
Фенол по сравнению с одноатомными спиртами проявляет большие кислотные свойства. Он способен реагировать с растворами щелочей. К водной эмульсии фенола прильем несколько капель раствора гидроксида натрия. Образуется прозрачный раствор фенолята натрия.
С6Н5ОН + NaOH = C6H5ONa + H2О
Оборудование: пробирки, штатив для пробирок, шпатель.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Фенол вызывает ожог кожи. Не допускать попадания фенола на кожу. Соблюдать правила работы со щелочами и их растворами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение физических свойств фенола
Чистый фенол – бесцветные кристаллы с характерным запахом. При хранении фенол частично окисляется и приобретает розовую или красную окраску. Проверим растворимость фенола в воде. Для этого к нескольким кристалликам фенола прибавим немного воды. Фенол мало растворим в воде. При взбалтывании образуется суспензия фенола в воде.
Оборудование: пробирки, штатив для пробирок, горелка, шпатель.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Фенол вызывает ожог кожи. Не допускать попадания фенола на кожу.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция на фенол
Качественной реакцией на фенол является реакция с хлоридом железа (III). К сильно разбавленному раствору фенола добавляем раствор хлорида железа. Жидкость в пробирке окрашивается в темно-фиолетовый цвет. С помощью этой реакции можно определить фенол даже при очень малых его концентрациях.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Не допускать попадания фенола на кожу.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Источник
§ 10. Фенол
Функциональную гидроксильную группу содержат не только спирты, но и другой класс органических соединений, которые называют фенолами. У веществ этого класса гидроксил связан не с алкильным радикалом, а с фенилом, т. е. ароматическим радикалом.
Простейшим представителем этого класса органических соединений является фенол С6Н5ОН (рис. 42).
Фенол раньше получали взаимодействием хлорбензола со щелочью в очень жестких условиях (высокие температура и давление):
В настоящее время одним из важнейших способов получения фенола является прямое окисление бензола.
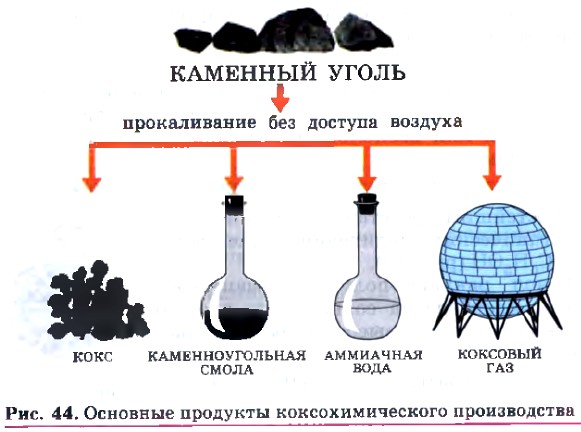
Одним из основных источников для промышленного получения фенола является каменный уголь.
Каменный уголь представляет собой окаменелые останки доисторических растений. Наряду с природным газом и нефтью, он является важнейшим сырьевым источником химических веществ. Запасы каменного угля на планете значительно превышают запасы газа и нефти (рис. 43), поэтому химическое производство, основанное на переработке угля (коксохимическое производство), имеет большое будущее.
Коксохимическое производство (рис. 44) основано на нагревании каменного угля в специальных установках, называемых коксовыми батареями, без доступа воздуха. В результате коксования, которое проводят при температуре около 1000 °С, получают:
Фенол представляет собой белые игольчатые кристаллы с характерным запахом, быстро розовеющие на воздухе в результате окисления. Он малорастворим в холодной воде, но неограниченно — в горячей.
До сих пор используют исторически сложившееся название этого вещества — карболовая кислота.
Химические свойства фенола обусловлены сочетанием двух фрагментов в составе его молекулы: ароматического углеводородного радикала фенила и гидроксильной группы. Свойства фенола являются яркой иллюстрацией положения теории строения органических соединений о взаимном влиянии атомов в молекулах.
Влияние фенила на гидроксил заключается в том, что он еще более поляризует ковалентную связь между атомами кислорода и водорода в гидроксиле. Атом водорода при этом становится более подвижным по сравнению со спиртами, что обусловливает кислотные свойства фенола (отсюда и название — карболовая кислота):
Поэтому, в отличие от спиртов, фенол вступает в реакцию нейтрализации со щелочами, например:
Подобно алкоголятам, фенолят натрия может быть получен и при взаимодействии фенола с металлическим натрием:
Влияние гидроксила на фенил состоит в том, что он делает атомы водорода в положениях 2, 4 и б более подвижными, и потому фенол, в отличие от бензола, взаимодействует с бромной водой, образуя белый осадок 2,4,6-трибромфенол:
Эта реакция служит для качественного обнаружения фенола.
Из-за подвижности атомов водорода в положениях 2 и 6 фенол способен вступать в реакцию поликонденсации с формальдегидом с образованием фенолоформальдегидной смолы:
которая является основой для производства ценнейшей фенолоформальдегидной пластмассы.
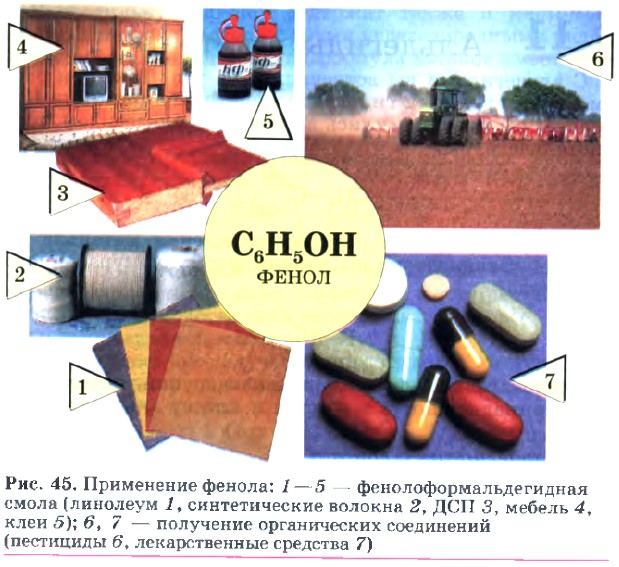
Фенолоформальдегидную смолу широко используют для производства древесностружечных плит (ДСП), фанеры, электротехнических приборов, бытовых предметов. Мебель, изготовленная из ДСП, выделяет в атмосферу квартир и домов немалое количество фенола, который очень вреден для здоровья, поэтому комнаты с такой мебелью надо проветривать, а лучше — дать отстояться новой мебели в нежилом помещении с открытым окном.
Фенол находит широкое применение в различных отраслях промышленности (рис. 45).
1. Какие вещества называют фенолами?
2. Почему фенол называют также карболовой кислотой?
3. В чем проявляется взаимное влияние фенила и гидроксила друг на друга в молекуле фенола?
4. Какие свойства фенола лежат в основе его применения?
5. Из 390 г бензола в две стадии было получено 410 г фенола. Определите массовую долю выхода продукта реакции от теоретически возможного.
6. При взаимодействии фенола с бромной водой образуется нерастворимый в воде 2,4,6-трибромфенол (качественная реакция на фенол). При действии избытка бромной воды на 240 г водного раствора фенола получено 8,45 г осадка. Рассчитайте массовую долю фенола в исходном растворе.
- Фенол. Ответы
Источник