- Вычисление количества теплоты (энтальпии), которое выделяется при реакции
- Эксперимент «Натрий на воде»
- Меры предосторожности
- Реагенты и оборудование:
- Пошаговая инструкция
- Пояснение процессов
- Задача № 1. При взаимодействии 10 г оксида натрия с водой выделяется 36,46 кДж теплоты
- Эксперимент «Натрий на воде»
- Меры предосторожности
- Реагенты и оборудование:
- Пошаговая инструкция
- Пояснение процессов
- Пособие-репетитор по химии
Вычисление количества теплоты (энтальпии), которое выделяется при реакции
Задача 981.
Вычислить количество теплоты, которое выделится при 25 °С при взаимодействия 8 г гидрида натрия с водой. Стандартные энтальпии образования NaН и NаОН принять соответственно равными —56,4 и —425,6 кДж/моль.
Решение:
М(NaH) = 24 г/моль; ΔН 0 (H2O) = -286,0 кДж/моль.
Уравнение реакции:
Находим тепловой эффект химической реакции, используя следствие из закона Гесса:
ΔН 0 х.р. = ΔН 0 (NaOHl) — ΔН 0 (H2O) + ΔН 0 (NaH) =
= (-425,6,5) – [(-286,0) + (-56,4)] = -83,2 кДж.
Теперь рассчитаем количество теплоты, выделившейся при взаимодействии 8 г нитрида натрия с водой, получим:
24 : 83,2 = 8 : Q; Q = (83,2 . 8)/24 = 27,73 кДж.
Ответ: 27,73 кДж.
Задача 982.
Закончить уравнения реакций:
а) Na2O2 + KI + H2SO4 →
в) K + O 2 (избыток) →
б) Li3N + H2O →
г) KNO3 
Решение:
а) Na2O2 + 2KI + 2H2SO4 → I2 + Na2SO4 + K2SO4 + 2H2O;
в) K + O2 (избыток) → KO2 (надпероксид калия);
г) 2KNO3 
Задача 983.
Назвать важнейшие сплавы меди, указать их примерный состав.
Решение:
а) Сплавы меди с цинком, называются латуни. Латуни с высоким содержанием меди – томпак – благодаря своему внешнему сходству с золотом используется для ювелирных и декоративных изделий.
б) Медноникелевые сплавы. Мельхиоры – это сплавы, которые содержат 20 – 30% никеля и небольшое количество железа и марганца, а нейзильберы содержат 5-35% никеля и 13-45% марганца. Манганин – сплав, содержащий 3% никеля и 12% марганца. Константан — электрохимический медно-никелевый сплав, содержащий 40% никеля и 1,5% марганца. Копель – термопарный сплав меди, содержащий 43% никеля и 0,5% марганца.
в) Бронзы – сплавы меди с бериллием, алюминием, оловом, кремнием и др. Бронза обычная содержит 10% олова, а остальное — медь. Оловянные бронзы – самые древние бронзы. Алюминиевые бронзы – сплавы, содержащие 5-10% алюминия и добавки железа марганца и никеля. Бериллиевые бронзы используются для изготовления пружин и других ответственных деталей. Сплав «Деварда» — сплав, легко растирающийся в порошок, состоит из 45% алюминия и 5% цинка применяется в качестве восстановителя (из воды сплав этот выделяет водород уже из холодной воды).
г) Международные золотой и серебряный монетные сплавы – сплавы меди, состоящие соответственно из 90% золота или серебра и 10% меди. В настоящее время эти монеты почти не имеют хождения. Для выделки различных украшений и изделий применяются сплавы золота или серебра с медью, а также сплавы золота с серебром и медью, состав которых (пробу) выражают числом весовых частей драгоценного металла в 1000 частях сплава. Например, для золотых зубных протезов применяются сплавы с пробой 900 или 916, а для ювелирных изделий – 958, 750, 583, 500, 375.
Источник
Эксперимент «Натрий на воде»
Почему металл не тонет, а бегает по воде?
Можно ли заставить металл бегать по воде? Давайте проверим!
Меры предосторожности
Проводите опыт в защитных перчатках, очках и маске. Соблюдайте технику безопасности при работе с огнем и горючими предметами, а также активными металлами (литий, натрий, калий, рубидий, цезий).
Внимание! Не проводите этот опыт самостоятельно — только в присутствии профессионала!
Реагенты и оборудование:
- металлический натрий;
- 1%-й р-р фенолфталеина;
- 1%-й р-р индигокармина;
- 1%-й р-р тимолового синего;
- вода;
- кристаллизатор (3 шт.).
Пошаговая инструкция
В кристаллизаторы наливаем воду и добавляем растворы индикаторов: в первый кристаллизатор капаем фенолфталеин, во второй — индигокармин, а в третий — тимоловый синий. Добавляем по кусочку металлического натрия. Наблюдаем изменение окраски во всех трех кристаллизаторах.
Пояснение процессов
Натрий — очень активный металл, он способен вытеснять водород из воды. Реакция натрия и воды нередко сопровождается взрывом. Если маленький кусочек натрия бросить в кристаллизатор с водой и кислотно-основным индикатором, натрий будет быстро бегать по поверхности жидкости. При этом он будет плавиться, превращаясь в красивую «бусину», которая может даже загореться!
Почему натрий бегает
При взаимодействии с водой выделяется водород, который подталкивает натрий к «бегству».
Почему натрий плавится и загорается
Реакция натрия с водой сопровождается выделением огромного количества тепла — из-за этого металл плавится. Этой энергии реакции достаточно, чтобы поджечь выделяющейся водород!
Почему изменяется цвет растворов
Фенолфталеин, индигокармин и тимоловый синий являются кислотно-основными индикаторами, то есть веществами, которые изменяют свой цвет в зависимости от водородного показателя среды. При взаимодействии натрия с водой образуется гидроксид натрия, который является очень сильным основанием — так среда становится щелочной. Фенолфталеин меняет цвет от бесцветного к малиновому, индигокармин — от синего к зеленому, а тимоловый синий — от желтого к синему.
Источник
Задача № 1. При взаимодействии 10 г оксида натрия с водой выделяется 36,46 кДж теплоты
При взаимодействии 10 г оксида натрия с водой выделяется 36,46 кДж теплоты. Какое количество теплоты (кДж) выделилось, если в результате реакции образовалось 200 г гидроксида натрия?
1. Запишем термохимическое уравнение реакции:
2. Определяем количество оксида натрия:


3. Определяем количество гидроксида натрия, образовавшегося при растворении 10 г Na2O: n(Na2O) : n(NaOН) = 1 : 2 (по уравнению),
следовательно, n(NaOН) = 2 n(Na2O); n(NaOН) = 2×0,16 = 0,32 моль.
4. Определяем количество гидроксида натрия, соответствующего 200 г NaOH:
5. Определяем количество теплоты, выделившейся при образовании
5 моль NaOH:
при образовании 0,32 моль NaOH выделится 36,46 кДж,
а при образовании 5 моль NaOH выделится х кДж, что составляет:
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.004 сек.)
Источник
Эксперимент «Натрий на воде»
Почему металл не тонет, а бегает по воде?
Можно ли заставить металл бегать по воде? Давайте проверим!
Меры предосторожности
Проводите опыт в защитных перчатках, очках и маске. Соблюдайте технику безопасности при работе с огнем и горючими предметами, а также активными металлами (литий, натрий, калий, рубидий, цезий).
Внимание! Не проводите этот опыт самостоятельно — только в присутствии профессионала!
Реагенты и оборудование:
- металлический натрий;
- 1%-й р-р фенолфталеина;
- 1%-й р-р индигокармина;
- 1%-й р-р тимолового синего;
- вода;
- кристаллизатор (3 шт.).
Пошаговая инструкция
В кристаллизаторы наливаем воду и добавляем растворы индикаторов: в первый кристаллизатор капаем фенолфталеин, во второй — индигокармин, а в третий — тимоловый синий. Добавляем по кусочку металлического натрия. Наблюдаем изменение окраски во всех трех кристаллизаторах.
Пояснение процессов
Натрий — очень активный металл, он способен вытеснять водород из воды. Реакция натрия и воды нередко сопровождается взрывом. Если маленький кусочек натрия бросить в кристаллизатор с водой и кислотно-основным индикатором, натрий будет быстро бегать по поверхности жидкости. При этом он будет плавиться, превращаясь в красивую «бусину», которая может даже загореться!
Почему натрий бегает
При взаимодействии с водой выделяется водород, который подталкивает натрий к «бегству».
Почему натрий плавится и загорается
Реакция натрия с водой сопровождается выделением огромного количества тепла — из-за этого металл плавится. Этой энергии реакции достаточно, чтобы поджечь выделяющейся водород!
Почему изменяется цвет растворов
Фенолфталеин, индигокармин и тимоловый синий являются кислотно-основными индикаторами, то есть веществами, которые изменяют свой цвет в зависимости от водородного показателя среды. При взаимодействии натрия с водой образуется гидроксид натрия, который является очень сильным основанием — так среда становится щелочной. Фенолфталеин меняет цвет от бесцветного к малиновому, индигокармин — от синего к зеленому, а тимоловый синий — от желтого к синему.
Источник
Пособие-репетитор по химии
ЗАНЯТИЕ 10
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16/2006
Основы термохимии. Тепловые эффекты химических реакций
План

2. Тепловой эффект химической реакции. Понятие об энтальпии.
3. Термохимические уравнения.
4. Закон Гесса и следствия из него.
Химические реакции протекают с выделением или поглощением энергии (обычно в виде теплоты). Химические реакции, протекающие с выделением теплоты, называются экзотермическими, а реакции, протекающие с поглощением теплоты, – эндотермическими.
С + О2 
СaCO3 
Количество теплоты, которое выделяется или поглощается в результате химической реакции, называется тепловым эффектом реакции (Q).
Тепловой эффект выражается в кДж или ккал
(1 ккал = 4,187 кДж). Для экзотермических реакций Q > 0, для эндотермических Q
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| а, г | а | г | б | в | а, в | г | в | а |
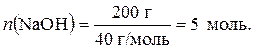
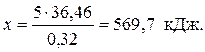
 1. Вычислить теплоту реакции получения гидроксида кальция из оксида кальция и воды, если теплота образования оксида кальция равна +635,7 кДж/моль, теплота образования воды равна +285,8 кДж/моль, а теплота образования гидроксида кальция равна +986,8 кДж/моль.
1. Вычислить теплоту реакции получения гидроксида кальция из оксида кальция и воды, если теплота образования оксида кальция равна +635,7 кДж/моль, теплота образования воды равна +285,8 кДж/моль, а теплота образования гидроксида кальция равна +986,8 кДж/моль.
 Н = –802,2 кДж.
Н = –802,2 кДж.



