ВЕЩЕСТВА, ОТДАЮЩИЕ КИСЛОРОД
К этой группе относятся лекарственные вещества, обладающие свойствами окислителя, то есть отдавать атомарный кислород, который, при выделении обладает наиболее высокой активностью, а вступая во взаимодействие с микробами, влияет на них губительно.
Препараты, отдающие кислород, действуют бактерицидно быстро и сильно. Это имеет большое значение для уничтожения вегетативных форм микробов прежде всего на ранах и слизистых оболочках животного. Препараты этой группы ценны тем, что активны и в толще воспалительного экссудата, гноя, даже некротизированных тканей. Атомарный кислород легко взаимодействует с продуктами воспаления и в результате этого влияет дезодорирующе, а если же образуется много мельчайших пузырьков кислорода (при распаде перекиси водорода), то они вызывают отторжение мертвых клеток и быстро очищают рану.
Перекись водорода — Hydrogenii peroxydatum (Н2О2). В практике используют раствор перекиси водорода разной концентрации: So-lutio Hydrogenii peroxydi concentrata seu Perhydrolum (30% H2O2), Solutio Hydrogenii peroxydi diluta (3% H2O2). Растворы перекиси водорода представляют собой прозрачные бесцветные жидкости слабокислой реакции. При кипячении, а также при соприкосновении с органическими и другими легко окисляющимися веществами разлагаются с выделением кислорода: 1 л 3%-ного раствора перекиси водорода выделяет до 10 л газообразного кислорода.
При действии на ткани животного раствор перекиси водорода умеренно раздражает рецепторы и влияет вяжуще (вяжущим эффектом объясняется его кровоостанавливающее действие). При приеме внутрь у собак вызывает рвоту, а у крупного рогатого скота — скопление газа в рубце и развитие тяжелой формы тимпании; у лошадей нередко отмечают острое расширение желудка. При стоматитах растворы перекиси водорода устраняют неприятный запах (задерживают развитие гнилостных процессов), Применяют 3%-ный раствор перекиси водорода преимущественно наружно для дезинфекции, дезодорации и очистки загрязненных ран и язв, а также при воспалении наружного уха;, при фибринозных конъюнктивитах и фарингитах; в хирургии — для снятия прилипших повязок.
Весьма удобны для хранения и транспортировки таблетки комплексного соединения перекиси водорода с мочевиной — гидроперит (Hydroperitum). Они содержат около 35% перекиси водорода. Для получения 3%-ного раствора перекиси водорода одну таблетку (1,5) следует растворить в 15 мл (или в столовой ложке) воды, а для получения 1%-ного раствора берут две таблетки на 100 мл воды.
Калия перманганат—Kalii hypermanganas, КМпО4. Ромбические кристаллы или кристаллический порошок темно-фиолетового цвета. Растворяется в воде (1 : 18), в зависимости от концентрации раствора окрашивается от розового до темно-фиолетового цвета. При взаимодействии с органическими веществами разлагается с выделением свободного кислорода как в щелочной, так и в кислой среде. Образующийся при распаде соли кислород действует так же, как кислород перекиси водорода, но несколько медленнее, а образующиеся соли марганца оказывают вяжущее влияние. Свежеприготовленные растворы слабее, чем растворы 3—5-дневной давности: подогретые растворы активнее, чем холодные.
Применяют калия перманганат в форме 0,1—1%-ных растворов как антисептическое, дезодорирующее и вяжущее средство при катаральных, гнойных и гнилостных стоматитах, фарингитах, проктитах, вагинитах и эндометритах; при ожогах используют 2—4%-ные растворы в форме компрессов; в разведении 1 : 1000 КМпО4 назначают для промывания влагалища при многих гинекологических заболеваниях, в том числе и при трихомонозе крупного рогатого скота. Внутрь в форме 1—3%-ных растворов препарат вводят как противоядие при отравлении фосфором, морфином, а также как дезинфицирующее средство; в 0,1—2%-ных растворах — как противовоспалительное при остром гастрите, 2—4%-ные растворы используют для дезинфекции и дезодорации мясных прилавков на рынках, тары из-под колбасных, рыбных и других изделий. Калия перманганат малотоксичен для травоядных животных. От 15,0—20,0 г препарата (в сухом виде) у лошадей каких-либо нарушений со стороны пищеварительного тракта незаметно. При вскрытии забитых животных не обнаруживают никаких поражений и даже редко бывает окрашивание слизистых оболочек.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Кислород
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.
Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος — рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
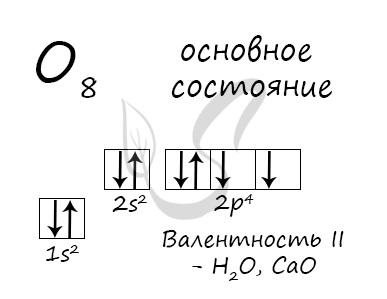
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 4 :
- O — 2s 2 2p 4
- S — 3s 2 3p 4
- Se — 4s 2 4p 4
- Te — 5s 2 5p 4
- Po — 6s 2 6p 4
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
На подводных лодках для получения кислорода применяют следующую реакцию:
Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O +2 )
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.
Все органические вещества сгорают с образованием углекислого газа и воды.
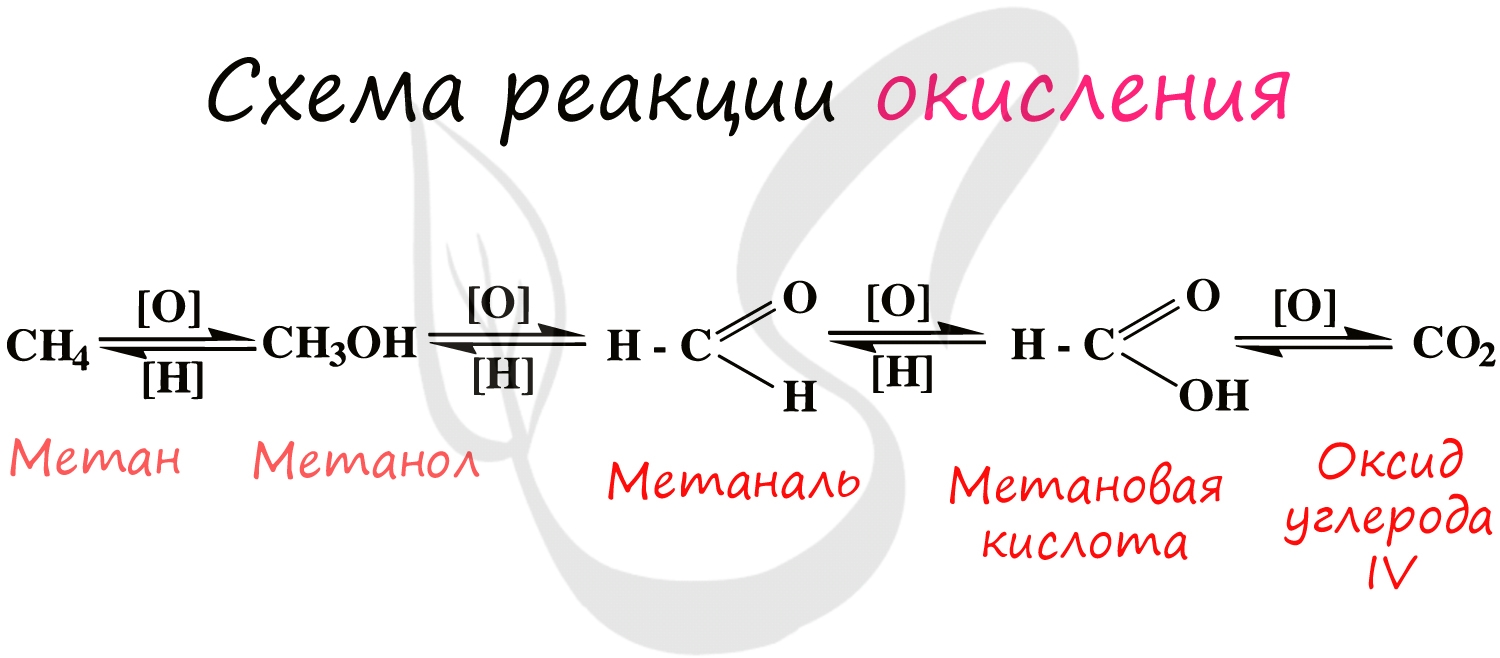
При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Откуда берется кислород в воде? Взаимодействие кислорода с водой. Насыщение воды кислородом
Пожалуй, сейчас даже дети знают, что химическая формула воды — H2O. Однако это теория, а на деле в воде растворено огромное количество веществ как органического, так и неорганического происхождения. Чистая вода, как известно, не имеет вкуса и запаха, но кто угодно может убедиться в том, что в подавляющем большинстве случаев это не так. В питьевой воде, например, содержится некоторое количество минеральных солей, что придает ей солоноватый привкус. В той или иной степени в ней содержится все то, с чем она контактирует. Точный состав воды зависит от места ее забора, ведь в разных местах она контактирует с разными веществами. Кое-где химики найдут в жидкости тяжелые металлы, где-то — различные органические вещества.
Как же так получается?
Вода является универсальным растворителем. Дистилированная вода считается наиболее чистым в химическом смысле веществом, однако через некоторое время она утрачивает свое первоначальное состояние. И вот почему: вода является настолько хорошим растворителем, что со временем в нее попадают молекулы различных веществ из воздуха. В природе же это происходит еще и за счет жизнедеятельности различных организмов, живущих в водной среде.
Газы в воде
Наливая воду в стакан, можно увидеть пузырьки газа, которые будут находиться на стенках сосуда. Наряду с солями и другими веществами вода растворяет в себе и газы. Прежде всего это азот из воздуха, а также кислород, углекислый газ, а в некоторых случаях еще метан и сероводород. Причем холодная вода растворяет газы гораздо лучше, чем теплая, так что чем ниже температура, тем выше концентрация газов. И наоборот — с ростом температуры растворимость падает.
Источники растворенных в воде газов
Но откуда вообще все эти вещества берутся в воде? Азот, как правило, растворяется в процессе взаимодействия с атмосферой, метан — в результате контакта с породами и разложения донного ила, а сероводород образуется как продукт гниения органических остатков. Как правило, сероводород содержится в глубинных водных слоях и не поднимается к поверхности. При его высокой концентрации жизнь невозможна, так, например, в Черном море на глубинах более 150-200 метров из-за высокой насыщенности вод сероводором почти нет живых организмов, кроме некоторых бактерий.
Кислород также всегда содержится в воде. Он является универсальным окислителем, поэтому частично разлагает сероводород, снижая его концентрацию. Но откуда берется кислород в воде? О нем разговор пойдет особый.
Кислород
Практически все живые организмы нуждаются в кислороде. Люди дышат вохдухом, который представляет собой смесь газов, немалую часть которой составляет именно он.
Обитатели водной среды также нуждаются в этом веществе, так что концентрация кислорода в воде — это очень важный показатель. Обычно он составляет до 14 мг/л, если речь идет о природных водах, а иногда даже больше. В той же жидкости, которая течет из-под крана, кислорода содержится гораздо меньше, и это легко объяснить. Водопроводная вода после водозабора проходит через несколько этапов очистки, а растворенный кислород — крайне неустойчивое соединение. В результате газообмена с воздушной средой большая его часть просто улетучивается. Так откуда берется кислород в воде, если не из воздуха?
На самом деле это не совсем правда, из воздуха он тоже берется, но его доля, растворенная в результате контакта с атмосферой, крайне мала. Для того чтобы взаимодействие кислорода с водой было достаточно эффективным, необходимы особые условия: низкая температура, высокое давление и относительно низкая минерализация. Они соблюдаются далеко не всегда, и жизнь вряд ли бы существовала в нынешнем виде, если бы единственным способом образования этого газа в водной среде было взаимодействие с атмосферой. К счастью, есть еще два источника, откуда берется кислород в воде. Во-первых, растворенные молекулы газа в большом количестве содержатся в снеговых и дождевых водах, а во-вторых — и это основной источник — в результате фотосинтеза, осуществляемого водной растительностью и фитопланктоном.
Кстати, несмотря на то, что молекула воды содержит кислород, извлечь его оттуда живые организмы, конечно, не в состоянии. Поэтому им остается довольствоваться именно растворенной долей.
О значении водорослей
Мало кто в обычной жизни задумывается, чем мы дышим и почему состав воздуха именно такой, какой он есть. Практически все знают, что большинство живых организмов, дышащих воздухом, приспособлено именно к такой смеси. Но если речь идет о наземно-воздушной среде, то вопросов не возникает. А откуда в воде кислород? Как и на земле, там много растений, которые с помощью процесса, который называют фотосинтезом, потребляя свет и углекислый газ, выделяют O2.
Если же быть точнее, в последние десятилетия по тем или иным причинам человечество уничтожило огромную часть лесов. Но речи о глобальном кризисе пока нет, хотя население планеты постоянно растет, и потребление кислорода
огромно. И огромное значение в этом вопросе имеют водоросли, которые обитают в Мировом океане, большей частью именно за их счет происходит насыщение воды кислородом. Некоторые их виды люди и морские обитатели употребляют в пищу, но их количество остается достаточным для эффективного фотосинтезирования. Вот откуда берется кислород в воде, а значит, благодаря газообмену с атмосферой, и в воздухе. Именно фотосинтез водорослей — его основной источник. Кстати, именно за счет процессов, происходящих в растениях, был накоплен первичный кислород в атмосфере, а сейчас происходит только поддержание ее неизменного состава.
Роль растворенного кислорода (РК)
Несмотря на то что дыхательная система водных обитателей устроена иначе, чем у жителей наземно-воздушной среды, они нуждаются все в тех же веществах. Прежде всего речь идет о кислороде, который играет важную роль в жизнедеятельности подавляющего большинства организмов. И если мы извлекаем его из атмосферы, где его доля более или менее стабильна и составляет около 21%, то жители рек, морей и океанов сильно зависят от того, сколько кислорода в воде содержится в месте их обитания. Помимо рыб, кислород нужен и растениям. Однако его продукция обычно выше, чем уровень потребления, так что это не должно вызывать беспокойства.
Нормальные показатели
Из-за своей значительной роли в нормальном функционировании экосистем, уровень РК часто подвергается контролю со стороны биологов и экологов. Ведь в природе все связано, нарушение газового баланса в одном водоеме может вызвать проблемы и в соседних, если они связаны. Как правило, замеры проводятся до полудня, в этот период концентрация газа в поверхностных водах становится максимальной и составляет до 14 мг/л. Этот показатель подвержен серьезным суточным и сезонным колебаниям, но он не должен опускаться ниже 4 мг/л.
Уменьшение концентрации до 2 мг/л и менее вызывает массовую гибель обитателей гидросферы. Фактически — от удушья. Постепенное снижение показателя может говорить о загрязнении водоема и также может со временем закончиться гибелью водных жителей.
Важное значение хорошая аэрация имеет, например, в аквариумистике. Именно поэтому необходимо не только устанавливать специальные насосы, закачивающие воздух в воду и насыщающие его кислородом, но и, например, при необходимости высаживать на дне различные водоросли. Конечно, тем, кто имеет подобное хобби, в первую очередь интересна эстетика экосистемы, однако нельзя забывать о ее устойчивости и некой долговечности.
Если же речь идет о рыбных хозяйствах, производстве жемчуга и других специфических отраслях подобного типа, то помимо различных мер, направленных на сохранение достаточной концентрации растворенного кислорода в воде, необходимо регулярно проводить измерение этого показателя с помощью специальных проб. При их заборе крайне важно, чтобы не произошло контакта с воздухом, это может исказить результаты анализа.
Источник