- Практическая работа № 7(c). Получение аммиака и изучение его свойств
- Практическая работа «Получение аммиака и изучение его свойств» методическая разработка по химии (9 класс) на тему
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Практическая работа по химии в 9 классе «Изучение свойств аммиака» материал по химии (9 класс) на тему
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Практическая работа » Получение аммиака и изучение его свойств»
- Цель: 1. овладеть одним из способов получения аммиака реакцией ионного
- На уроке мы должны получить аммиак реакцией ионного обмена и изучить свойства этого газа и его водного раствора – гидроксида аммония.
- IV Подведение итога урока.
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Современные образовательные технологии в преподавании химии с учетом ФГОС
- Оставьте свой комментарий
- Подарочные сертификаты
Практическая работа № 7(c). Получение аммиака и изучение его свойств
Получение аммиака. Проведем все действия, описанные в учебнике.
Соберите прибор, как показано на рисунке 50.
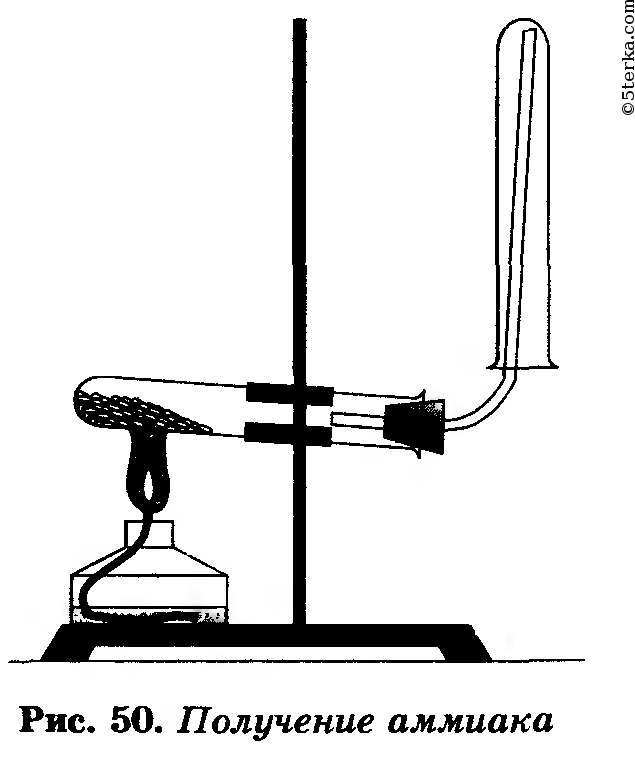
На лист бумаги или в небольшую фарфоровую чашку (можно ступку) насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ).
Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой с газоотводной трубкой и укрепите в лапке штатива.
При укреплении прибора в лапке штатива обратите внимание на наклон пробирки относительно ее отверстия. На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 дви
жения пламени), а затем нагрейте в том месте, где находится смесь. Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку. Обнаружив аммиак, поднесите к отверстию пробирки стеклянную палочку, смоченную концентрированной соляной кислотой. Что вы наблюдаете? Напишите уравнения реакции.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, осторожно снимите с газоотводной трубки, держа ее вверх дном (конец газоотводной трубки сразу же после снятия с нее пробирки с аммиаком закройте кусочком мокрой ваты).
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Снова закройте пальцем отверстие пробирки под водой и выньте ее из сосуда.
1. Почему в данном случае пробирку со смесью веществ нужно укреплять в лапке штатива так, чтобы ее дно было несколько выше открытого конца? Запись уравнения реакции между хлоридом аммония и гидроксидом кальция поможет вам ответить на вопрос.
2. Почему аммиак собирают в перевернутую вверх дном пробирку? Какие еще газы можно собирать таким способом?
3. Что можно наблюдать, если вместо соляной кислоты поднести к отверстию пробирки с аммиаком палочку, смоченную концентрированной азотной кислотой? Напишите уравнение реакции.
4. Как доказать, что в водном растворе аммиака содержатся гидроксид-ионы?
Изучение свойств водного раствора аммиака
1. В пробирку налейте 2—3 мл водного раствора аммиака и добавьте 2—3 капли раствора фенолфталеина. Каков цвет раствора? Нагрейте этот раствор до кипения. Как изменится окраска раствора? Чем вызвано это изменение?
2. Налейте в пробирку 2—3 мл водного раствора аммиака. Добавьте 2—3 капли раствора фенолфталеина и приливайте по каплям раствор соляной кислоты до исчезновения малиновой окраски. Почему исчезла окраска? Напишите ионные уравнения реакции (полное и сокращенное).
3. В пробирку налейте 2—3 мл водного раствора хлорида алюминия и добавьте еще столько же водного раствора аммиака. Что вы наблюдаете? Напишите ионные уравнения реакции (полное и сокращенное).

Изучение свойств водного раствора аммиака.


задача №7
к главе «Практические работы».
Источник
Практическая работа «Получение аммиака и изучение его свойств»
методическая разработка по химии (9 класс) на тему
Практическая работа
«Получение аммиака и изучение его свойств»
Инструкция к практической работе, форма оформления отчета, дополнительные задания к теме.
Скачать:
| Вложение | Размер |
|---|---|
| prakticheskaya_rabota_pol-1_ammiaka.doc | 39.5 КБ |
Как сдать ЕГЭ на 80+ баллов?
Репетиторы Учи.Дома помогут подготовиться к ЕГЭ. Приходите на бесплатный пробный урок, на котором репетиторы определят ваш уровень подготовки и составят индивидуальный план обучения.
Бесплатно, онлайн, 40 минут
Предварительный просмотр:
«Получение аммиака и изучение его свойств»
Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.
Оборудование: лабораторный штатив, сухие пробирки, пробка с газоотводной трубкой, ступка, ложки для сыпучих веществ, спиртовка, спички, стакан с водой.
Реактивы: кристаллический гидроксид кальция, кристаллический хлорид аммония, раствор соляной кислоты, раствор ф – ф.
Уравнения реакций в молекулярном, полном и сокращенном ионном виде
1. Получение аммиака и исследование его физических свойств.
Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке
Собираем аммиак в пробирку дном .
Разрыхление реакционной массы.
Образование тумана.
Индикаторная бумага окрасилась в .
О выделении какого газа свидетельствуют наблюдения ?
Написать уравнение реакции:
Ca(OH) 2 + NH 4 Cl = . + NH 3 ↑ + .
Физические свойства аммиака: . Аммиак . воздуха, поэтому сухая пробирка – приемник находится дном. .
2. Исследование химических свойств аммиака
1 . Растворение аммиака в воде.
.Изучение кислотно-основных свойств водного раствора аммиака.
3. Взаимодействие с кислотами:
Сняв с газоотводной трубки прибора пробирку, помещаем её в химический стакан с водой.
Убираем из стакана пробирку и в образовавшийся раствор добавляем фенолфталеин .
В стакан с водным раствором аммиака в присутствии фенолфталеина вливают 1мл раствора серной кислоты
Пробирка наполняется водой.
Написать уравнение реакции, назвать образующееся вещество:
NH 4 OH + H + + . = NH 4 + + . + .
NH 4 OH + H + = NH 4 + + H 2 O
Аммиак . растворим в воде . Продукт взаимодействия аммиака с водой называется . . Относится к классу . . Механизм образования химической связи в катионе . . Тип реакции . .
Почему исчезла первоначальная окраска раствора?
Название продукта взаимодействия гидроксида аммония с соляной кислотой . . К какому классу относится продукт реакции? .
4. Окислительно-восстановительные свойства аммиака
На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель:
а) Горение аммиак без катализатора
б) Горение аммиак в присутствии катализатора
Какие вещества образуются в процессе горения аммиака а) без катализатора; б) в присутствии катализатора?
1) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
2) Какой объем кислорода потребуется для сжигания 34 г аммиака?
3) Закончите уравнения химических реакций, дайте названия продуктам реакций:
б) NH 3 + H 2 SO 4 = .
в) NH 3 + H 2 SO 4 = .
г) NH 3 + H 3 PO 4 = .
По теме: методические разработки, презентации и конспекты
Практическая работа № 2 9 класс.
Практическая работа № 2 8 класс.
При проведении практической работы должны показать умения Ø составлять технологическую карту;Ø применять теоретические знания о свойствах и лабораторном способе получения аммиака, при.
Инструкционная карта выдается ученикам на урок-практикум. В карте представлена схема сбора прибора для получения газа, даны подробные инструкции по работе, представлена таблица для оформления ра.
УМК Н.Е. Кузнецовой.
В данной работе представлена презентация и технологическая карта к уроку в 8 классе по учебнику «Химия.8» автора О.С. Габриелян.
Источник
Практическая работа по химии в 9 классе «Изучение свойств аммиака»
материал по химии (9 класс) на тему
Практическая работа дает возможность проверить пратические навыки чащихся, изучить свойства аммиака и проверить знания учащихся по теме «Соединения азота»
Скачать:
| Вложение | Размер |
|---|---|
| Практическая работа » Изучение свойств аммика». | 315.08 КБ |
Как сдать ЕГЭ на 80+ баллов?
Репетиторы Учи.Дома помогут подготовиться к ЕГЭ. Приходите на бесплатный пробный урок, на котором репетиторы определят ваш уровень подготовки и составят индивидуальный план обучения.
Бесплатно, онлайн, 40 минут
Предварительный просмотр:
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ОБЩАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81
«Получение аммиака и изучение его свойств»
Автор Ицкович Т.Я.
«Получение аммиака и изучение его свойств»
Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.
Оборудование: лабораторный штатив, сухие пробирки, пробка с газоотводной трубкой, ступка, ложки для сыпучих веществ, спиртовка, спички, стакан с водой.
Реактивы: кристаллический гидроксид кальция, кристаллический хлорид аммония, раствор соляной кислоты, раствор ф – ф.
Уравнения реакций в молекулярном, полном и сокращенном ионном виде
1. Получение аммиака и исследование его физических свойств.
Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке
Собираем аммиак в пробирку дном .
Разрыхление реакционной массы.
Образование тумана.
Индикаторная бумага окрасилась в .
О выделении какого газа свидетельствуют наблюдения ?
Написать уравнение реакции:
Ca(OH) 2 + NH 4 Cl = . + NH 3 ↑ + .
Физические свойства аммиака: . Аммиак . воздуха, поэтому сухая пробирка – приемник находится дном. .
2. Исследование химических свойств аммиака
1 . Растворение аммиака в воде.
.Изучение кислотно-основных свойств водного раствора аммиака.
3. Взаимодействие с кислотами:
Сняв с газоотводной трубки прибора пробирку, помещаем её в химический стакан с водой.
Убираем из стакана пробирку и в образовавшийся раствор добавляем фенолфталеин .
В стакан с водным раствором аммиака в присутствии фенолфталеина вливают 1мл раствора серной кислоты
Пробирка наполняется водой.
Написать уравнение реакции, назвать образующееся вещество:
NH 4 OH + H + + . = NH 4 + + . + .
NH 4 OH + H + = NH 4 + + H 2 O
Аммиак . растворим в воде . Продукт взаимодействия аммиака с водой называется . . Относится к классу . . Механизм образования химической связи в катионе . . Тип реакции . .
Почему исчезла первоначальная окраска раствора?
Название продукта взаимодействия гидроксида аммония с соляной кислотой . . К какому классу относится продукт реакции? .
4. Окислительно-восстановительные свойства аммиака
На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель:
а) Горение аммиак без катализатора
б) Горение аммиак в присутствии катализатора
Какие вещества образуются в процессе горения аммиака а) без катализатора; б) в присутствии катализатора?
1) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
2) Какой объем кислорода потребуется для сжигания 34 г аммиака?
3) Закончите уравнения химических реакций, дайте названия продуктам реакций:
б) NH 3 + H 2 SO 4 = .
в) NH 3 + H 2 SO 4 = .
г) NH 3 + H 3 PO 4 = .
По теме: методические разработки, презентации и конспекты
в данном пособии приводятся инструкции по лабораторным и практическим работам по ФГОС Нового поколения.
несколько инструкций к практическим работам по химии,помогающие сэкономить время на уроке.
несколько инструкций к практическим работам по химии,помогающие сэкономить время на уроке.
несколько инструкций к практическим работам по химии,помогающие сэкономить время на уроке.
несколько инструкций к практическим работам по химии,помогающие сэкономить время на уроке.
Предложенный материал представляет собой методическую разработку урока по химии по программе О.С.Габриеляна. В конспекте описаны все этапы урока с предполагаемой деятельностью обучающихся.
Конспект урока«Экспериментальное решение задач по неорганической химии» Цели урока:Обучающая: обобщить знания обучающихся о качественных реакциях на неорганические веществ.
Источник
Практическая работа » Получение аммиака и изучение его свойств»
ПЛАН ПРОВЕДЕНИЯ УРОКА ХИМИИ
Практическая работа № 7.
Получение аммиака и изучение его свойств.
Цель: 1. овладеть одним из способов получения аммиака реакцией ионного
обмена, которая используется и как качественная реакция на соли
2. совершенствовать умения собирать прибор для получения газа легче
3. изучить свойства водного раствора аммиака;
4. закреплять умение наблюдать за явлениями, описывать их и делать
Оборудование: прибор для получения аммиака, NH 4 CI , Ca ( OH ) 2 , H 2 O , c теклянные палочки, чашки Петри, фенолфталеин, нагревательный прибор, штатив.
I Постановка целей и задач урока.
На уроке мы должны получить аммиак реакцией ионного обмена и изучить свойства этого газа и его водного раствора – гидроксида аммония.
II . Повторение правил техника безопасности
1.Экономное расходование веществ.
2.При выяснении запаха веществ не подносите сосуд близко к лицу, иначе вдыхание паров и газов может вызвать раздражение дыхательных путей.
3.Проводите опыты только над столом, нагревая пробирку с жидкостью, держите её так, чтобы открытый конец её был направлен в сторону и от самого себя и от соседей.
4.Не приступайте к выполнению опыта, не зная, что и как нужно делать.
На лист бумаги или в небольшую фарфоровую чашку (можно ступку) насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ).
Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой с газоотводной трубкой и укрепите в лапке штатива.
При укреплении прибора в лапке штатива обратите внимание на наклон пробирки относительно ее отверстия. На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем нагрейте в том месте, где находится смесь.
Почему пробирка вверх дном? ( NH 3 легче воздуха в 2 раз).
Как вы узнаете, что получили NH 3 ?
1)по запаху (резкий запах);
2)поднесите к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку(она стала малиновой).
2)Не переворачивая пробирку, быстро опустите её в чашку с водой отверствием вниз, подержите так, капните фенолфталеин. Что произошло? Какое вещество мы получили?
Аммиак очень хорошо растворим в воде!
3)Получение „дыма без огня”
В результате этих реакций мы получили какие вещества? (соли аммония).
получили аммиак, обнаружили по резкому запаху, имеет основной
характер, хорошо растворим в воде, образуя основание, аммиачную
воду, взаимодействует с кислотами, образуя соли.
2.Изучение свойств водного раствора аммиака.
1 . NH 4 OH + 2,3 капли фенолфталеина → малиновая окраска
NH 4 OH + 2,3 капли фенолфталеина → малиновая окраска, + HCI
Как изменился цвет? Почему?


Н + + ОН — = Н 2 О реакция нейтрализации
AI 3+ + 3OH — = AI (OH) 3 ↓
при изучении свойств водного раствора NH 3 выяснили, что это
основание, разлагается при нагревании, взаимодействует
с кислотами и солями.
IV Подведение итога урока.
Вывод по уроку: чему научились?
Получили аммиак, изучили его свойства, а также свойства нашатырного спирта.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
Номер материала: ДБ-521566
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Рособрнадзор соберет данные о частоте проведения контрольных работ в школах
Время чтения: 1 минута
В Тульской области вводят школьные каникулы c 25 октября по 7 ноября
Время чтения: 1 минута
В московском метро появились наклейки для потерявшихся детей
Время чтения: 1 минута
Рособрнадзор оставил за регионами решение о дополнительных школьных каникулах
Время чтения: 1 минута
В школе в Пермском крае произошла стрельба
Время чтения: 1 минута
В России объявлены нерабочие дни с 30 октября по 7 ноября
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник











