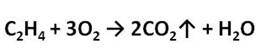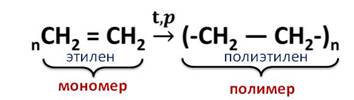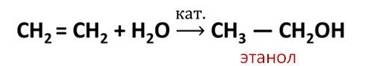- Практ. 1
- Практическая работа № 2 Получение этилена и изучение его свойств.
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Современные образовательные технологии в преподавании химии с учетом ФГОС
- Оставьте свой комментарий
- Подарочные сертификаты
- Алкены. Химические свойства этилена
- Урок 31. Химия 9 класс ФГОС
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Алкены. Химические свойства этилена»
Практ. 1
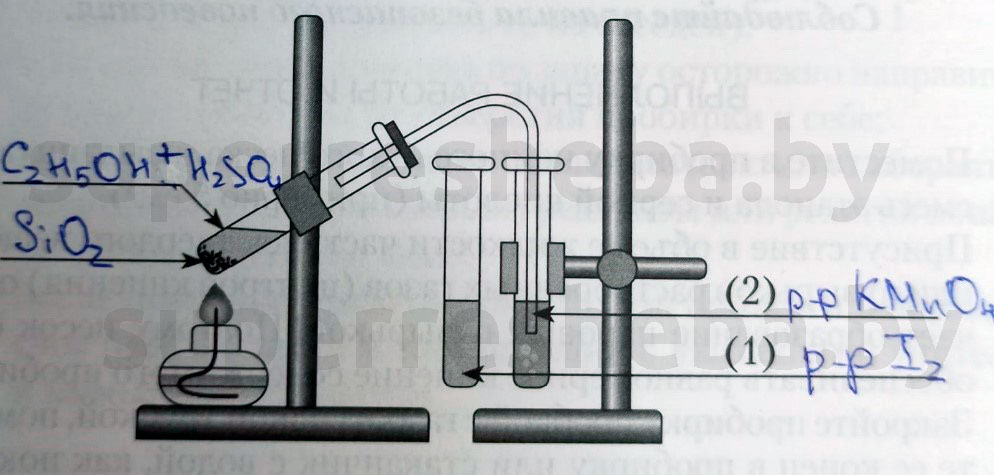
Напишите над стрелками формулы или названия веществ в пробирках.
Объясните явления, которые наблюдаются в процессе получения этилена.
В процессе получения мы наблюдали появление пузырьков газа и обесцвечивание растворов иода и перманганата калия. (Причины обесцвечивания приведены далее).
Приведите уравнение реакции получения этилена.
+ ° C 2 H 4 ↑ + H 2 O .
Объясните явления, наблюдаемые при пропускании этилена в пробирки с растворами иода (1) и перманганата калия (2).
В процессе получения этилена мы наблюдали обесцвечивание растворов иода и перманганата калия, потому что образовывались бесцветные продукты реакции. Раствор перманганата обесцвечивался, т.к. в ходе реакции перманганат переходил в щелочь и оксид марганца (IV), а раствора иода – потому что молекулы иода встраивались в молекулу этилена.
Приведите уравнения реакции этилена с раствором иода.
Приведите схему реакции этилена с раствором K M n O 4 \mathrm
Приведите уравнение реакции горения этилена.
1. Напишите, благодаря наличию какого структурного фрагмента в молекулах алкенов они вступают в реакции с иодной и бромной водой. К какому типу относятся данные реакции?
Алкены вступают в реакции с иодной и бромной водой благодаря наличию двойной связи. Эти реакции относятся к реакциям присоединения.
2. В каких условиях реагируют с бромом алканы? К какому типу относится реакция алканов с бромом?
Алканы реагируют с бромом на свету. Это реакция замещения.
3. Сравните отношение к бромной воде алканов и алкенов. Можно ли различить этан и этен при помощи бромной воды?
Да, можно. При пропускании этана через бромную воду раствор брома не будет обесцвечиваться, а при пропускании этена — будет.
Источник
Практическая работа № 2 Получение этилена и изучение его свойств.
Нечаев Дмитрий Валерьевич, учитель химии
ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ»
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
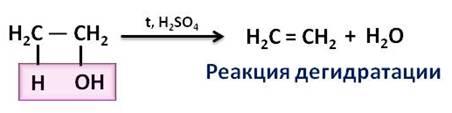
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
В пробирке начинается выделяться газ — этилен.
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
В третью пробирку налили 2-3 мл разбавленного раствора KMnO 4 , поодкисленного серной кислотой, и пропустили через него газ.
При пропускании газа через подкисленный раствор KMnO4 , происходит обесцвечивание раствора KMnO 4 .
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D (возд.) = Mr ( алкена)/Mr (воздуха);
Mr ( алкена) = D (возд.)* Mr (воздуха);
Mr ( алкена) = 1,45*29 = 42.
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D (Н2) = Mr ( алкена)/Mr (Н 2 );
Mr ( алкена) = 14*2 = 28.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
Номер материала: ДБ-1175165
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
В России пройдет конференция «Исследования, улучшающие образование»
Время чтения: 2 минуты
РАО учредит научно-образовательный центр для подготовки научных кадров
Время чтения: 1 минута
В России объявлены нерабочие дни с 30 октября по 7 ноября
Время чтения: 2 минуты
В Чувашии школьные каникулы продлятся две недели
Время чтения: 1 минута
В школе в Пермском крае произошла стрельба
Время чтения: 1 минута
Рособрнадзор оставил за регионами решение о дополнительных школьных каникулах
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник
Алкены. Химические свойства этилена
Урок 31. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Алкены. Химические свойства этилена»
Алкены. Химические свойства этилена
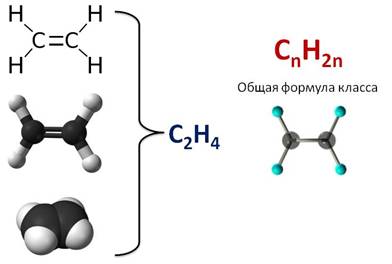
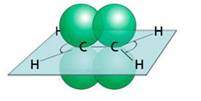
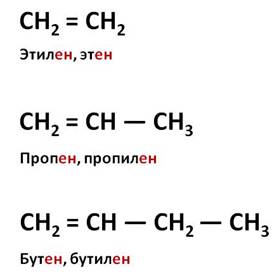
Первым представителем алкенов является этилен, или этен. Его молекулярная формула С2Н4. Из этой формулы можно выразить общую формулу этого класса – CnH2n.
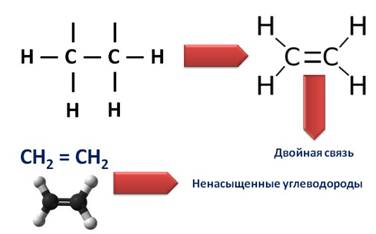
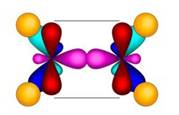
В образовании молекулы этилена участвуют два атома углерода, с каждым атомом углерода соединено два атома водорода и ещё у каждого атома углерода остаётся по одной свободной валентности, ведь атомы углерода должны быть четырёхвалентны. Поэтому между этими двумя углеродами возникает ещё одна связь. Такую связь называют двойной.
Из-за этой двойной связи этилен относят к ненасыщенным углеводородам, потому что атомы углерода не насыщены до предела атомами водорода, а образуется двойная C – C связь.
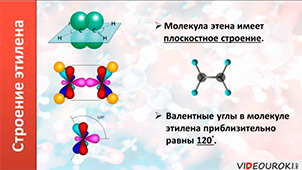
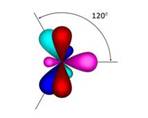
Молекула этилена плоская. Все шесть атомов молекулы лежат в одной плоскости. Экспериментально установлено, что валентные углы в молекуле этилена приблизительно равны 120 0 .
Вторым представителем гомологического ряда алкенов является пропен, или пропилен. Как вы могли заметить, в названии свех алкенов употребляется суффикс – ен. Следующим представителем алкенов является бутен, или бутилен.
По физическим свойствам этилен – газ со слабым запахом, незначительно растворяется в воде, лучше – в органических растворителях.
В лаборатории этилен можно получить из этилового спирта, путём отщепления от него молекулы воды. Эта реакция протекает в присутствии серной кислоты и при нагревании.
Эта реакция является реакцией дэгидратации. То есть, реакции дэгидратации – это реакции разложения, в результате которых от молекул веществ отщепляется вода.
Если поджечь выделяющийся газ, то можно заметить, что этилен горит светящимся пламенем.
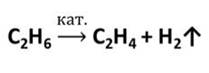
Этилен в промышленности получают нагреванием при высокой температуре углеводородов, содержащихся в попутных газах нефти. Эта реакция – крекинг (от английского крэк – расщеплять).
Этилен применяют для получения пластмасс и полиэтилена.
Полиэтилен – распространённый материал, из которого изготавливают трубы, посуду, его используют как покрытие для теплиц, как упаковку для сельхозпродуктов и продуктов питания, изготовления одноразовой посуды. Этилен используют для получения этилового спирта и других растворителей.
Полиэтилен получают из этилена при высокой температуре и давлении.
Эта реакция называется реакцией полимеризации. То есть, реакции полимеризации – это реакции, в которых происходит соединение молекул исходного вещества в огромную молекулу.
Исходное вещество, которое вступает в реакцию полимеризации, называется мономером. В данном случае, это – этилен, а продукт реакции – это полимер, у нас это – полиэтилен.
Полимеризацию можно рассматривать как частный случай реакции присоединения.
Для алкенов характерны и другие реакции присоединения. Эти реакции протекают с разрывом одной из двух связей.
Например, реакция присоединения воды, которая называется реакцией гидратации.
В результате реакции гидратации этилена образуется спирт – этанол. Эта реакция протекает в присутствии катализатора.
Этанол, или этиловый спирт широко используется как растворитель, для производства каучуков, пластмасс и химических волокон.
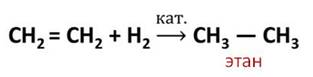
Водород присоединяется к этилену в присутствии катализатора с образованием этана. В этой реакции разорвалась одна химическая связь в молекуле этилена и связь в молекуле водорода и образовались две новые связи Н – С в молекуле этана.
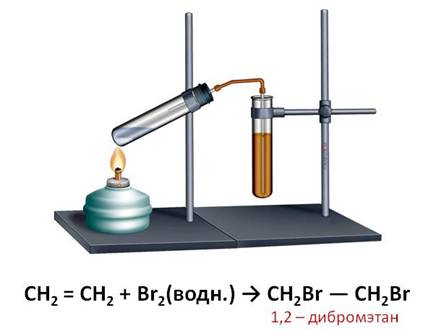
С помощью реакций присоединения можно распознать алкены. Качественными реакциями на двойную связь являются реакции обесцвечивания ими бромной воды и водного раствора перманганата калия.
Например, если пропустить через раствор бромной воды этилен, то происходит обесцвечивание бромной воды. В результате данной реакции образуется соединение – 1,2 – дибромэтан – вещество, у которого отсутствуют кратные связи.
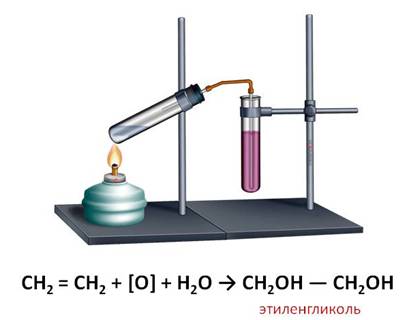
Если пропустить газ этилен через раствор марганцовки, то в данном случае, также происходит обесцвечивание этого раствора. В результате данной реакции образуется этиленгликоль.
Таким образом, молекула этилена имеет плоскостное строение, то есть все атомы находятся в одной плоскости. Валентный угол равен 120 0 . Характерными реакциями этилена являются реакции присоединения. Качественными реакциями на этилен являются реакции обесцвечивания бромной воды и водного раствора перманганата калия.
Источник