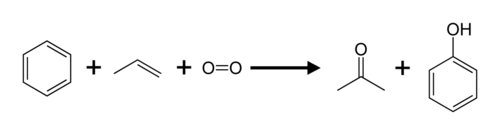
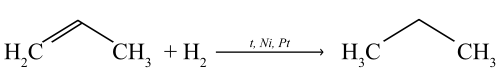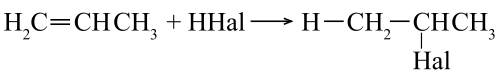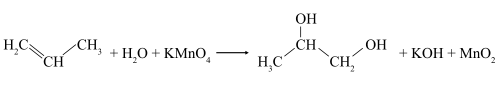- Пропилен
- Содержание
- Физические свойства
- Химические свойства
- Присоединение галогенов (галогенирование)
- Присоединение водорода (реакция гидрирования)
- Присоединение воды (реакция гидратации)
- Присоединение галогеноводородов (HHal)
- Горение на воздухе
- Полимеризация
- Окисление кислородом воздуха в пропиленоксид
- Получение
- В лаборатории
- В промышленности
- Применение
- Производство
- Источники
- Примечания
- Ссылки
- Полезное
- Смотреть что такое «Пропилен» в других словарях:
- Пропен — Propene
- СОДЕРЖАНИЕ
- Производство
- Паровой крекинг
- Технология преобразования олефинов
- Каталитический крекинг в псевдоожиженном слое
- Рынок и исследования
- Использует
- Реакции
- Комплексы переходных металлов
- Полимеризация
- Горение
- Экологическая безопасность
- Хранение и обращение
- Встречаемость в природе
Пропилен
| Пропилен | |
 | |
 | |
| Общие | |
|---|---|
| Химическая формула | C3H6 |
| Физические свойства | |
| Молярная масса | 42.08 г/моль |
| Плотность | 0.695@-47 °C г/см³ |
| Термические свойства | |
| Температура плавления | − 185.2 °C |
| Температура кипения | − 47.6 °C |
| Классификация | |
| Рег. номер CAS | 115-07-1 |
| SMILES | C=CC |
Пропиле́н (пропен) СН2=СН-СН3 — непредельный (ненасыщенный) углеводород ряда этилена, горючий газ, является изологом пропана. Вещество с наркотическим действием более сильным, чем у этилена. Класс опасности — четвертый. [1] .
Содержание
Физические свойства
Пропилен представляет собой газообразное вещество с низкой температурой кипения tкип= -47,7 °C и температурой плавления tпл= −187,6 °C, оптическая плотность d20 4 =0,5193.
Химические свойства
Обладает значительной реакционной способностью. Его химические свойства определяются двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Все реакции присоединения протекают по двойной связи и состоят в расщеплении π-связи алкена и образовании на месте разрыва двух новых σ-связей.
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
Присоединение галогенов (галогенирование)
Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — йода. Фтор взаимодействует со взрывом.
Присоединение водорода (реакция гидрирования)
Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропен переходит в предельный углеводород — пропан.
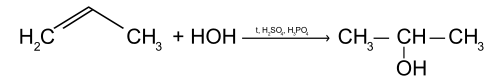
Присоединение воды (реакция гидратации)
Пропилен реагирует с водой с образованием одноатомного спирта изопропанола, при этом двойная связь раскрывается.
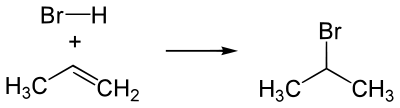
Присоединение галогеноводородов (HHal)
Происходит по правилу Марковникова. Водород кислоты HHal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом углерода, при котором находится меньшее число атомов водорода.
Пример гидрогалогенирования — получение бромпроизводного пропана при реакции бромоводорода и пропилена.
Горение на воздухе
При поджигании горит на воздухе: 2СН2=СНСН3 + 9О2 → 6СО2 + 6Н2О.
С кислородом воздуха газообразный пропилен образует взрывчатые смеси.
В слабощелочной или нейтральной водной среде пропилен окисляется перманганатом калия, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах углерода). Эта реакция получила название реакции Вагнера.
Полимеризация
Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных π-cвязей и образования новых межмолекулярных σ-cвязей.
Окисление кислородом воздуха в пропиленоксид
При нагревании в присутствии серебряных катализаторов:
Получение
В лаборатории
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
2. Гидрирование пропина в присутствии катализатора (Pd):
3. Дегидратация изопропилового спирта (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или Аl2O3:
4. Отщепление двух атомов галогена от дигалогеноалканов, содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.):
В промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3).
Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия:
Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Производство
Большая часть производственных мощностей по пропилену сосредоточена в Европе, Северной Америке и Азии. В настоящее время за год в мире производится более 50 миллионов тонн пропилена полимерного и химического сортов (PG/CG). Большая часть выпуска пропилена этих сортов приходится на долю установок пиролиза, где пропилен — побочный продукт производства этилена. Установками термического крекинга вырабатывается более 60 % такого пропилена. Нефтеперерабатывающими FCC-предприятиями выпускается 34 %. При дегидрогенизации или метатезисе пропана производится 3 % пропилена (в данном случае пропилен является целевым продуктом).
Пропилен нефтехимической чистоты (RG) производится на нефтеперерабатывающих предприятиях мира в количестве, равном 31,2 миллионам тонн. Большая часть такого пропилена вырабатывается на FCC-предприятиях, где пропилен — побочный продукт производства бензина и дистиллятов. Половина этих пропиленовых мощностей интегрирована с нефтехимическими предприятиями, на которых происходит алкилирование пропилена или смешивание LPG и пропана.
Источники
- http://www.ssa.ru
- http://chem.edu.ru
- А. И. Артеменко, Органическая химия, М.:Высшая школа — 1998
- Б. Д. Степин, А. А. Цветков, Органическая химия, М.:Высшая школа — 1994
Примечания
Ссылки
- http://www.xumuk.ru
- http://chemindustry.ru
 Углеводороды Углеводороды | |
|---|---|
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Эйкозан . |
| Алкены | Этилен • Пропен • Бутен • Пентен • Гексен • Гептен • Октен . |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен |
| Другие ненасыщеные | Винилацетилен • Диацетилен |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Циклобутадиен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | Нафталин • Антрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |
 |
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Пропилен» в других словарях:
ПРОПИЛЕН — Газообразное углеводородное тело, входящее в состав светильного газа. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ПРОПИЛЕН бесцветный газ углеводородного состава., находящейся в светильном газе; под сильным… … Словарь иностранных слов русского языка
Пропилен — – вещество, представляющее собой бесцветный горючий газ со слабым запахом. Химическая формула СH2=СН–CH3. Пропилен является одним из важнейших видов промышленного химического сырья. Содержится в газах крекинга нефтепродуктов. Широко… … Нефтегазовая микроэнциклопедия
ПРОПИЛЕН — (пропен) СН3СН=СН2, бесцветный газ, tкип ?47,7 .С. Получают пиролизом нефтепродуктов и дегидрогенизацией пропана. Важное сырье химической промышленности; применяется для синтеза глицерина, акрилонитрила, кумола, полипропилена и др … Большой Энциклопедический словарь
ПРОПИЛЕН — (пропен), бесцветный алифатический УГЛЕВОДОРОД, СН2СН:СН2, получаемый термическим КРЕКИНГОМ ЭТИЛЕНА. Используется в производстве широкого ряда химических веществ, включая виниловую и акриловую смолы. Свойства: температура кипения 48 °С;… … Научно-технический энциклопедический словарь
пропилен — сущ., кол во синонимов: 3 • олефин (5) • пропен (1) • углеводород (77) Словарь синонимов ASIS … Словарь синонимов
ПРОПИЛЕН — (пропен CH2 = CHCH3) непредельный (ненасыщенный) углеводород ряда этилена; бесцветный горючий газ со слабым запахом. Получают пиролизом нефтепродуктов и дегидрогенизацией пропана. Является важным сырьем химической промышленности … Российская энциклопедия по охране труда
пропилен — (C3Н6) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN propylene … Справочник технического переводчика
ПРОПИЛЕН — (пропей), (СH2=CH СH3) ненасыщенный углеводород ряда этилена, горючий газ без цвета, но со слабым запахом; обладает высокой реакционной способностью. П. содержится в газах, образующихся при (см.) нефти; широко применяется для производства… … Большая политехническая энциклопедия
пропилен — а; м. Органическое соединение газ, выделяемый из попутных газов нефтедобычи и нефтепереработки (используется в производстве моторных масел). ◁ Пропиленовый, ая, ое. П ая смесь. * * * пропилен (пропен), СН3СН=СН2, бесцветный газ, tкип 47,7°C.… … Энциклопедический словарь
пропилен — propenas statusas T sritis chemija formulė CH₂=CHCH₃ atitikmenys: angl. propene; propylene rus. пропен; пропилен ryšiai: sinonimas – propilenas … Chemijos terminų aiškinamasis žodynas
Источник
Пропен — Propene
- 115-07-1
Y
- ЧЕБИ: 16052
Y
- ChEMBL117213
Y
- 7954
Y
- C11505
Y
- AUG1H506LY
Y
1,745 кг / м 3 , газ (1,013 бар, 25 ° C)
613,9 кг / м 3 , жидкость



 Y проверить ( что есть ?)
Y проверить ( что есть ?)  Y
Y  N
NПропен , также известный как пропилен , представляет собой ненасыщенное органическое соединение с химической формулой . Он имеет одну двойную связь и является вторым простейшим представителем алкенового класса углеводородов . Это бесцветный газ со слабым запахом нефти. CH 3 CH знак равно CH 2 <\ displaystyle <\ ce
СОДЕРЖАНИЕ
Производство
Паровой крекинг
Доминирующей технологией производства пропилена является паровой крекинг. Та же технология применяется с этаном к этилену. Судя по масштабу, эти две конверсии являются процессами №2 и №1 в химической промышленности. В этом процессе пропан подвергается дегидрированию . Побочный продукт — водород:
Выход пропена составляет около 85 % . Побочные продукты обычно используются в качестве топлива для реакции дегидрирования пропана. Крекинг с паром — один из самых энергоемких промышленных процессов.
Исходным сырьем является нафта или пропан , особенно на Ближнем Востоке , где имеется большое количество пропана, добываемого при нефтегазовых операциях. Пропен можно отделить фракционной перегонкой от углеводородных смесей, полученных в результате крекинга и других процессов очистки; Пропен нефтеперерабатывающего качества составляет от 50 до 70%. В Соединенных Штатах сланцевый газ является основным источником пропана.
Технология преобразования олефинов
В технологии конверсии триолефина или олефина Phillips пропилен взаимно превращается с этиленом и 2-бутенами . Катализаторы на основе рения и молибдена используются:
В основе технологии лежит реакция метатезиса олефинов, открытая в компании Phillips Petroleum . Достигнут выход пропена около 90 мас.%.
Связанный является Метанол-к-олефинов / метанол-к-пропена процесс. Он преобразует синтез-газ (синтез-газ) в метанол , а затем преобразует метанол в этилен и / или пропен . В качестве побочного продукта процесса образуется вода. Синтез-газ производится путем реформирования природного газа или реформирования паром нефтепродуктов, таких как нафта, или путем газификации угля .
Каталитический крекинг в псевдоожиженном слое
Каталитический крекинг с псевдоожиженным слоем высокой жесткости (FCC) использует традиционную технологию FCC в жестких условиях (более высокое отношение катализатора к маслу, более высокая скорость впрыска пара, более высокие температуры и т. Д.), Чтобы максимизировать количество пропена и других легких продуктов. В установку FCC с высокой степенью строгости обычно подают газойли (парафины) и остатки, и при этом в сырье производится около 20–25 млн.% Пропена вместе с большими объемами автомобильного бензина и побочных продуктов дистиллята. Эти высокотемпературные процессы дороги и имеют большой углеродный след. По этим причинам альтернативные пути получения пропилена продолжают привлекать внимание.
Рынок и исследования
Производство пропена оставалось неизменным на уровне около 35 миллионов тонн (только Европа и Северная Америка) с 2000 по 2008 год, но оно увеличивалось в Восточной Азии, особенно в Сингапуре и Китае. В настоящее время общее мировое производство пропена составляет примерно половину от производства этилена.
Было изучено использование сконструированных ферментов , но оно не имеет коммерческой ценности.
Использует
Пропен — второй по важности исходный продукт в нефтехимической промышленности после этилена . Это сырье для самых разных продуктов. Производители полипропилена потребляют почти две трети мирового производства. Конечные применения полипропилена включают пленки, волокна, контейнеры, упаковку, а также крышки и укупорочные средства. Пропен также используется для производства важных химических веществ, таких как оксид пропилена, акрилонитрил, кумол, масляный альдегид и акриловая кислота. В 2013 году во всем мире было переработано около 85 миллионов тонн пропена.
Пропен также используется для производства изопропанола (пропан-2-ол), акрилонитрила , оксида пропилена и эпихлоргидрина . Промышленное производство акриловой кислоты включает каталитическое частичное окисление пропена. Пропен также является промежуточным продуктом при одностадийном селективном окислении пропана до акриловой кислоты. В промышленности и мастерских пропен используется в качестве альтернативного топлива ацетилену при газокислородной сварке и резке , пайке и нагреве металла с целью гибки. Теперь, когда настоящий газ MAPP больше не доступен, он стал стандартом для продуктов BernzOmatic и других продуктов, заменяющих MAPP .
Реакции
Пропен напоминает другие алкен в том , что она претерпевает аддитивные реакции относительно легко при комнатной температуре. Относительная слабость его двойной связи объясняет его склонность вступать в реакцию с веществами, которые могут осуществить это преобразование. Алкеновые реакции включают: 1) полимеризацию , 2) окисление , 3) галогенирование и гидрогалогенирование , 4) алкилирование , 5) гидратацию , 6) олигомеризацию и 7) гидроформилирование .
Комплексы переходных металлов
В основе гидроформилирования, метатезиса алкенов и полимеризации лежат комплексы металл-пропилен , которые являются промежуточными продуктами в этих процессах. Пропилен является прохиральным , что означает, что связывание реагента (такого как металлический электрофил) с группой C = C дает один из двух энантиомеров .
Полимеризация
Большая часть пропена используется для образования полипропилена, очень важного товарного термопласта , путем полимеризации с ростом цепи . В присутствии подходящего катализатора (обычно катализатора Циглера-Натта ) пропен полимеризуется. Есть несколько способов добиться этого, например, использовать высокое давление для суспендирования катализатора в растворе жидкого пропена или пропустить газообразный пропен через реактор с псевдоожиженным слоем .

Горение
Пропен горит аналогично другим алкенам . В присутствии достаточного или избыточного кислорода пропен горит с образованием воды и углекислого газа .
Экологическая безопасность
Пропен — продукт сгорания от лесных пожаров, сигаретного дыма, выхлопных газов автомобилей и самолетов. Это примесь в некоторых отопительных газах. Наблюдаемые концентрации были в диапазоне 0.1-4.8 частей на миллиард ( частей на миллиард ) в сельском воздухе, 4-10.5 частей на миллиард в городском воздухе, и 7-260 частей на миллиард в образцах промышленных воздуха.
В Соединенных Штатах и некоторых европейских странах пороговое значение 500 частей на миллион ( ppm ) было установлено для профессионального воздействия (8-часовое средневзвешенное по времени ) воздействие. Он считается летучим органическим соединением (ЛОС), и его выбросы регулируются правительствами многих стран, но Агентство по охране окружающей среды США (EPA) не внесло его в список опасных загрязнителей воздуха в соответствии с Законом о чистом воздухе . С относительно коротким периодом полураспада не ожидается биоаккумуляции.
Пропен имеет низкую острую токсичность при вдыхании и не считается канцерогенным. Исследования хронической токсичности на мышах не дали существенных доказательств побочных эффектов. Люди, подвергшиеся кратковременному воздействию 4000 частей на миллион, не испытывали каких-либо заметных эффектов. Пропен опасен из-за его способности вытеснять кислород как удушающий газ , а также из-за его высокой воспламеняемости / риска взрыва.
Биопропилен — это пропилен на биологической основе . Это было исследовано, мотивировано различными интересами, такими как углеродный след . Было рассмотрено производство из глюкозы . Более современные способы решения таких проблем сосредоточены на электрификации, альтернативной паровому крекингу .
Хранение и обращение
Пропен легко воспламеняется. Пропен обычно хранится в жидком виде под давлением, хотя его также можно безопасно хранить в виде газа при температуре окружающей среды в одобренных контейнерах.
Встречаемость в природе
Пропен обнаружен в межзвездной среде с помощью микроволновой спектроскопии. 30 сентября 2013 года НАСА также объявило, что орбитальный аппарат Кассини, входящий в миссию Кассини-Гюйгенс , с помощью спектроскопии обнаружил небольшие количества природного пропена в атмосфере Титана .
Источник