можно ли считать, что вода это кислота?
если вода кислота, то она должно вступать в реакцию с металлами левее водорода (в ряде активности) , и действительно она вступает в реакцию со щелочными металлами вытесняя водород (как кислота) . Соли воды — основания (гидроксиды) , кислотный остаток у воды OH.
HOH + Na = NaOH + H2, где HOH — вода (кислота) , Na — металл, NaOH — соль воды.
нет вода вообщето ш2о, а кислоты получаются на её основе
вода Н+ ОН-
одновременно и кислота и основание
потому и является таким хорошим растворителем (почти универсальным, чуть не дотянула)
вода является окислителем. вызывает корозии металов. а горячая вода быстро разъедает снег и лёд, однажды уничтожила мою любимую сосулю.
Вода — это расстворитель !
P.S. И на её основе получаются РАССТВОРЫ кислот .
Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность).
С позиции теории электролитической диссоциации вода — амфолит, так как дает два типа ионов, как кислота, — катион водорода (Н+),как основание, -гидроксид анион (ОН-).В свете протонной теории может тоже проявлять свойство как кислоты (отщеплять протон) и, как основание, -присоединять его) в виде Н3О (+).
считай, никто не запрещает, но одновременно она является и основанием.
вода является кислотой т. к. она реагирует с щёлочами как Li Na u K. Происходит тот же эфект как и с кислотой. Сами рассудите SH2, HCl, CH3 являются кислотами. Почему же вы считаете, что вода это
не кислота.
Источник
Химия, Биология, подготовка к ГИА и ЕГЭ
Размышления ( не учебный материал . ) на тему
свойств молекулы воды
Автор статьи — Саид Лутфуллин
Самое распространенное вещество на нашей планете. Без нее не было бы жизни. Все живые структуры, за исключением вирусов, по большей части состоят из воды. На ее примере детям в школе объясняют строение молекул, химические формулы. Свойства, характерные только для воды, используются в живой природе, а так же в хозяйственной жизни человека.
С детства нам знакомое вещество, никогда не вызывавшее каких-то вопросов. Ну вода, и что? А в таком простом, казалось бы, веществе скрыто много загадок.
свойства молекулы воды
Вода — основной природный растворитель. Все реакции в живых организмах так или иначе протекают в водной среде, вещества реагируют в растворенном состоянии.
У воды отличная теплоемкость, но довольно малая теплопроводность. Это позволяет использовать воду как транспорт тепла. На этом принципе основан механизм охлаждения многих организмов. А в атомной энергетике и воду, благодаря этому свойству, используют в качестве теплоносителя.
В воде не только протекают реакции, она сама вступает в реакции. Гидратация, фотолиз и т. д.
Это только некоторые свойства, ни одно вещество не может похвастаться таким наборов свойств. Поистине это вещество уникально.
Ну а теперь ближе к теме.
Всегда, везде, даже в школе на уроках химии ее называют просто «вода».
А вот какое химическое называние и свойства молекулы воды?
На просторах интернета и учебной литературы можно встретить такие называния: оксид водорода, гидроксид водорода, гидроксильная кислота. Это самые наиболее часто встречающиеся.
Так к какому все таки классу неорганических веществ относится вода?
Давайте разберемся в этом вопросе.
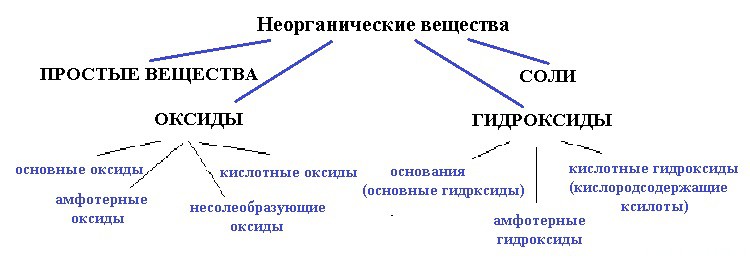
Ниже приведена схема:
вода — точно не простое вещество, так как образована атомами разных элементов;
и не соль, так как связь в солях между катионом и анионом должна быть ионной, катионом должен быть металл, а в молекуле воды связи только ковалентные и катион — водород (неметалл).
Для начала разберемся — оксид это или гидроксид. Что с уверенностью можно сказать, так это то, что вода — это точно не оксид.
Хотя, если поверхностно посмотреть, то вода, в принципе, попадает под определение оксида водорода. Образуется в результате реакции полного окисления водорода: 2H2 + O2 → 2H2O, кислород в низшей степени окисления.
Рассмотрим по свойствам :
Свойства основных оксидов:
Взаимодействие с кислотами.
Взаимодействие с кислотными оксидами.
Взаимодействие с амфотерными оксидами.
Молекула воды обладает только одним свойством основного оксида — это взаимодействие с кислотными оксидами.
Свойства кислотных оксидов:
Взаимодействие со щелочами.
Взаимодействие основными оксидами.
Взаимодействие амфотерными оксидами.
Молекула воды так же проявляет только одно свойство: взаимодействие основными оксидами.
По свойствам молекула воды проявляет двойственную природу : реагирует с кислотными и основными оксидами.
Но воду нельзя отнести к амфотерным оксидам, так как амфотерные оксиды образуют металлы, а водород — неметалл.
Выходит, если вода — все таки оксид, значит несолеобразующий.
Но, может это будет сенсацией, ВОДА ОБРАЗУЕТ СОЛИ!
Но об этом немного позже.
Из приведенных выше доказательств следует, что вода — не оксид. Еще один аргумент «против оксида»: ни один оксид не диссоциирует на ионы, а одно из свойств молекулы воды — частичная диссоциация на катион H + и анион OH — .
Исходя из предыдущего: в воде два «разных» водорода. Один в катионе, другой — в анионе.
И формулу воды следует писать не так как мы привыкли: H2O, а
HOH
Следовательно, вода — это гидроксид.
Эта версия более правдоподобна: гидроксильная группа явно намекает на что-то подобное. Но какой гидроксид? Давайте опять разберем по свойствам гидроксиды:
Свойства основных гидроксидов (оснований):
Для растворимых оснований (щелочей):
Для растворимых оснований (щелочей) характерны реакции ионного обмена.
Взаимодействие растворимых оснований (щелочей) с кислотными основаниями.
Взаимодействие с амфотерными гидроксидами.
Нерастворимые основания разлагаются при нагревании.
Молекула воды не проявляет ни одного свойства, только разве что, при сильном нагревании, она подвергнется разложению, ну а это со всеми веществами так — есть определенный порог температуры, выше которого связи не могут больше существовать и разрушаются.
Так же аргумент, «против» амфотерного и основного гидроксида — основные и амфотерные гидроксиды образуют только металлы.
Теперь подходим к самой интересной части. Выходит, что вода — это
кислотный гидроксид, то есть кислородосодержащая кислота.
Рассмотрим по свойствам.
Для кислотных гидроксидов характерны:
Реакции с металлами.
Реакции с основными и амфотерными оксидами.
Реакции с основаниями и амфотерными гидроксидам.
Реакции с солями.
Для сильных кислот так же реакции ионного обмена.
Вытеснение более слабых, а так же летучих кислот из солей.
Для молекулы воды характерны почти все эти свойства.
- Реакции с металлами. Не все металлы способны реагировать с водой. Вода как кислота — очень слабая, но, тем не менее, это свойство она проявляет:
HOH + Na → NaOH + H2↑ — из воды вытесняется водород — вода ведет себя, как большинство кислот.
- Реакции с основными и амфотерными оксидами. С амфотерными оксидами не реагирует, так как кислотные свойства слабые, но реагирует с основными оксидами (не со всеми правда, это объясняется слабыми кислотными свойствами):
HOH + Na2O → 2NaOH
- Реакции с основаниями и амфотерными гидроксидам. Тут вода не может похвастаться такими реакциями — из-за своей слабости как кислоты.
- Реакции с солями. Некоторые соли подвергаются гидролизу — как раз таки реакции с водой.
Эта реакция так же иллюстрирует последнее свойство — вытеснение кислоты, у воды получается вытеснить сероводород.
Из определения: «кислота — это сложное вещество, состоящее из водорода и кислотного остатка, при диссоциирующее на катион H + и катион кислотного остатка«.
Все подходит. И получается, что кислотный остаток — это гидроксильная группа OH.
И, как я и говорил раньше, вода образует соли, выходит, что соли воды-кислоты — это основные и амфотерные гидроксиды: металл, соединенный с кислотным остатком (OH).
И схемы реакций:
кислота + металл → соль + водород (в общем случае)
HOH + Na → NaOH + H2↑
кислота + основный оксид → соль вода
HOH + Na2O → 2NaOH (соль образуется, только воды не образуется, да и с чего бы это вдруг в результате реакции с водой, должна образовываться вода)
соль + кислота → другая кислота + другая соль
Итак, мы пришли к выводу, что амфотерные и основные гидроксиды — это соли воды — кислоты.
Тогда как их называть?
Весть термин «гидроксид» также применим к кислородосодержащим кислотам. По правилам получается:
название иона + ат = Гидрокс + ат.
Соли воды — гидроксаты.
Вода настолько слабая кислота, что проявляет некоторые амфотерные свойства, например реакции с кислотными оксидами.
И в воде нейтральная среда, а не кислая, как во всех кислотах — это исключение из правила.
Но в конце концов, как говорил замечательный русский химик-органик «Неосуществимых реакций нет, а если реакция не идет, то еще не найден катализатор».
Сформулируем основные положения теории «Вода — кислота»:
Молекула воды по свойствам — слабая (очень слабая) кислота.
Вода настолько слабая, что проявляет амфотерные свойства и у нее нейтральная реакция среды.
Вода как кислота образует соли — гидроксаты.
К гидроксатам относятся амфотерные и основные гидроксиды.
Формула воды: HOH.
Правильные названия воды: гидроксид водорода, гидроксильная кислота.
Источник
Кислая и щелочная вода
Показатель pH считается одной из базовых характеристик питьевой и хозяйственной воды. В этой статье мы разберем, что это такое, почему он так важен и как влияет на здоровье. Заодно расскажем, как можно измерить pH и скорректировать его в нужную сторону.
Что такое pH?
pH — аббревиатура латинских слов potentia Hidrogeni, что в переводе означает “сила водорода”. Его называют показателем кислотности. pH измеряется по шкале от 0 до 14 и показывает соотношение положительно заряженных ионов водорода H+ и отрицательно заряженных гидроксид-ионов водорода OH-.
Чем ниже показатель pH, тем меньше в воде содержится ионов водорода, которые входят в состав практически любой кислоты. Поэтому чем меньше pH, тем кислее жидкость, и наоборот — чем больше в воде OH-, тем выше ее щелочность. Уровень pH кислоты равен 0, что означает, что отрицательные гидроксид-ионы в ней отсутствуют. Щелочь имеет pH выше 14. В дистилированной воде содержится равное количество и тех, и других ионов, ее pH равен 7. Вода с pH ниже 7 будет иметь кислую реакцию, а с pH выше 7 — щелочную.
Наши самые популярные акции
Помпа + 3 бутыли за 490 руб!
Доставка воды до квартиры
Кулер + 5 бутылей воды за 4900 руб.
pH вокруг и внутри нас: вода кислая и щелочная
В жизни мы употребляем (внутрь и для хозяйственных нужд) жидкости с самым разным уровнем pH. Например:
- pH меньше 3 — сильнокислая жидкость (лимонный сок).
- pH от 3 до 5 — кислая жидкость. Такой показатель имеют апельсиновый сок, пиво и вино.
- pH от 5 до 6.5 — слабокислая жидкость. Это черный кофе или молоко.
- pH от 6.5 до 8.5 — нейтральная или слабощелочная жидкость. Как мы уже говорили, такой pH имеет чистая вода.
- pH от 8.5 до 9.5 — щелочная жидкость. Получится, если добавить в воду пищевую соду.
- pH от 9.5 до 11 — сильнощелочная жидкость. Показатель хлорной извести.
Жидкости человеческого организма в среднем имеют слабощелочную реакцию. Так, pH слюны равен 6.5-7.4, слез – 7.3-7, крови – 7.32-7.43. Женское молоко имеет практически нейтральный pH 6.9-7.5. Щелочными являются пищеварительный сок (pH 7.5-9) и желчь (pH 8-8.5).
Вреден ли для здоровья пониженный или повышенный pH воды
Идеальным pH для питьевой воды считается нейтральный и слабощелочной. Санитарно-эпидимиологические нормы (СанПиН) допускают колебания показателя кислотности воды в наших кранах в пределах от 6 до 9 единиц.
Что же будет, если вода имеет высокий или слишком низкий pH? Медики говорят, что здоровому человеку такая вода сильного вреда не причинит. Однако есть моменты, на которые стоит обратить внимание.
Вода с повышенным pH
Вода с pH больше 9 имеет низкую кислотность и считается щелочной. Она, как правило, имеет неприятный запах и привкус соды. Регулярное употребление такой воды может привести к гастриту или язве. Также возможно накапливание щелочи в организме, в медицине называемое алколозом. Человек испытывает мышечную слабость, озноб, нарушается работа сердечно-сосудистой системы.
Купание в щелочной воде может вызвать раздражение слизистых оболочек и зуд кожи. Такое случается, например, в бассейнах, где для очистки воды используют хлорную известь.
Высокая щелочность воды может означать, что в ней содержится много солей кальция и магния (вода “жесткая”). Такая вода плохо мылится и приводит к образованию накипи.
Вода с пониженным pH
Вода с pH ниже 6,5 имеет низкую щелочность и считается кислой. В быту она ощущается “мягкой”. Сама по себе кислая вода неопасна, однако, проходя по водопроводным трубам, она увеличивает их коррозию. В результате в кислой воде может быть повышенное содержание частиц ржавчины, железа, меди, свинца. При длительном употреблении такой воды металлы накапливаются в организме и могут вызвать отравление.
Как измерить pH воды
Как мы уже отмечали выше, о повышенной или пониженной кислотности воды можно догадаться и без специальных приборов: щелочная вода не мылится, а кислая кажется на ощупь мягкой. Самый простой и дешевый способ измерить pH — лакмусовые полоски, которые продают в хозяйственных магазинах или зоомаркетах.
Полоску нужно опустить в воду и сравнить результаты с таблицей, приложенной к упаковке. Результаты будут приблизительными, но, тем не менее, позволят определить, насколько pH-показатель воды отличается от нормы. Стоимость полосок начинается от 100 руб.
Для более точных результатов используйте pH-метр. Прибор внешне напоминает электронный градусник и стоит от 500 руб.
Как повысить или понизить кислотность воды
Самый простой и очевидный способ повысить pH (щелочность) воды — прокипятить. Свежий кипяток имеет показатель pH 8.42. По мере остывания кислотность повышается примерно до 7.9. Также можно добавить в воду обыкновенную пищевую соду.
Кислотность воды повышается (pH снижается), если на воде что-нибудь приготовить. Например, заваривание чая уменьшает pH до 6.4, приготовление черного кофе — до 5.26, какао — 5.75.
Для корректировки кислотности воды используют специальные фильтры:
- фильтры с минерализаторами. Обогащают воду натрием, магнием, калием, тем самым повышая щелочность и снижая кислотность воды.
- фильтры обратного осмоса. Наоборот, очищают воду от избытка минералов, делая ее более кислой и снижая уровень pH.
Источник