- Урок №19. Соляная кислота и её соли
- Соляная кислота
- Содержание
- Физические свойства [ ]
- Химические свойства [ ]
- Производство [ ]
- Применение [ ]
- Промышленность [ ]
- Медицина [ ]
- Особенности обращения [ ]
- Ссылки [ ]
- Соляная кислота
- Содержание
- Физические свойства
- Химические свойства
- Производство
- Применение
- Промышленность
- Медицина
- Особенности обращения
- Примечания
- Ссылки
- Полезное
- Смотреть что такое «Соляная кислота» в других словарях:
Урок №19. Соляная кислота и её соли
Соляная кислота
Физические свойства:
Концентрированная соляная кислота – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом.
Получение соляной кислоты:
Соляная кислота HCl получается при растворении газа хлороводорода воде. Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H 2 SO 4 = HCl↑ + NaHSO 4 (хлороводород + гидросульфат натрия)
Химические свойства:
Раствор хлороводорода в воде — соляная кислота — сильная кислота:
1) реагирует с металлами , стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl 3 + 3H 2
3) с оксидами металлов :
MgO + 2HCl = MgCl 2 + H 2 O
4) с основаниями и аммиаком :
HCl + KOH = KCl + H 2 O
3HCl + Al(OH) 3 = AlCl 3 + 3H 2 O
HCl + NH 3 = NH 4 Cl
5) с солями :
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
HCl + AgNO 3 = AgCl↓ + HNO 3
Образование белого осадка хлорида серебра — AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl — в растворе.
Хлориды металлов — соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
2Fe + 3Cl 2 = 2FeCl 3
Mg + 2HCl = MgCl 2 + H 2
CaO + 2HCl = CaCl 2 + H 2 O
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Pb(NO 3 ) 2 + 2HCl = PbCl 2 ↓ + 2HNO 3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
KCl — удобрение, используется также в стекольной и химической промышленности.
HgCl 2 — сулема — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
Hg 2 Cl 2 — каломель — не ядовита, слабительное средство.
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl 2 — для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра: 2AgCl = 2Ag + Cl 2
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
HCl → Cl 2 → AlCl 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 → Cl 2
№2. Расставьте коэффициенты методом электронного баланса в следующей реакции:
HCl + KClO 3 → KCl + H 2 O + Cl 2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
Источник
Соляная кислота
Модель молекулы соляной кислоты
Соля́ная кислота (хлористоводоро́дная кислота) — HCl, раствор хлористого водорода в воде ; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость (техническая соляная кислота желтоватая из-за примесей Fe , Cl2 и др.). Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см 3 . Слабые растворы соляной кислоты (до 0,4 %) имеют специфический терпко-кислый вкус, более концентрированные вызывают ожоги полости рта. Соли соляной кислоты называются хлоридами .
Содержание
Физические свойства [ ]
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
| Конц. (вес) c : кг HCl/кг | Конц. (г/л) c : кг HCl/м³ | Плотность ρ : кг/л | Молярность M | pH | Вязкость η : мПа·с | Удельная теплоемкость s : кДж/(кг·К) | Давление пара PHCl : Па | Т кипения т.кип. | Т плавления т.пл. |
| 10 % | 104,80 | 1,048 | 2,87 M | −0,5 | 1,16 | 3,47 | 0,527 | 103 °C | −18 °C |
| 20 % | 219,60 | 1,098 | 6,02 M | −0,8 | 1,37 | 2,99 | 27,3 | 108 °C | −59 °C |
| 30 % | 344,70 | 1,149 | 9,45 M | −1,0 | 1,70 | 2,60 | 1,410 | 90 °C | −52 °C |
| 32 % | 370,88 | 1,159 | 10,17 M | −1,0 | 1,80 | 2,55 | 3,130 | 84 °C | −43 °C |
| 34 % | 397,46 | 1,169 | 10,90 M | −1,0 | 1,90 | 2,50 | 6,733 | 71 °C | −36 °C |
| 36 % | 424,44 | 1,179 | 11,64 M | −1,1 | 1,99 | 2,46 | 14,100 | 61 °C | −30 °C |
| 38 % | 451,82 | 1,189 | 12,39 M | −1,1 | 2,10 | 2,43 | 28,000 | 48 °C | −26 °C |
При 20 °C, 1 атм (101 kPa)
При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства [ ]
Соляная кислота представляет собой типичную сильную одноосновную кислоту. В водных растворах диссоциирует практически полностью ( константа диссоциации 1·10 7 ):
Имеет следующие химические свойства:
- реагирует с металлами, стоящими в электрохимическом ряду металлов до водорода,
- с оксидами металлов (если образуется растворимая соль ),
- с гидроксидами металлов (если образуется растворимая соль),
- с солями металлов, образованных более слабыми кислотами (напр. угольной ),
- с сильными окислителями (перманганат калия, диоксид марганца ), выделяя хлор .
Производство [ ]
Соляную кислоту получают растворением газообразного хлороводорода в воде. Последний может быть получен действием концентрированной серной кислоты на хлорид натрия или сжиганием водорода в хлоре .
Применение [ ]
Промышленность [ ]
- Применяют в гидрометаллургии и гальванопластике ( травление , декапирование ), для очистки поверхности металлов при паянии и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с ПАВ используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции .
- В пищевой промышленности зарегистрирована в качестве регулятора кислотности , пищевой добавки E507. Применяется для изготовления зельтерской (содовой) воды .
Медицина [ ]
- Составная часть желудочного сока ; разведенную соляную кислоту ранее назначали внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Особенности обращения [ ]
Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги . Особенно опасно попадание в глаза. При открывании сосудов с соляной кислотой в обычных условиях образуется туман и пары хлороводорода , которые раздражают слизистые оболочки и дыхательные пути.
Реагируя с такими веществами, как хлорная известь , диоксид марганца , или перманганат калия, образует токсичный газообразный хлор .
Ссылки [ ]
| Основные хлорсодержащие неорганические кислоты | |||||
| Хлороводород Хлороводород(HCl) | Хлорноватистая кислота Хлорноватистая кислота (HClO) | ||||
| Хлористая кислота Хлористая кислота (HClO2) | Хлорноватая кислота Хлорноватая кислота (HClO3) | Хлорная кислота Хлорная кислота (HClO4) | |||
| Химическая посуда | Это незавершённая статья о неорганическом соединении . Вы можете помочь проекту, исправив и дополнив её. |
ar:حمض هيدروكلوريك bg:Солна киселина bs:Hlorovodonična kiselina ca:Àcid clorhídric cs:Kyselina chlorovodíková da:Saltsyre de:Salzsäure en:Hydrochloric acid es:Ácido clorhídrico et:Vesinikkloriidhape fa:اسید هیدروکلریدریک fi:Suolahappo fr:Acide chlorhydrique gl:Ácido clorhídrico he:חומצת מימן כלורי hr:Klorovodična kiselina id:Asam klorida is:Saltsýra it:Acido cloridrico ja:塩酸 ko:염산 lt:Druskos rūgštis lv:Sālsskābe mk:Хлороводородна киселина ms:Asid hidroklorik nl:Zoutzuur nn:Saltsyre no:Saltsyre pl:Kwas solny pt:Ácido clorídrico ro:Acid clorhidric scn:Àcitu clurìdricu simple:Hydrochloric acid sk:Kyselina chlorovodíková sl:Klorovodikova kislina sr:Хлороводонична киселина sv:Saltsyra th:กรดไฮโดรคลอริก tr:Hidroklorik asit uk:Хлоридна кислота vi:Axít clohiđric zh:盐酸
Источник
Соляная кислота
Соля́ная кислота́ (хлороводоро́дная, хлористоводоро́дная, хлористый водород) [1] — HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.), «дымящая» на воздухе, едкая жидкость. Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Молярная масса 36,46 г/моль. Соли соляной кислоты называются хлоридами.
Содержание
Физические свойства
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
| Конц. (вес) c : кг HCl/кг | Конц. (г/л) c : кг HCl/м³ | Плотность ρ : кг/л | Молярность M | pH | Вязкость η : мПа·с | Удельная теплоемкость s : кДж/(кг·К) | кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O. 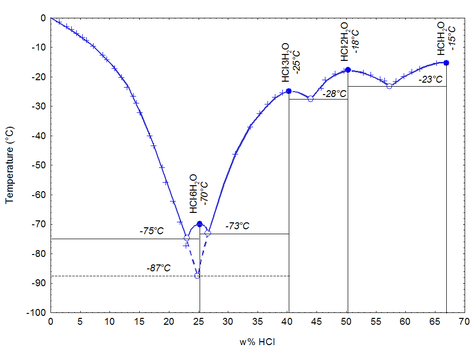 Химические свойства
ПроизводствоСоляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорирования углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Соляная кислота, полученная методом сжигания водорода в хлоре, содержит меньше примесей и применяется при необходимости высокой чистоты. В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии крепкой серной кислоты на поваренную соль: При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие: Возможно получение путем гидролиза хлоридов магния, алюминия (нагревается гидратированная соль): Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например: Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту. ПрименениеПромышленность
Медицина
Особенности обращенияСоляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При открывании сосудов с соляной кислотой в обычных условиях образуется туман и пары хлороводорода, которые раздражают слизистые оболочки и дыхательные пути. ПримечанияСсылки
Шаблон:АТХ код A09 Wikimedia Foundation . 2010 . ПолезноеСмотреть что такое «Соляная кислота» в других словарях:СОЛЯНАЯ КИСЛОТА — (НСl), водный раствор хлороводорода, бесцветного газа с резким запахом. Получают действием серной кислоты на поваренную соль, как побочный продукт хлорирования углеводородов, или реакцией водорода и хлора. Соляная кислота используется, для… … Научно-технический энциклопедический словарь Соляная кислота — – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов СОЛЯНАЯ КИСЛОТА — (хлористоводородная кислота) раствор хлористого водорода в воде; сильная кислота. Бесцветная, дымящая на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20 .С) 38% по массе,… … Большой Энциклопедический словарь СОЛЯНАЯ КИСЛОТА — (Acidum muriaticum, Acid, hydrochloricum), раствор хлористого водорода (НС1) в воде. В природе встречается в воде нек рых источников вулканического происхождения, а также находится в желудочном соке (до 0,5%). Хлористый водород может быть получен … Большая медицинская энциклопедия СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда СОЛЯНАЯ КИСЛОТА — (хлористоводородная кислота) НСl водный раствор хлористого водорода, сильная одноосновная кислота, летучая, с резким запахом; примеси железа, хлора окрашивают её в желтоватый цвет. Поступающая в продажи концентрированная С. к. содержит 37 %… … Большая политехническая энциклопедия соляная кислота — сущ., кол во синонимов: 1 • кислота (171) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов СОЛЯНАЯ КИСЛОТА — СОЛЯНАЯ КИСЛОТА, водный раствор хлористого водорода HCl; дымящая на воздухе жидкость с резким запахом. Применяют соляную кислоту для получения различных хлоридов, травления металлов, обработки руд, в производстве хлора, соды, каучуков и др.… … Современная энциклопедия Соляная кислота — СОЛЯНАЯ КИСЛОТА, водный раствор хлористого водорода HCl; дымящая на воздухе жидкость с резким запахом. Применяют соляную кислоту для получения различных хлоридов, травления металлов, обработки руд, в производстве хлора, соды, каучуков и др.… … Иллюстрированный энциклопедический словарь соляная кислота — (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь Источник |

















 [2]
[2] 

 Соляная кислота(HCl)
Соляная кислота(HCl) Хлорноватистая кислота(HClO)
Хлорноватистая кислота(HClO)  Хлористая кислота(HClO2)
Хлористая кислота(HClO2)  Хлорноватая кислота(HClO3)
Хлорноватая кислота(HClO3)  Хлорная кислота(HClO4)
Хлорная кислота(HClO4) 


