Кальцинированная сода
Кальцинированная сода
| Карбонат натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | карбонат натрия |
| Традиционные названия | кальцинированная сода |
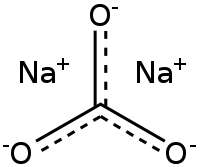
| Химическая формула | Na2CO3 |
| Отн. молек. масса | 106 а. е. м. |
| Молярная масса | 105.99 г/моль |
| Физические свойства | |
| Плотность вещества | 2.53 г/см³ |
| Термические свойства | |
| Температура плавления | 852 °C |
| Температура кипения | 1600 °C |
| Химические свойства | |
| pKa | 3.67 |
| Растворимость в воде при при 20 °C | 21,8 г/100 мл |
| Классификация | |
| номер CAS | 497-19-8 |
| номер EINECS | 207-838-8 |
Содержание
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5% кристаллизационной воды) — кристаллическая сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — питьевая или пищевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много, ранее считавшихся редкими, минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40% потребности страны в этом полезном ископаемом. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблана получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000°C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Сульфид натрия реагирует с карбонатом кальция:
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90% предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20°C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160°C, при этом он переходит в карбонат натрия:
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции:
возвращают в производственный цикл.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского поселка Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год.
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует карбонат кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Хоу.
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017°С переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27°C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а.е.м. | 286,14 а.е.м. |
| Температура плавления | 852°C (по другим источникам, 853°C) | 32°С |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см 3 (при 20°C) | 1,446 г/см 3 (при 17°C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Первая константа диссоциации угольной кислоты равна 4,5·10 -7 . Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Применение
Карбонат натрия используют в стекольном производстве, мыловарении и производстве синтетических моющих средств, эмалей, для получения ультрамарина. Также он применяется для умягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.[1]
Ссылки
Разное: Воск (E900-909) • Глазурь (E910-919) • Восстановитель (E920-929) • Газ для упаковки (E930-949) • Заменители сахара (E950-969) • Вспениватель (E990-999)
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Кальцинированная сода» в других словарях:
КАЛЬЦИНИРОВАННАЯ СОДА — то же, что карбонат натрия Na2CO3; см. Сода … Большой Энциклопедический словарь
Кальцинированная сода — более слабое щелочное средство в сравнении с едким натром. Представляет собой белый мелкокристаллический порошок, хорошо растворимый в воде. Горячие растворы кальцинированной соды хорошо омыляют жиры и гидролизуют белки. Источник: Санитарные… … Официальная терминология
кальцинированная сода — то же, что карбонат натрия Na2CO3; см. сода. * * * КАЛЬЦИНИРОВАННАЯ СОДА КАЛЬЦИНИРОВАННАЯ СОДА, то же, что карбонат натрия Na2CO3; см. Сода (см. СОДА) … Энциклопедический словарь
кальцинированная сода — natrio karbonatas statusas T sritis chemija formulė Na₂CO₃ atitikmenys: angl. calcined soda; soda ash; sodium carbonate rus. кальцинированная сода; натрий углекислый; натрия карбонат ryšiai: sinonimas – dinatrio trioksokarbonatas sinonimas –… … Chemijos terminų aiškinamasis žodynas
Кальцинированная сода — то же, что Натрия карбонат Na2CO3; см. также Сода … Большая советская энциклопедия
КАЛЬЦИНИРОВАННАЯ СОДА — то же, что карбонат натрия Nа2СОз; см. Сода … Естествознание. Энциклопедический словарь
КАЛЬЦИНИРОВАННАЯ СОДА — смотри Сода … Металлургический словарь
КАЛЬЦИНИРОВАННАЯ СОДА — кальцинированная сода, см. Натрия карбонат … Ветеринарный энциклопедический словарь
Источник
Сода кальцинированная
Сода кальцинированная (карбонат натрия) — соль, образованная катионом натрия и анионом угольной кислоты.
Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета.
Химическая формула – Na2CO3.
Сода кальцинированная – гигроскопичный продукт, на воздухе поглощает влагу и углекислоту с образованием кислой соли NaHCO3, при хранении на открытом воздухе слеживается.
Водные растворы соды кальцинированной имеют сильно щелочную реакцию. Выпускают соду кальцинированную марки А (гранулированная) и марки Б (порошкообразная).
Кальцинированная сода взрыво- и пожаробезопасна, относится к веществам 3-й степени опасности для организма человека. Вдыхание пыли может вызвать раздражение дыхательных путей, а при длительной работе с раствором кальцинированной соды возможны экземы, при попадании раствора в глаза может произойти ожег, поэтому при работе с кальцинированной содой необходимо использовать респиратор, защитные очки и защитный костюм.
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали, кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
В природе сода (карбонат натрия) встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
- нахколит NaHCO3
- трона Na2CO3∙NaHCO3∙2H2O
- натрон (сода) Na2CO3∙10H2O
- термонатрит Na2CO3∙Н2O.
Свойства карбоната натрия
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3∙10H2O |
| Молекулярная масса | 105,99 а.е.м. | 286,14 а.е.м. |
| Температура плавления | 852°C (по другим источникам, 853°C) | 32°С |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см3 (при 20°C) | 1,446 г/см3 (при 17°C) |
| Стандартная энтальпия образования ΔH | -1131 кДж/моль (т) (при 298 К) | -4083,5 кДж/моль ((т) (при 298 К) |
| Стандартная энергия Гиббса образования G | -1047,5 кДж/моль (т) (при 298 К) | -3242,3 кДж/моль ((т) (при 298 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль∙K (т) (при 298 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль∙K (жг) (при 298 К) |
Растворимость карбоната натрия в воде
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
CO32- + H2O ↔ HCO3- + OH-
Первая константа диссоциации угольной кислоты равна 4,5∙10-7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом кальция. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Область применения соды кальцинированной
Сода кальцинированная марок А и Б используется в производстве стекла всех видов, в том числе: хрусталя, оптического и медицинского стекла, стеклоблоков, пеностекла, силиката натрия растворимого, керамических плиток, компонента фритт для глазурей; черной и цветной металлургии: для производства свинца, цинка, вольфрама, стронция, хрома, для десульфуризации и дефосфации чугуна, в очистке отходящих газов, для нейтрализации сред.
Для производства электровакуумного стекла используется сода кальцинированная марки А высшего сорта со строго нормированным гранулометрическим составом.
Сода кальцинированная марки Б применяется в химической промышленности для производства синтетических моющих средств и жирных кислот, при очистке рассолов, в производстве фосфорных, хромовых, бариевых, натриевых солей как карбонатсодержащее сырье, в производстве глицеринов, аллилового спирта; целлюлозно-бумажной, анилино-красочной и лакокрасочной и нефтяной промышленностях.
Упаковка, транспортирование, хранение
Соду кальцинированную упаковывают в бумажные мешки массой 50 кг, мягкие специализированные контейнеры разового использования массой 800 кг (марка А) и 500 кг (марка Б).
Соду кальцинированную транспортируют насыпью – в содовозах и хопперах, упакованную в мягкие специализированные контейнеры перевозят по железной дороге в полувагонах и крытых вагонах.
Соду кальцинированную, упакованную в мешки, перевозят любым видом транспорта, предохраняя продукт от попадания влаги.
Источник