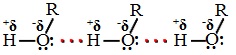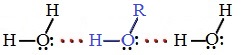Растворимость спиртов объясняется способностью образовывать с водой
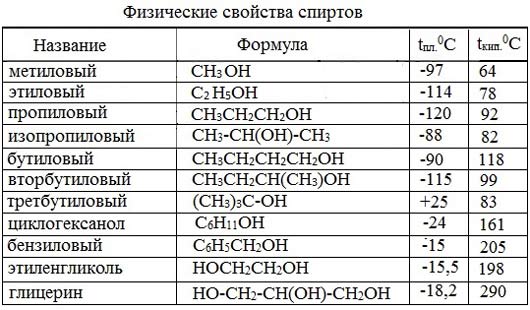
Метиловый спирт (метанол, карбинол, древесный спирт) – простейший одноатомный спирт, бесцветная жидкость (tкип= 64,5; tпл= -97; ρ= 0,793г/см 3 ), с запахом алкоголя, хорошо растворяется в воде, горюч. Пары метанола взрывоопасны. Пары метанола взрывоопасны. Сильный яд!
Метанол вызывает слепоту (достаточно 10 мл). При употреблении внутрь 70 мл и более наступает летальный исход. Смерть наступает от паралича верхних дыхательных путей.
Этиловый спирт (этанол, винный спирт) – бесцветная жидкость, с запахом спирта, хорошо смешивается с водой, ядовитое наркотическое вещество. Кипит при 78,3 0 С, замерзает при -114 0 С. Горит слабо светящимся пламенем. В виде ректификата (спирта, очищенного перегонкой) он содержит 95,6 % спирта и 4,4% воды.
Винный спирт – исторически сложившееся название, которое отражает, что этанол является основным компонентом винной продукции.
Этиловый спирт разрушает кровеносную, нервную, пищеварительную системы. Вызывает сильное привыкание и деградацию личности. При употреблении 300 мл, в перерасчете на чистый спирт, может вызвать смертельный исход.
Так как метанол и этанол фактически не отличить друг от друга, то большинство отравления суррогатным алкоголем связано с употреблением продукции, содержащей метиловый спирт вместо этилового.
А знаете ли вы?
Одноатомным спиртом является и холестерин. Его еще называют холестеролом. Холестерин – компонент желчи, играет важную роль в организме, из него синтезируются многие биологически активные соединения. Он участвует в обмене желчных кислот, в синтезе гормонов коры надпочечников и половых желез. Отложение холестерина на стенках сосудов приводит к атеросклерозу, а в желчном пузыре – к образованию желчных камней.
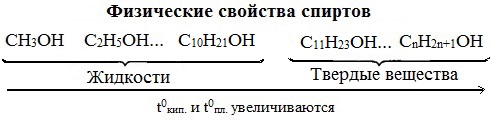
Низшие члены ряда предельных одноатомных спиртов, содержащие от одного до десяти атомов углерода, — жидкости. Высшие спирты (начиная с С11Н23ОН) при комнатной температуре — твёрдые вещества. Все алканолы легче воды, бесцветны. Низшие спирты имеют характерный алкогольный запах и жгучий вкус.
Полярность связи О-Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
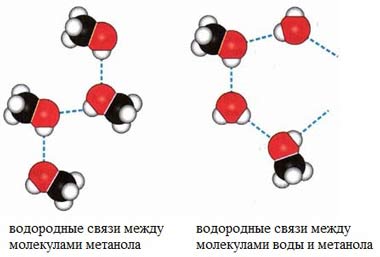
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.
Ассоциация молекул R-OH
Из-за способности образовывать водородные связи в гомологическом ряду спиртов нет газообразных веществ.
В водных растворах водородные связи образуются не только между молекулами спиртов, но также между молекулами спиртов и воды. Образованием водородных связей между молекулами спирта и воды объясняется их хорошая растворимость в воде.
Гидратация молекул R-OH
Водородные связи не прочны и при испарении спиртов легко разрываются.
Видеоопыт «Физические свойства спиртов»
С увеличением углеводородного радикала растворимость спиртов в воде уменьшается. Высшие спирты практически нерастворимы в воде. Метиловый, этиловый, н-пропиловый, изопропиловый спирты, а также этиленгликоль и глицерин смешиваются с водой в любых отношениях. Растворимость фенола в воде ограничена.
Источник
Растворимость спиртов объясняется способностью образовывать с водой
МЕТАНОЛ (древесный спирт) – жидкость ( t кип =64,5; t пл =-98; ρ = 0,793г/см 3 ), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
Особенности строения спиртов – спирты образуют водородные связи (обозначают точками) за счёт функциональной группы (-ОН)
А) Водородная связь между молекулами спиртов
Б) Водородная связь между молекулами спирта и воды
1) В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С,
а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
2) Способность спиртов образовывать межмолекулярные водородные связи не только влияет на их температуры кипения, но и увеличивает их растворимость в воде. Все алканы нерастворимы в воде, а низкомолекулярные спирты (метиловый, этиловый, н-пропиловый и изопропиловый) растворяются в воде неограниченно.
3) Отсутствие газов в гомологическом ряду предельных одноатомных спиртов.
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
· С–ОН с отщеплением ОН-группы
· О–Н с отщеплением водорода
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н + ) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О – свойства основания и нуклеофильного реагента.
С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксильных соединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных органических соединений.
RO — + H + ↔ ROH ↔ R + + OH —
Кислотные свойства уменьшаются в ряду, а основные возрастают:
вода первичный вторичный третичный
С активными щелочными металлами :
Алкоголяты подвергаются гидролизу, это доказывает,
что у воды более сильные кислотные свойства
С галогенводородными кислотами :
Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной способности происходит в следующих рядах:
первичные вторичные третичные
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с кислым раствором дихромата калия. Оранжевая окраска гидратированного иона Cr 2 O 7 2- исчезает и появляется зеленоватая окраска, характерная для иона Cr 3+ . Эта смена окраски позволяет определять даже следовые количества спиртов.
В более жёстких условиях окисление первичных спиртов идёт сразу до карбоновых кислот:
Третичные спирты устойчивы к окислению в щелочной и нейтральной среде. В жёстких условиях (при нагревании, в кислой среде) они окисляются с расщеплением связей С-С и образованием кетонов и карбоновых кислот.
2). Качественная реакция на первичные спирты!
(ацетальдегид – запах листвы)
3). Горение (с увеличением массы углеводородного радикала – пламя становится всё более коптящим)
III. Реакции отщепления
1) Внутримолекулярная дегидратация
В тех случаях, когда возможны 2 направления реакции, например:
дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена. Правило Зайцева: Водород отщепляется от наименее гидрированного атома углерода соседствующего с углеродом, несущим гидроксил.
2) Межмолекулярная дегидратация
— при переходе от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов; уменьшается способность образовывать простые эфиры.
3) Реакция дегидрирование и дегидратация предельных одноатомных спиртов – реакция С.В. Лебедева
IV. Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
ВАРИАНТ проведения урока:
1. Организационный момент: класс разбивается на группы 4-5человек.
Каждая группа получает карточку с понятием
номенклатура (дать название по формуле)
номенклатура (составить формулу по названию)
изученном на прошлом уроке и готовит к нему презентацию на доске или листе формата А3.
После повторения темы прошлого урока переходим к изучению нового материала.
2. Из строения молекул вытекают физические свойства спиртов с которыми мы с вами сейчас познакомимся по слайдам данной презентации.
Первый вариант: В молекулах спирта углеводородный радикал и атом Н находятся с атомом О не на одной прямой, а под углом108,5 0 .
У атома О есть свободная электронная пара и поэтому атом О может взаимодействовать с атомом Н другой молекулы, имеющим частичный «+»заряд в результате смещения электронов к атому О. Так между атомами возникает водородная связь, которая обозначается в формулах точками. За счет водородных связей молекулы спирта оказываются ассоциированными, как бы прилипшими друг к другу. Межмолекулярная водородная связь — невалентное взаимодействие между поляризованным атомом водорода одной молекулы и атомом ЭОЭ другой.
Водородная связь приблизительно в 10 раз слабее ковалентной.
Изучив физические свойства углеводородов, можно сделать заключение, что соединения с близкими молярными массами должны обладать и близкими температурами кипения.
Однако это соответствие далеко не всегда выполняется.
Например, t 0 кип. Пропана (М(С3Н8)=44г/моль равна -42 0 ,а этанола (М(С2Н5ОН)=46г/моль) +78 0 С.
Такое различие в значениях температуры кипения углеводорода и спирта, имеющих близкие молярные массы, объясняется тем, что молекулы способны соединяться друг с другом с участием межмолекулярных водородных связей, что приводит к более высоким температурам кипения и хорошей растворимости.
Все спирты легче воды. Низшие спирты (до С11) —бесцветные жидкости со специфическим запахом,
Высшие ( с С12)— твердые вещества. Наличие гидроксильных групп в молекулах спиртов способствует их растворимости в воде. С ростом молекулярной массы растворимость спиртов в воде падает.
Метанол и этанол смешиваются с водой в любых соотношениях .
Высшие спирты практически нерастворимы в воде.
Спирты разветвленного строения имеют более низкие температуры кипения, чем изомерные им неразветвленные.
Бутанол-1 tкип.=117,7 ° С
2-метилпропанол tкип.=108,4 ° С
Основными представителями одноатомных спиртов являются метанол и этанол.
Метанол или метиловый спирт (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Т оксичен , ядовит – вызывает слепоту,
смерть наступает от паралича верхних дыхательных путей.
Э танол или этиловый спирт (винный спирт, алкоголь ) – б/цв жидкость,
с запахом спирта, хорошо смешивается с водой в любых отношениях, поскольку группы -ОН этанола могут образовывать водородные связи с молекулами воды. Этанол содержится в винах, пиве и других спиртных напитках; так, в столовых винах примерно каждая двадцатая молекула является молекулой этанола.
Изучение химических свойств я предлагаю вам самостоятельно провести в группах.
Каждая группа должна подготовить презентацию своего ответа на примере метанола или этанола:
2.Основные свойства спиртов.
Подведение итогов выступлений представителей от группы и просмотр видеоопытов из единой коллекции ЦОР химических свойств.
Проверку усвоения материала х имические свойства предельных одноатомных спиртов классом проводится с помощью интерактив ЦОР:
Метанол ранее называли «древесный спирт»-т.к.раньше его получали перегонкой твердых пород древесины. В следовых количествах метанол содержится в молодом вине, в букет которого он вносит свой вклад. Но никогда не надо забывать, что метанол является ядом. Его токсичность связана с тем, что в организме человека под действием ферментов метанол превращается в муравьиную кислоту и формальдегид. Эти соединения повреждают сетчатку глаза, вызывают дегенерацию зрительного нерва и могут привести к постоянной слепоте. Если человек выпьет 50 мл метанола и более, то обычно наступает смерть.
Этиловый спирт хорошее антисептическое средство.
Алкоголь оказывает токсический эффект на ряд органов. Страдает сердечно-сосудистая система, мозг и нервная система,
желудок и поджелудочная железа, печень. Алкогольный цирроз печени — одно из наиболее тяжёлых и безнадёжных в смысле лечения заболевание человека. Цирроз печени как последствие потребления алкоголя , по данным ВОЗ , опубликованным в 1982 году, стал одной из основных причин смертности населения. А лкоголь играет значительную роль в увеличении частоты заболеваемости онкологическими заболеваниями, диабетом.
При длительном приёме спиртных «напитков» развивается хронический алкоголизм, имеющий свою клиническую картину, которая варьируется по стадии алкоголизма, но с характерной для всех пьющих особенностью — они стремятся найти повод для выпивки, а если повода нет — пьют без оного.
Экспериментами и наблюдениями над пьющими людьми установлено, что ядовитость алкоголя тем сильнее, чем выше его концентрация. Этим объясняется более заметное влияние крепких алкогольных «напитков» на развитие алкоголизма. Однако инициируется приобщение алкоголезависимых в будущем людей к потреблению этого наркотика — алкоголя — чаще всего пивом и слабоалкогольными изделиями. Таким образом, как бы ни были тяжелы последствия алкоголизма, однако не в нём сущность этой проблемы. Трагедия в самом потреблении алкоголя. Спиртные изделия с первой принятой дозы начинают уродовать жизнь человека и всего общества.
Смертельный исход: к ак всякий яд, алкоголь, принятый в определённой дозе, приводит к смертельному исходу. Путём многочисленных экспериментов установлено наименьшее количество яда из расчёта на килограмм массы тела, необходимое для отравления и гибели животного. Это так называемый токсический эквивалент. Из наблюдений над отравлением людей этиловым алкоголем выведен токсический эквивалент и для человека. Он равен 7-8 г. То есть для человека весом 64 кг смертельная доза будет равна 500 г чистого алкоголя.
Если сделать подсчёт для водки (40°), то окажется, что смертельная доза равняется 1200 г. Быстрота введения оказывает существенное влияние на ход отравления. Медленное введение несколько уменьшает опасность. При поступлении в организм смертельной дозы температура тела снижается на 3-4 градуса. Смерть наступает через 12-40 часов.
Домашнее задание: §21 (без получения и применения), упр.9 и 11, задачи 2, 4*, с. 88.
Источник