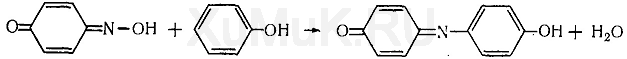- Фенолы
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Фенолы
- § 12. ФЕНОЛ
Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
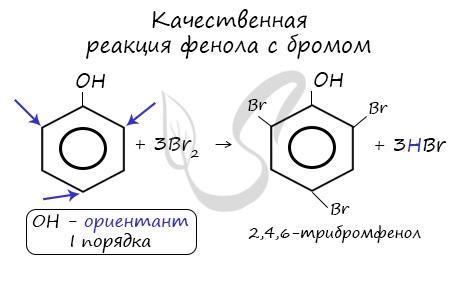
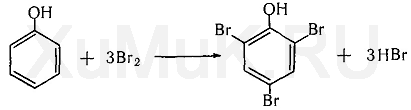
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
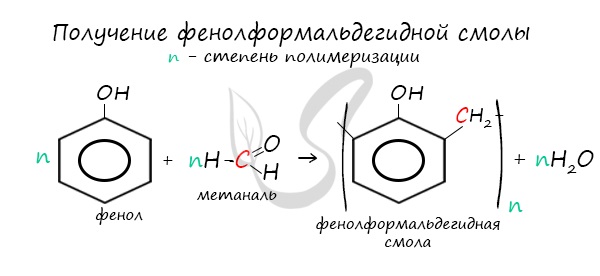
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
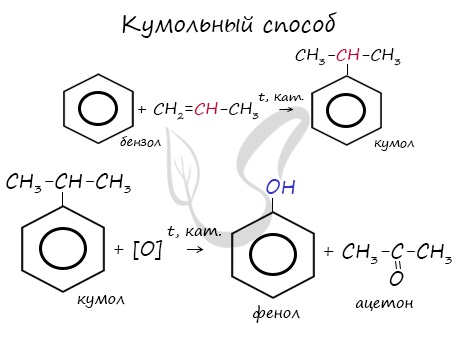
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Источник
Фенолы
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
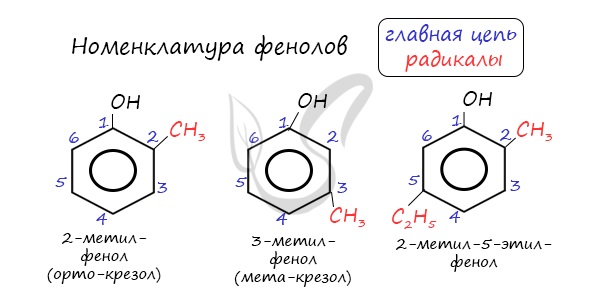
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
Химические свойства фенолов
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей — фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал — нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
§ 12. ФЕНОЛ
Фенол представляет собой тонкие длинные игольчатые кристаллы или бесцветную кристаллическую массу со своеобразным запахом. На воздухе он постепенно розовеет. Фенол растворяется в воде в соотношении 1 : 20, легко растворяется в этиловом спирте, диэти-ловом эфире, хлороформе, жирных маслах, растворах едких щелочей.
Применение. Действие на организм. Фенол применяется в медицинской практике как дезинфицирующее средство. Он широко используется в химической промышленности для получения многих химических соединений (красителей, пластических масс, фармацевтических препаратов, средств защиты растений).
Фенол всасывается в кровь через слизистые оболочки и кожу, а затем распределяется в органах и тканях. Фенол, поступивший в организм через пищевой канал, вызывает боли в желудке, рвоту, понос, иногда с примесями крови. Моча отравленных фенолом имеет оливковый или оливково-черный цвет. При пероральном поступлении в организм 10—15 г фенола наступает смерть. После вскрытия трупов лиц, отравленных фенолом, наибольшее количество его можно найти в почках, затем в печени, сердце, крови и головном мозгу.
Метаболизм. Часть фенола в организме связывается с белками, а ча-сть — подвергается окислению с образованием гидрохинона и пирокатехина. Несвязанный фенол и его метаболиты (гидрохинон и пирокатехин) выделяются с мочой в виде конъюгатов с сульфатами и глюкуроновой кислотой.
Выделение фенола из биологического материала. Фенол, содержащийся в трупном материале, выделяют путем перегонки с водяным паром, как и другие вещества этой группы ядов. В ряде случаев возникает необходимость производить обнаружение и количественное определение фенола в моче.
В моче людей и животных, отравленных фенолом, он может находиться в несвязанном виде и в виде конъюгатов с сульфатами или глюкуроновой кислотой. Для изолирования несвязанного фенола из мочи ее подкисляют слабым раствором уксусной кислоты, а затем фенол отгоняют с водяным паром. Дистиллят, в который может переходить как фенол, так и часть уксусной кислоты, нейтрализуют гидрокарбонатом натрия, а затем из дистиллята фенол экстрагируют органическим растворителем. Полученную вытяжку используют для обнаружения и количественного определения фенола.
Для обнаружения фенола используется часть третьего дистиллята, который вносят в делительную воронку, прибавляют раствор гидрокарбоната натрия до щелочной реакции. Содержимое делительной воронки 2—3 раза взбалтывают с новыми порциями диэтилового эфира по 10 мл. Эфирные вытяжки соединяют вместе и при комнатной температуре выпаривают досуха. Сухой остаток растворяют в 2—3 мл воды. Полученный раствор используют для обнаружения фенола при помощи реакций образования трибромфенола, индофенола, а также реакций с хлоридом железа (III), реактивом Миллона и др.
Реакция с бромной водой. От прибавления бромной воды к фенолу выпадает осадок трибромфенола:
Выполнение реакции. К 0,5—1,0 мл исследуемого раствора прибавляют 3—5 капель бромной воды. При наличии фенола в исследуемом растворе образуется желтовато-белый осадок трибромфенола. Эту реакцию дают крезолы, анилин и некоторые другие ароматические амины.
Приготовление реактива (см. Приложение 1, реактив 3).
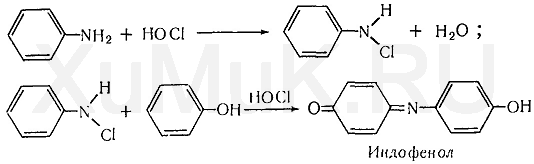
Индофеноловая реакция. При окислении смеси фенолов и аминов (в том числе и аммиака) образуются индофенолы, имеющие соответствующую окраску:
При выполнении индофеноловой реакции в качестве окислителей могут быть использованы гипохлорит натрия, хлорная известь, хлорная или бромная вода, пероксид водорода и др. Окислителем также может быть кислород воздуха.
Выполнение реакции. К 0,5—1,0 мл исследуемого раствора прибавляют 1 каплю анилина и 2 мл раствора гипохлорита натрия. Появление грязно-фиолетовой окраски указывает на наличие фенола в пробе. После прибавления аммиака появляется устойчивая синяя окраска.
Индофеноловую реакцию дают фенолы, имеющие свободное параположение, крезолы и другие соединения, содержащие фенольную группу.
Приготовление реактива (см. Приложение 1, реактив 10).
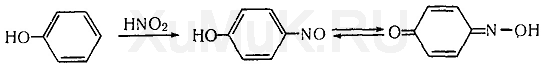
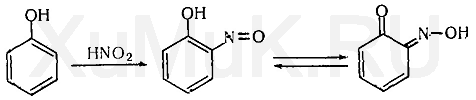
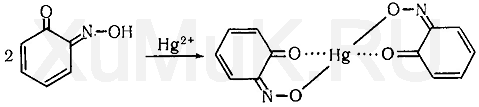
Реакция Либермана. Эта реакция также основана на образовании индофенола. В качестве реактивов на фенолы применяют нитрит натрия и серную кислоту. При взаимодействии нитрита натрия и серной кислоты образуется азотистая кислота, которая с фенолом образует n -нитрозофенол, при изомеризации которого образуется n -хиноидоксим:
При взаимодействии хиноидоксима с избытком фенола образуется индофенол, имеющий синюю окраску:
Выполнение реакции. 1—2 капли исследуемого раствора (лучше брать раствор исследуемого вещества в диэтиловом эфире) вносят в маленький тигель и выпаривают досуха. К сухому остатку прибавляют каплю 1 %-го свежеприготовленного раствора нитрита натрия в концентрированной серной кислоте и смесь оставляют на несколько минут. После охлаждения смеси по каплям прибавляют 4 н. раствор гидроксида натрия до щелочной реакции (по лакмусу). Появление синей окраски, которая может переходить в красную, а затем в зеленую, указывает на наличие фенола в пробе. Реакцию Либермана дают некоторые фенолы, эфиры фенолов, тиофен и др. Не дают этой реакции нитрофенолы, паразамещенные фенолы и др.
Выполнение реакции. 1—2 капли исследуемого раствора помещают на фарфоровую пластинку или в маленькую фарфоровую чашку и прибавляют 1—2 капли свежеприготовленного 5 %-го раствора хлорида железа (III). При наличии фенола появляется фиолетовая или сине-фиолетовая окраска, исчезающая от прибавления воды, спирта и кислот.
С хлоридом железа (III) дают окраску крезолы, оксипиридины, оксихинолин и ряд других веществ, содержащих фенольные группы. Состав и окраска образующихся соединений зависят от природы исследуемых веществ, растворителей и рН среды. о -Крезол и n -крезол с хлоридом железа (III) дают синюю окраску, а м -крезол — красно-фиолетовую.
Реакция с реактивом Миллона. При взаимодействии фенола с реактивом Миллона (смесь нитратов одно- и двухвалентной ртути, содержащая азотистую кислоту) появляется красная или оранжевая окраска. При малых количествах фенолов возникает желтая окраска. Нагревание ускоряет эту реакцию. Вероятно, что при этой реакции вначале образуется 2-нитрозофенол, который переходит в 1,2-хинонмоноксим:
Выполнение реакции. В микротигель вносят 1—2 капли исследуемого раствора, прибавляют 1—2 капли реактива Миллона и оставляют на несколько минут. Если за это время не произойдет изменение окраски, то смесь нагревают до кипения и кипятят несколько минут. Появление красной окраски указывает на наличие фенола в пробе. Эту реакцию дают некоторые фенолы, анилин, эфиры фенолов, которые при нагревании образуют фенол. Эта реакция часто используется для обнаружения пара-замещенных фенола, которые не могут быть обнаружены при помощи реакции Либермана.
Приготовление реактива (см. Приложение 1, реактив 39).
Реакция с бензальдегидом. При нагревании фенолов в кислой среде с бензальдегидом (как и с рядом других альдегидов) образуется бесцветный продукт конденсации, при окислении которого возникает окраска. Концентрированная серная кислота при этой реакции играет роль дегидратирующего и конденсирующего вещества, а также роль окислителя.
Выполнение реакции. В пробирку вносят 0,1—0,5 мл исследуемого раствора, 2 мл концентрированной серной кислоты и 1— 2 капли бензальдегида. При нагревании смеси до кипения появляется темно-красная окраска. После охлаждения смеси и прибавления к ней 10 мл воды и 10 %-го раствора гидроксида натрия до щелочной реакции (по лакмусу) окраска переходит в сине-фиолетовую. При взбалтывании этого раствора с диэтиловым эфиром или хлороформом окраска переходит в слой органического растворителя. Эту реакцию дают фенол и о-крезол. Другие крезолы не дают этой реакции.
Метод микродиффузии. Этот метод, основанный на реакции с реактивом Фолина — Чиокальто, применяется для обнаружения фенола в моче, крови и гомогенатах тканей. Подробно этот метод описан выше (см. гл. III, § 3).
Источник