- Реакция едкой щелочи с водой
- Щёлочи – наши помощники
- Получение оснований
- Свойства оснований
- Безопасность в работе со щелочами
- Что за вещество «нашатырный спирт»?
- Применение оснований
- Щелочные продукты питания
- Приготовление раствора едкого натра (каустической соды). Свойства, получение, применение. Техника безопасности.
- Содержание статьи
- 1. Химические свойства едкого натра
- 2. Физические свойства едкого натра
- 3. Способы производства едкого натра
- Химические способы:
- Электрохимические методы получения гидроксида натрия:
- 4. Техника безопасности при работе с едким натром
- 5.Приготовление раствора каустической соды (едкого натра)
- 5.1. Определение содержания каустической соды в растворе
- 5.2. Определение содержания каустической соды в сухом веществе
- 5.3. Расчет количества сухого едкого натра для приготовления рабочего раствора
- 5.4. Расчет количества концентрированного раствора едкого натра для приготовления рабочего раствора щелочи
- 6.Оказание первой помощи при отравлениях и химических ожогах каустической содой
- 7. Установка для безопасного растворения каустической соды
- Растворение едкого натра (каустической соды) в воде (видео)
Реакция едкой щелочи с водой
53. Едкие щелочи
Щелочи образуют гидроксиды щелочных металлов 1 группы главной подгруппы при растворении их в воде.
Физические свойства: растворы щелочей в воде мылкие на ощупь, они разъедают кожу, ткани, бумагу – едкие щелочи (едкий натр NaOH, едкий калий КОН). На коже они вызывают долго незаживающие раны. Очень гигроскопичны.
Химические свойства LiOH, NaOH, КОН, RbOH, CsOH. В этом ряду сила и растворимость щелочей возрастает, что связано с увеличением размеров ионов щелочных металлов (катионов) и ослаблением электростатического притяжения с гидроксидной группой (анионом). К щелочам относится гидроксид щелочно-земельного металла бария – Ва(ОН)2.
Щелочи – сильные основания, химически очень активные вещества. При растворении их в воде выделяется большое количество теплоты.
В водном растворе идет диссоциация щелочей:
Химические свойства щелочей:
1) щелочи вступают в реакцию нейтрализации с кислотами, образуя соль и воду:
2) взаимодействуют с кислотными оксидами, образуя как средние, так и кислые соли:
3) вступают со средними солями в реакцию обмена: CuSO4 + KOH = Cu(OH)2 + K2SO4, с кислыми солями: NaНSO4 + KOH = Na2SO4 + К2SO3 + H2O (окислительно-восстановительная);
4) растворы щелочей вступают в реакцию с амфотерными оксидами – образуются комплексные соли: Al2O3 + NaOH + 7Н2О = 2Na[Al(ОН)4(Н2О)2];
5) при сплавлении твердых щелочей с оксидами амфотерных металлов образуются двойные безводные соли: Al2O3 + 2NaOH = 2NaAlO2 (метаалюминат натрия);
6) взаимодействуют с галогенами в зависимости от температурных условий – на холоде: Cl2 + 2NaOH = NaClO + NaCl + H2O, при нагревании: 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O;
7) взаимодействуют с некоторыми органическими веществами: С2Н5ОН + NaOH = С2Н5ОNa + Н2О;
8) растворы и расплавы щелочей подвергаются электролизу
1) реакция металлов с водой: 2К + 2H2O = 2KOH + H2;
2) реакция оксидов металлов с водой: 2К2О + 2H2O = 2KOH.
Применение: NaOH и KOH используют в производстве мыла, бумаги, в текстильной промышленности и др.
Источник
Щёлочи – наши помощники
Основания состоят из положительно заряженных ионов металла и гидроксид-ионов ОН-. Щёлочи — это основания, которые хорошо растворимы в воде.
Сведения о растворимости в воде можно брать из таблицы растворимости. Р – растворимые основания, то есть щёлочи, м – малорастворимые, н – нерастворимые, черта «–» означает, что такого основания не существует.

В обычных условиях являются твёрдыми веществами. Имеют вид белых порошков, легко впитывающих влагу. Требуют хранения в банках из толстого стекла с широким горлышком или полиэтиленовых емкостях.
Получение оснований
Щёлочь образуется в результате реакции металла и воды с большим выделением теплоты.
2Na + 2H2O>2NaOH + H2
CaO + H2O>Ca(OH)2.
Гидроксиды натрия и калия образуются при воздействии на раствор электрического тока:
KCl + 2H2O>2KOH + H2 + Cl2.
Свойства оснований
Щёлочи реагируют
1. С кислотными оксидами:
2КОН+SO3>K2SO4+H2O.
Щёлочи способны растворять оксидную плёнку алюминия (амфотерного оксида):
2. С кислотами:
NaOH+HCl>NaCl+HOH.
Можно определить, осталась ли щёлочь, если добавить 1-2 капли раствора фенолфталеина. Щёлочь прореагировала полностью, если малиновый цвет окрашивания раствора не появился.
Реакция между основанием и кислотой – реакция нейтрализации. Подобные реакции часто применяют с целью очищения сточных вод промышленных предприятий от щелочей и кислот. Продукты таких реакций – соли, которые более безопасны для окружающей среды. Очень эффективной и экономически выгодной является нейтрализация стоков различных производств.
3. С солями. Это реакции обмена. Происходят в растворе, при этом исходная соль должна быть водорастворимой. А получаемое вещество – нерастворимым:
2NaOH+Mn(NO3)2=Mn(OH)2v+2NaNO3
4. С галогенами.
На холоде: Cl2 + 2NaOH = NaClO+NaCl+H2O.
При нагревании: 3Cl2+6NaOH = NaClO3+5NaCl+3H2O.
Расплавить можно только гидроксиды натрия и калия (температуры плавления соединений составляют 322о и 405о соответственно).
Безопасность в работе со щелочами
Химические ожоги, причиняемые щелочами, в том числе едким натром и едким кали, намного опаснее, чем химические ожоги от кислот. Ожог усугубляется, если кусочек кристаллического вещества прилипает к коже.
Щёлочи способны разъедать много материалов, вызывать серьёзные ожоги на коже и слизистых оболочках, поражать глаза. Поэтому гидроксид натрия называют «едким натром», а гидроксид калия – «едким кали». При работе со щелочами и их растворами, нужно соблюдать осторожность. При попадании раствора щелочи на кожу, нужно сразу смыть его большим количеством воды. Затем обработать это место слабым раствором уксусной или борной кислоты. И опять промыть водой.
Что за вещество «нашатырный спирт»?
Жидкость с названием «нашатырный спирт» — это водный раствор газа аммиака NH3. Его используют, как лекарственный препарат. В нашатырном спирте содержатся основание NH4OH (гидроксид аммония). Образуется в результате реакции:
NH3+H2O- NH4OH.
Во взаимодействие вступает небольшое количество растворённого аммиака и одновременно распадается на исходные вещества, на что указывает знак «-» в уравнении. Гидроксид аммония, подобно щелочам, изменяет окрашивание индикатора, взаимодействует с кислотными оксидами, кислотами и солями.
2NH4OH+СО2>(NH4)2СО3+H2O
NH4OH+HCl>NH4Cl+H2O
NH4OH+Pb(NO3)2>Pb(OH)2v+2NH4NO3.
Применение оснований

Нашатырный спирт используют не только для того, чтобы привести человека в сознание. С его помощью можно отлично вымыть окна, используя 1 столовую ложку препарата на 1 литр воды. Затем нужно вытереть поверхность бумажными полотенцами.
Если смешать 1 часть нашатырного спирта с 1 частью уксуса, а потом протирать полученным раствором поверхность утюга, то он станет чистым. Но не стоит думать, что получится мгновенный эффект. Поверхность нужно аккуратно потереть.
Широко применяют, прежде всего, гидроксиды кальция и натрия. Гашёная известь – это гидроксид кальция Сa(OH)2. Её используют, как вяжущий материал в строительстве. Смешивают с песком и водой. Полученную смесь наносят на кирпич, штукатурят стены. В результате взаимодействия основания с углекислым газом и оксидом силициума (IV), смесь твердеет. Известь способна поглощать кислые газы. Также может впитывать токсичные вещества, поэтому для здоровья жильцов белить комнату предпочтительнее, чем красить.
Также гидроксид кальция используют в сахарной промышленности, сельском хозяйстве, при изготовлении зубных паст, получении многих веществ.
Гидроксид натрия (каустическую соду) используют при производстве мыла в реакции щёлочи с жиром, при изготовлении лекарств, в кожной промышленности, для очищения нефти. Каустическая сода применяется для чистки масляных пятен. Всем известный «Крот» для труб представляет собой раствор гидроксида натрия, способный растворять жиры и даже волосы.

Щёлочи разъедают стекло и фарфор. Растворяют белковые вещества.
Применяются в медицине в качестве антисептиков, раздражающих и прижигающих препаратов. При заболеваниях пищеварительной системы щелочные минеральные воды действуют оздоравливающе. Эффективны в лечении подагры, стоматита, в лечении заболеваний дыхательной системы. Являются мочегонным средством. Нейтрализуют отравление кислотами.
Немаловажно участие щелочей в изготовлении каучука, искусственного волокна, красителей, очищения предметов из металла, обработки деревянных поверхностей. Являются хладагентом холодильных установок. Используются в сельском хозяйстве, лёгкой промышленности и металлургии.
Щелочные продукты питания
Различают кислые, щелочные и нейтральные продукты питания. Среди щелочных продуктов можно перечислить зелень, репу, огурцы, хрен, сельдерей, лимоны, свеклу, морковь, капусту, цитрусовые, смородину, виноград, вишню, сухофрукты, картофель, перец, помидоры, чеснок.

Примечательно, что в составе нейтральных продуктов содержатся и кислоты, и щёлочи. Это растительное, сливочное масло.
Интересно, что молоко — это щелочной продукт. Но тёплое или кипячёное молоко – кислый продукт.
Щёлочи активно используются человеком. При этом следует помнить и в обязательном порядке соблюдать правила техники безопасности.
Источник
Приготовление раствора едкого натра (каустической соды). Свойства, получение, применение. Техника безопасности.
Содержание статьи
 1. Химические свойства едкого натра
1. Химические свойства едкого натра
Едкий натр (другие названия: гидроксид натрия, каустик, каустическая сода, натриевая щелочь) – пожалуй, наиболее распространённая щелочь. Химическая формула NaOH. Гидроксид натрия состоит из двух ионов: катиона натрия (Na+) и гидроксид-аниона (OH−). Эти ионы формируют едкий натр, связываясь между собой за счет электростатического притяжения разнозаряженных частиц. В растворе едкий натр полностью диссоциирует на ионы – является мощным электролитом. Водные растворы каустика проявляют сильную щелочную реакцию (pH 1%-раствора = 13). Основным методом определения едкого натра в растворе является реакция на гидроксид-ион (OH−). Чем больше гидроксид-ионов в растворе щелочи, тем щелочь сильнее и индикатор интенсивнее проявляет цвет.
Каустик вступает в реакцию с амфотерными оксидами и гидроксидами, кислотами, кислотными оксидами, солями, неметаллами (серой, фосфором), галогенами, металлами, амидами, эфирами, алкилгалогенидами, жирами, многоатомными спиртами.
2. Физические свойства едкого натра
Пр
Раствор едкого натра более удобен в применении, поэтому каустическая сода чаще всего используется в виде раствора.
Каустик используется в следующих отраслях промышленности:
– автомобильная (при производстве щелочных аккумуляторов)
– пищевая (в качестве пищевой добавки, для очистки оборудования)
– целлюлозно-бумажная (изготовления картона, бумаги, древесно-волоконных плит и пр.)
– химическая (для нейтрализации кислот, производства моющих средств и различных масел, титрования алюминия, получения чистых металлов, солей, оснований и органических соединений; едкий натр применяется также в качестве катализатора реакций)
– дегазация и нейтрализация отравляющих веществ
– фармакология (производство лекарств)
– легкая промышленность (при производстве шелка, а также в качестве отбеливателя для тканей)
3. Способы производства едкого натра
Химические способы:
- Известковый способ – заключается в реакции между гашеной известью и карбонатом натрия при температуре 80 ° С. В результате образуются едкий натр и осадок карбоната кальция. Методом фильтрации осадок отделяют, а оставшийся раствор упаривают до получения массы, содержащей около 92% едкого натра. Полученный едкий натр плавят и перекачивают в стальные барабаны, где он кристаллизуется.
- Ферритный способ – при высокой температуре (800-900° С) карбонат натрия спекают с трехвалентным оксидом железа. Образовавшийся феррит натрия NaFeO2 подвергают воздействию воды. NaFeO2 разлагается с образованием раствора едкого натра (содержание NaOH ≈ 400 г/л) и осадка железа с водой (Fe2O3*H2O). Осадок отделяют и возвращают в процесс, а раствор каустической соды выпаривают до белых кристаллов с содержанием NaOH ≈ 92%.
- Пиролитический – карбонат натрия прокаливают при температуре ≈ 1000 °C. Полученный в результате оксид натрия Na2О охлаждают. Затем в оксид натрия осторожно (выделяется большое количество тепла) добавляют воду.
Электрохимические методы получения гидроксида натрия:
Существует три электрохимических метода:
– мембранный и диафрагментарный (электролиз с твёрдым катодом),
– ртутный (электролиз с жидким ртутным катодом).
В Российской Федерации ориентировочно 65 % едкого натра производится электролизом с твёрдым катодом и 35 % электролизом с ртутным катодом.
Согласно ГОСТу 2263-79 выпускаются следующие марки гидроксида натрия:
- РР — раствор ртутный
- РД — раствор диафрагменный
- РХ — раствор химический
- ТД — твёрдый диафрагменный (плавленый)
- ТР — твёрдый ртутный (чешуированный)
4. Техника безопасности при работе с едким натром
Раствор каустической соды в транспортировке неудобен, опасен и, соответственно, дорог. Его проще перевозить в сухом состоянии. Но при этом возникает вопрос приготовления раствора щелочи на предприятии. Процесс растворения каустической соды в воде небезопасен, т.к. вещество относится к вредным веществам 2 класса опасности (ГОСТ 12.1.007). Вызывает ожоги и изъязвления кожи, повреждает слизистые глаз и верхних дыхательных путей.
Растворение гидроксида натрия осложняется выделением значительного количества тепла. Например, при растворении 25 кг едкого натра в 29,3л воды (для получения 46% раствора) температура раствора поднимается с 15 о С до 241 о С.
К работе с натриевой щелочью допускаются лица, достигшие 18 лет, прошедшие предварительно медицинское освидетельствование, не имеющие противопоказаний к выполнению соответствующих работ.
Работник до назначения его на самостоятельную работу с едким натром обязан пройти производственное обучение безопасным методам работы, проверку знаний, стажировку на рабочем месте под наблюдением и руководством опытного сотрудника.
Работать с каустической содой разрешается только в костюме с фартуком, резиновых сапогах, резиновых перчатках, респираторе и защитных очках. Для защиты кожи рук следует также применять силиконовый крем, который наносится на кожу рук перед началом работы.
Все операции с едким натром следует выполнять лишь:
– при работающей общеобменной вентиляции помещения;
– в вытяжном шкафу;
– с применением средств индивидуальной защиты.
При приготовлении раствора щелочи ВСЕГДА засыпайте сухой едкий натр в воду! Не лейте воду в едкий натр – вы рискуете создать тепловой взрыв. Если натриевая щелочь засыпается в воду, неконтролируемой бурной термической реакции не будет.
Чтобы избежать кипения раствора, внимательно просчитывайте пропорции воды и каустика!
5.Приготовление раствора каустической соды (едкого натра)
Гидроксид натрия поступает на предприятие:
– в жидком виде (с массовой долей NaOH не менее 40 %)
– в сухом виде (чешуированный, гранулированный; с массовой долей NaOH не менее 98,5 %)
Прежде чем приступить к приготовлению рабочего раствора щелочи, рекомендуется определить содержание NaOH в жидком/сухом едком натре.
5.1. Определение содержания каустической соды в растворе
Содержание едкого натра в растворе можно определить двумя способами:
1. Методом титрования:
Один миллилитр раствора каустика заливается в мерную колбу (емкостью 100 мл), доливается водой до метки и перемешивается. Отмеряется 10 мл полученного раствора в колбу титрования, добавляется 2-3 капли фенолфталеина или метилоранжа, титруется 0,1 н раствором соляной кислоты HCl до обесцвечивания. Содержание NaOH (К, в граммах на литр) определяется по формуле:
К = 40 * А
А – объем (в мл) 0,1 н раствора соляной кислоты, использованной в титровании.
С помощью денсиметра (с делениями шкалы от 1,00 до 1,530) измеряется плотность раствора. По таблице плотности раствора едкого натра определяется содержание NaOH (г/л):
Таблица плотности растворов едкого натра при температуре 20 оС
5.2. Определение содержания каустической соды в сухом веществе
Навеска в 4 грамма едкого натра как можно скорее растворяется в свежепрокипяченной дистиллированной воде. Полученный раствор переливается в мерную литровую колбу и после охлаждения доводится до метки. Отмеряется 50 мл раствора, титруется 0,1 н раствором соляной кислоты HCl с 3-4 каплями метилоранжа до появления оранжево-розового окрашивания. Содержание едкого натра (X, в процентах) рассчитывается по формуле:
Х = а * 0,004 * 1000 * 100 / (c * 50)
а – объем (в мл) 0,1 н раствора соляной кислоты, использованной в титровании;
с – вес (в г) навески едкого натра;
0,004 – масса (в гр) едкого натра соответствующее 1 мл 0,1 н раствора соляной кислоты;
50 – объем (в мл) раствора едкого натра, использованное в титровании.
5.3. Расчет количества сухого едкого натра для приготовления рабочего раствора
Ориентировочное количество каустической соды (в кг), необходимое для получения раствора заданной концентрации, определяется по формуле (1):
m (NaOH) = Vр-ра * Pр-ра * С1(%) / С2(%), кг (1)
Vр-ра – объем приготавливаемого раствора, м 3 ;
Pр-ра – плотность приготавливаемого раствора, кг/м 3 (плотность раствора определяется по справочной таблице «Таблица плотности растворов едкого натра при температуре 20 о С);
С1 – концентрация приготавливаемого раствора, %;
С2 – содержание в товарном продукте, %.
Ориентировочное количество исходной воды (в кг), необходимое для получения раствора щелочи заданной концентрации, определяется по формуле (2):
m (воды) = Vр-ра * Pр-ра – m (NaOH), кг (2)
Vр-ра – объем приготавливаемого раствора, м 3 ;
Pр-ра – плотность приготавливаемого раствора, кг/м 3 (плотность раствора определяется по таблице плотности растворов едкого натра);
m (NaOH) – масса NaOH в приготавливаемом растворе, кг, определяемая по формуле (1).
Ориентировочное количество приготавливаемого раствора (в кг) определяется по формуле (3):
mр-ра = mв-ва * С2 (%) / С1(%), кг (3)
mр-ра – масса приготавливаемого раствора, кг;
mв-ва – масса едкого натра, кг;
С1 – концентрация приготавливаемого раствора, %;
С2 – содержание едкого натра в товарном продукте, %.
Пример. Расчет ориентировочного количества воды, необходимого для получения 4%-го раствора каустической соды при растворении мешка массой 25 кг
Ориентировочное количество исходной воды в кг, необходимое для получения раствора заданной концентрации, определяется по формуле (2):
m (воды) = mр-ра – mв-ва (2)
mр-ра – масса раствора, кг;
mв-ва – масса едкого натра, кг.
Таким образом, при растворении мешка едкого натра массой 25 кг (при содержании едкого натра в товарном продукте – 99 %):
– по формуле (1) определяем массу 4%-го раствора едкого натра:
mр-ра = 25 * 99 / 4 = 618,8 (кг)
– по формуле (2) определяем ориентировочное количество исходной воды в кг:
m (воды) = 618,8 – 25 = 593,8 (кг)
5.4. Расчет количества концентрированного раствора едкого натра для приготовления рабочего раствора щелочи
Требуемое количество концентрированного раствора гидроксида натрия рассчитывается по формуле:
А = Б х В х 1000 / К
А – количество концентрированного раствора гидроксида натрия (в мл);
Б – количество необходимого рабочего раствора (в литрах);
В – содержание NaOH в 1 л рабочего раствора (в г);
К – содержание NaOH в 1л концентрированного раствора щелочи (в граммах на литр)
Пример. Расчет ориентировочного количества 46%-го раствора гидроксида натрия (684,2 г/л), требующегося для приготовления 100л 5%-го раствора (52,69 г/л).
100*52,69*1000/684,2 = 7 701 мл (7,7л)
Соответственно, чтобы приготовить 100л 5%-го раствора требуется в 7,7л 46% раствора долить воды до 100 л.
6.Оказание первой помощи при отравлениях и химических ожогах каустической содой
При отравлении едким натром (NaOH)
Вдыхание теплого водяного пара (в воду добавить немного лимонной кислоты).
При попадании в органы пищеварения – смазывание слизистых оболочек рта и горла 1% раствором новокаина. Внутрь по столовой ложке 1% раствора лимонной или винной кислоты каждые 3÷5 мин, крахмальный клейстер с добавлением тех же или уксусной кислот, 2÷3 столовые ложки растительного масла. Внутрь кусочки льда. Обратиться к врачу.
При химических ожогах едким натром (NaOH)
Обильное промывание водой в течение 10 минут, примочки из 5% раствора уксусной, виннокаменной, или лимонной кислоты. Обратиться к врачу.
При попадании едкого натра (NaOH) в глаза
Тщательное промывание глаз струей воды или физиологическим раствором поваренной соли в течение 10÷30 мин. Затем закапать 2% раствор новокаина или 0,5% раствор дикаина. Обратиться к врачу.
7. Установка для безопасного растворения каустической соды
ООО «КВАНТ МИНЕРАЛ» разработало установку для безопасного растворения едкого натра в воде, исключающую прямой контакт человека с сухой щелочью и концентрированными растворами.
Растворение едкого натра (каустической соды) в воде (видео)
Растворение едкого натра (каустической соды) в воде (видео)
Источник
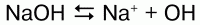
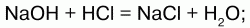
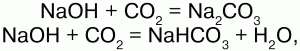
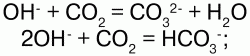
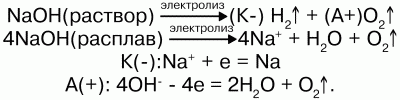
 1. Химические свойства едкого натра
1. Химические свойства едкого натра



