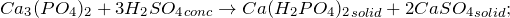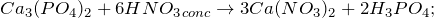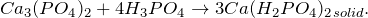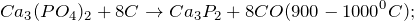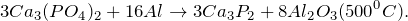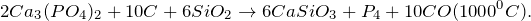- Фосфат кальция
- Характеристики и физические свойства фосфата кальция
- Получение фосфата кальция
- Химические свойства фосфата кальция
- Применение фосфата кальция
- Примеры решения задач
- Ca3(PO4)2 + H2O = ? уравнение реакции
- Фосфат кальция, характеристика, свойства и получение, химические реакции
- Фосфат кальция, характеристика, свойства и получение, химические реакции.
- Краткая характеристика фосфата кальция:
- Физические свойства фосфата кальция:
- Получение фосфата кальция:
- Фосфат кальция — основные характеристики, свойства и области применения
- Основные характеристики
- Другие соединения фосфатов
- Роль в организме человека
- Ключевые источники
- Влияние добавок на человека
Фосфат кальция
Характеристики и физические свойства фосфата кальция
Существует в виде двух полиморфных модификаций: моноклинной и гексагональной.
Рис. 1. Фосфат кальция. Внешний вид.
Основные характеристики фосфата кальция приведены в таблице ниже:
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Растворимость в воде (20 o С), % (масс.)
Получение фосфата кальция
Лабораторные способы получения фосфата кальция предполагают действие ортофосфорной кислоты на соли кальция (1) или гидроксид кальция (2):
Химические свойства фосфата кальция
Фосфат кальция – это средняя соль, образованная сильным основанием – гидроксидом кальция (Ca(OH)2) и слабой кислотой – ортофосфорной (H3PO4). В водном растворе гидролизуется. Гидролиз протекает по аниону (теоретически возможны вторая и третья ступень). Наличие анионов ОН — свидетельствует о щелочном характере среды.
3Ca 2+ + 2PO4 3- + HOH ↔ HPO4 2- + 3Ca 2+ + OH — ;
Для фосфата кальция характерны все свойства солей:
— взаимодействие с сильными минеральными кислотами
— взаимодействие с солями, в результате которого одним из продуктов реакции является нерастворимое в воде соединение
— разложение при нагревании
Применение фосфата кальция
Фосфат кальция нашел применение в качестве добавки при производстве кормов для КРС и домашних птиц. Его используют при производстве минеральных удобрений, керамики и стекла. В пищевой промышленности фосфат кальция известен как добавка Е341 – разрыхлитель.
Примеры решения задач
| Задание | Вычислите массу фосфата кальция, который может прореагировать с концентрированным раствором соляной кислоты объемом 100 мл (массовая доля HCl 34%, плотность 1,168 кг/л). |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора соляной кислоты, а также массу растворенного вещества HCl в нем:
msolution =0,1 × 1,168 = 0,1168 кг = 116,8г.
msolute (HCl) = ω (HCl) / 100% ×msolution;
msolute (HCl) = 34 / 100% × 116,8 = 39,712 г.
Рассчитаем количество моль соляной кислоты (молярная масса равна 36,5 г/моль):
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 39,712 / 36,5 = 1,088 моль.
Согласно уравнению реакции n (HCl) :n (Ca3(PO4)2) =6: 1. Значит,
Тогда масса фосфата кальция, вступившего в реакцию будет равна (молярная масса – 310 г/моль):
| Задание | Какая масса оксида фосфора (V) образуется в ходе реакции термического разложения фосфата кальция массой 46 г? |
| Решение | Запишем уравнение реакции термического разложения фосфата кальция: |
Рассчитаем количество вещества фосфата кальция (молярная масса – 310 г/моль):
Согласно уравнению реакции n(Ca3(PO4)2) :n(P2O5) =1:1 . Тогда количество моль оксида фосфора (V) будет равно:
Найдем массу образовавшегося оксида фосфора (V) (молярная масса – 284 г/моль):
Источник
Ca3(PO4)2 + H2O = ? уравнение реакции
Подскажите, растворяется ли фосфат кальция в воде (Ca3(PO4)2 + H2O = ?)? Происходит ли при этом химическая реакция? Приведите основные физические параметры этой соли, расскажите о её химических свойствах и способах его получения.
Среди фосфатов в воде растворимы только соли щелочных металлов и аммония, а это значит, что химическая реакция между Ca3(PO4)2 + H2O = ? невозможна.
Фосфат кальция представляет собой твердое вещество белого цвета, кристаллы которого плавятся без разложения. Разлагается кислотами:
Восстанавливается углеродом и алюминием при спекании:
Из фосфата кальция можно получить белый фосфор по реакции:
Фосфат кальция получают по нижеуказанным реакциям:
Источник
Фосфат кальция, характеристика, свойства и получение, химические реакции
Фосфат кальция, характеристика, свойства и получение, химические реакции.
Фосфат кальция – неорганическое вещество, имеет химическую формулу Ca3(PO4)2.
Краткая характеристика фосфата кальция:
Фосфат кальция – неорганическое вещество бесцветного либо белого цвета, соль металла кальция и ортофосфорной кислоты.
Фосфат кальция представляет собой бесцветные кристаллы.
Химическая формула фосфата кальция Ca3(PO4)2.
Фосфат кальция существует в виде двух модификациях (α и β), отличающихся физическими свойствами (плотностью и температурой плавления). α-модификация фосфата кальция имеет моноклинную сингонию. β-модификация фосфата кальция имеет гексагональная сингонию.
Плохо растворим в воде. В отличие от многих химических веществ растворимость фосфата кальция падает с увеличением температуры.
Не растворим в жидком аммиаке, ацетоне, диэтиловом эфире, этаноле и пр. органических растворителях.
В пищевой промышленности используется 3 типа фосфатов кальция, согласно степени замещения атомов водорода:
– добавка Е341(i) – ортофосфат кальция 1-замещенный (Monocalcium ortophosphate) с химической формулой Ca(Н2PO4)2;
– добавка Е341(ii) – ортофосфат кальция 2-замещенный (Dicalcium ortophosphate) с химической формулой CaНPO4;
– добавка Е341(iii) – ортофосфат кальция 3-замещенный (Tricalcium ortophosphate) с химической формулой Ca3(PO4)2.
Фосфат кальция широко распространён в природе. Входит в состав минералов фосфорита, апатита, гидроксиапатита. Фосфаты кальция содержатся в коровьем молоке. В организме человека кальций существует в основном в виде фосфатов кальция. Кости человека на семьдесят процентов состоят из фосфатов кальция. Зубная эмаль тоже состоит в основном из гидроксиапатитов (соединений фосфата кальция).
Физические свойства фосфата кальция:
| Наименование параметра: | Значение: |
| Химическая формула | Ca3(PO4)2 |
| Синонимы и названия иностранном языке | calcium phosphate (англ.) |
кальций фосфорнокислый (рус.)
кальция ортофосфат (рус.)
трикальций фосфат (рус.)
Получение фосфата кальция:
Фосфат кальция получают из минералов, в которых он содержится: фосфорита, апатита, гидроксиапатита.
Фосфат кальция также получают в результате следующих химических реакций:
- 1. взаимодействием оксида кальция и ортофосфорной кислоты:
- 2. взаимодействием гидроксида кальция и ортофосфорной кислоты:
- 3. взаимодействием фосфата лития и хлорида кальция:
- 4. взаимодействием фосфата натрия и хлорида кальция:
- 5. разложения гидроортофосфата кальция:
Источник
Фосфат кальция — основные характеристики, свойства и области применения
Основные характеристики
Чтобы понимать механизм образования фосфата кальция, следует ознакомиться с его физическими и химическими характеристиками, массовой долей составных веществ, вероятностью разложения при различных обстоятельствах. Важное значение имеют графические формулы и тривиальные названия соли.
Кальция фосфат — кристаллическое вещество белого оттенка, которое обнаруживается в составе апатита. Это минеральный камень группы фосфатов, в котором около 56% приходится на долю оксида кальция. Свойства фосфата кальция таковы, что он недостаточно хорошо растворяется в воде, а при воздействии кислот преобразуется в гидрофосфаты. Химические реакции могут быть записаны в виде уравнений и отличаются в зависимости от вещества, с которым взаимодействует фосфатное соединение.
Его месторождения расположены на территории древних морей. Они являются результатом деятельности фосфоробактерий. На отдельных территориях полезное ископаемое представлено в виде минерального вещества. Такие месторождения широко распространены. Их активно задействуют в сельском хозяйстве. Апатит является основой для получения различного сырья:
- фосфорных удобрений;
- керамики и стекла;
- продуктов черной металлургии.
Фосфориты представляют собой природные минералы, отличающиеся по своему происхождению. Обычно они являются осадочными. Фосфориты и апатиты очень важны для ведения народного хозяйства, так как позволяют получить удобрение. В качестве источника минерала кальция его задействуют для подкормки крупного рогатого скота и домашней птицы. Существует кормовой кальция фосфат. Его выпускают в соответствии с требованиями ГОСТ.
Апатит имеет неорганическое происхождение. Его задействуют во многих производственных процессах. С его помощью удается получить:
- свободный фосфор;
- абразивные материалы;
- керамические и стеклянные изделия.
Фосфаты, как гидрофосфаты и дигидрофосфаты, формируются в результате последовательной диссоциации. Схема проведения эксперимента осваивается профессиональными химиками. Специалисты в этой области изучают свойства фосфатов, пользуясь профессиональными инструментами и дополнительными веществами. Учащиеся школ и ВУЗов также обращаются к характеристикам фосфатного соединения посредством решения задач, в которых, к примеру, просят определить степень окисления элементов, произведение растворимости, то, как составные вещества реагируют друг на друга.
Это вещество является основой добавки Е341. Помимо замещенных солей фосфора, в его составе присутствует кальция фосфат. Чтобы запустить такой продукт на рынок, необходимо сделать его в соответствии с жесткими условиями.
Другие соединения фосфатов
Помимо кальция, существуют формулы с алюминием, барием, железом, натрием. Фосфат алюминия представляет собой соль твердой структуры с белым оттенком. Она не растворяется в воде и получается при объединении фосфорной кислоты и алюмината натрия. В результате формируются искомая соль, а также вода и гидроксид натрия. Кроме того, есть способ, в соответствии с которым смешивают сульфат и фосфат алюминия, после чего их нагревают. Полученный материал используют для производства антацидных препаратов.
Фосфат бария имеет аморфную форму и представляет собой белый порошок. В воде он растворяется плохо, но при добавлении хлорида аммония, а также любой кислоты удаётся увеличить ее растворимость. Чтобы получить такое соединение, достаточно добавить к гидроксиду бария дигидрофосфат этого вещества. Есть и другие методы, получившие большее или меньшее распространение на производстве. Фосфат бария используется для изготовления специального стекла для измерения уровня излучений. Также он представляет собой основу для производства люминофоров.
Фосфат железа имеет вид кристаллов жёлтого цвета, не растворяющихся в воде. Его получают при смешении ацетата натрия с гидрофосфатом этого минерала и солью железа. Готовое соединение может быть использовано при создании препаратов для борьбы с моллюсками, а также гомеопатических средств, применяемых людьми.
Фосфат натрия представлен в виде белых кристаллов, обладающих гигроскопичностью. Они превосходно растворяются в любой жидкости. Чтобы получить это вещество, проводят реакции взаимодействия карбоната натрия и фосфорной кислоты. При этом выделяется некоторое количество углекислого газа. Фосфат натрия входит в состав добавки Е339. При взаимодействии с содой она образует разрыхлитель.
Широкое применение кальция фосфат получил в производстве добавок для продуктов питания. Его задействуют для улучшения характеристик теста. Также полученный состав подходит в качестве компонента сгущенного молока, плавленых сыров. Его используют и в качестве эмульгаторов для колбасы.
Роль в организме человека
Кальция фосфат имеет широкое применение. Особая его разновидность — гидроксиапатит. Это соединение входит в состав человеческих костей и является строительным материалом для них. Также минерал присутствует в зубной эмали в форме фторапатита. Потребность в фосфоре является небольшой и составляет 800−1500 мг. Усвоение соединения на основе указанного минерала регулируется печенью. Также на этот процесс влияют витамин D, вырабатываемые организмом гормоны.
Кальция фосфат способен вступать в реакцию с продуктами питания. В комбинации с другими минералами он способен:
- улучшать работу сердца и сосудов;
- устранять тревожность;
- обеспечивать выработку коллагена в достаточном количестве;
- снижать холестерин.
Фосфаты выводятся с биологическими выделениями в количестве 4 гр. Происходит это каждый день. Получение фосфата кальция возможно в условиях лаборатории. Он входит в состав фосфорита. Зарождается это вещество в земной коре. Существуют природные источники для добычи соединения, которое служит основой для фосфата кальция, лабораторными методами.
Ортофосфат кальция изготавливается в результате взаимодействия ортофосфорной кислоты и гидроксида кальция. В дальнейшем производится ряд процессов, включающих фильтрацию, последующие высушивание и перемалывание. Молекулярная (структурная) формула фосфата кальция обозначается так: Са3 (РО4)2.
Ключевые источники
Молочная продукция необычайно богата фосфатом кальция. Также он присутствует в большом количестве в следующих изделиях:
- филе сардины и лосося;
- анчоусы;
- крупяные каши;
- обогащенные соки.
Соль присутствует в большом количестве в козьем молоке. Соединение представлено в виде мицелл. Это особые частицы, у которых ядро отличается уменьшенными размерами и является нерастворимым. Его окружают адсорбирующие ионы и молекулы растворителя. Соль входит в состав казеината кальция, составного ингредиента молока, относящегося к группе фосфопротеинов.
Несмотря на столь очевидную пользу, специалисты рекомендуют не допускать избытка фосфата кальция в ежедневном меню. Не стоит принимать без назначения врача специальные добавки и обогащенные продукты.
Запрет особенно актуален для людей с камнями в почках, патологиями паращитовидных желез. То же самое можно сказать относительно людей, проходящих лечение тетрациклиновыми антибиотиками.
Влияние добавок на человека
Различные добавки присутствуют во многих продуктах питания, продающихся в отечественных магазинах. Употреблять их безопасно, если количество таких соединений находится в пределах нормы. Если же превысить ее, возможно неблагоприятное воздействие на органы ЖКТ.
Добавка, которая произведена на основе фосфатного соединения, имеет название Е341. Она используется для придания плотной структуры отдельным блюдам, в качестве антиоксиданта и регулятора кислотности. Его применяют при производстве сухого молока и сливок, плавленых сыров. Это соединение способно делать консистенцию однородной, связывать ключевые компоненты продукта. Монофосфаты кальция, к которым относится Е341, хранят при температурных отметках от минус 20 °C до плюс 35 °C. Важны и показатели относительной влажности — они должны быть не более 70%.
Произведенный в технических условиях фосфорнокислый кальций лучше не добавлять в блюда. Его применяют в промышленной сфере и сельском хозяйстве. Если речь идёт о добавке Е341, то она способна положительно воздействовать на костную ткань, укреплять ее. Аналогичным эффектом обладает она и в отношении больных зубов, так как тормозит процессы разрушения эмали. Неорганическое соединение присутствует даже в некоторых антибиотиках. Но оно остаётся безопасным за счёт того, что не растворяется в нормальных условиях, но усиливает общий лечебный эффект.
Лучше не злоупотреблять продуктами, в составе которых присутствует кальций фосфат, так как он не растворяется водой, а формирует осадок. Человек, в организм которого регулярно попадает это вещество, может страдать от зашлакованности. Когда в тканях накапливается слишком много солей, происходят сбои в функционировании внутренних органов. Такого вреда от его употребления удастся избежать, соблюдая умеренность при употреблении продуктов, богатых фосфатным соединением.
Источник