- Карбонат магния: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Гидрокарбонат магния: физические и химические свойства
- Качественная реакция на гидрокарбонат-ион
- Взаимодействие с солями и щелочами
- Жесткость воды
- Магниевая и кальциевая жесткость
- Способы умягчения воды
- Принцип действия катионита
- Электролитическая диссоциация
- Гидролиз
- Круговорот солей угольной кислоты в природе
- Гидрокарбонат магния
- Содержание
- Получение
- Физические свойства
- Способ получения водного раствора бикарбоната магния
Карбонат магния: способы получения и химические свойства
Карбонат магния MgCO3 — соль магния и угольной кислоты. Белый, при умеренном нагревании разлагается. Мало растворяется в холодной воде. Разлагается в горячей воде.
Относительная молекулярная масса Mr = 84,31; относительная плотность для тв. и ж. состояния d= 3,037;
Способ получения
1. Карбонат магния можно получить путем взаимодействия сульфата магния и гидрокарбоната калия , образуется карбонат магния, сульфат калия, вода и углекислый газ:
Качественная реакция
Качественная реакция на карбонат магния — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат магния образует хлорид магния, углекислый газ и воду:
Химические свойства
1. Карбонат магния разлагается при температуре выше 350 — 650º С, с образованием оксида магния и углекислого газа:
2. Карбонат магния вступает в реакцию со многими сложными веществами :
2.1. Карбонат магния реагирует с горячей водой, образуя гидроксокарбонат магния и углекислый газ:
2.2. Карбонат магния реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат магния образует хлорид магния, углекислый газ и воду:
2.2.2. Карбонат магния реагирует с концентрированной и горячей плавиковой кислотой . Взаимодействие карбоната магния с плавиковой кислотой приводит к образованию фторида магния, воды и углекислого газа:
2.3. Карбонат магния может взаимодействовать с солями :
2.3.1. Карбонат магния взаимодействует при кипении с концентрированным раствором сульфата аммония . При этом образуется сульфат магния, аммиак, углекислый газ и вода:
Источник
Гидрокарбонат магния: физические и химические свойства
Угольная кислота, представляющая собой водный раствор углекислого газа, может взаимодействовать с основными и амфотерными окислами, аммиаком, со щелочами. В результате реакции получаются средние соли — карбонаты, а при условии, что карбонатная кислота взята в избытке – гидрокарбонаты. В статье мы познакомимся с физическими и химическими свойствами гидрокарбоната магния, а также с особенностями его распространения в природе.
Качественная реакция на гидрокарбонат-ион
Как средние соли, так и кислые, угольной кислоты взаимодействуют с кислотами. В результате реакции происходит выделение углекислого газа. Его присутствие можно обнаружить, пропуская собранный газ через раствор известковой воды. Наблюдается помутнение вследствие выпадения нерастворимого осадка карбоната кальция. Реакция, иллюстрирует, как гидрокарбонат магния, содержащий ион HCO3 — , вступает в реакцию.
Взаимодействие с солями и щелочами
Как происходят реакции обмена, между растворами двух солей, образованных различными по силе кислотами, например, между хлоридом бария и кислой солью магния? Она идет с образованием нерастворимой соли — угольнокислого бария. Такие процессы называются реакциями ионного обмена. Они всегда заканчиваются образованием осадка, газа или мало диссоциирующего продукта – воды. Реакция щелочи гидроксида натрия и гидрокарбоната магния приводит к образованию средней соли карбоната магния и воды. Особенностью термического разложения карбонатов аммония является то, что кроме появления кислых солей, происходит выделение газообразного аммиака. Соли карбонатной кислоты при сильном нагревании могут взаимодействовать с амфотерными оксидами, такими как оксид цинка или алюминия. Реакция идет с образованием солей – алюминатов или цинкатов магния. Окислы, образованные неметаллическими элементами, также способны реагировать с гидрокарбонатом магния. В продуктах реакции обнаруживается новая соль, углекислый газ и вода.
Широко распространенные в земной коре минералы – известняк, мел, мрамор, длительное время взаимодействуют с диоксидом углерода, растворенным в воде. В результате образуются кислые соли – гидрокарбонаты магния и кальция. При изменении условий внешней среды, например, при повышении температуры, происходят обратные реакции. Средние соли, кристаллизуясь из воды с высокой концентрацией бикарбонатов, часто образуют в известковых пещерах сосульки из карбонатов – сталактиты, а также наросты в виде башен – сталагмиты.
Жесткость воды
Вода взаимодействует с солями, содержащимися в почве, например, с гидрокарбонатом магния, формула которого Mg(HCO3)2. Она растворяет их, а сама становится жесткой. Чем больше примесей, тем хуже в такой воде развариваются продукты, резко ухудшаются их вкус и пищевая ценность. Такая вода мало пригодна для мытья волос и стирки белья. Особенно опасна жесткая вода для использования в паровых установках, так как во время кипения гидрокарбонаты кальция и магния, растворенные в ней, выпадают в осадок. Он образует слой накипи, плохо проводящий тепло. Это чревато такими негативными последствиями, как перерасход топлива, а также перегревание котлов, приводящее к их износу и авариям.
Магниевая и кальциевая жесткость
Если в водном растворе наряду с анионами HCO3 — присутствуют ионы кальция, то они обуславливают кальциевую жесткость, если катионы магния – магниевую. Их концентрация в воде носит название общей жесткости. При длительном кипячении гидрокарбонаты превращаются в плохо растворимые карбонаты, выпадающие в виде осадка. При этом общая жесткость воды уменьшается на показатель карбонатной или временной жесткости. Катионы кальция образуют карбонаты – средние соли, а ионы магния входят в состав гидроксида магния или основной соли – гидроксид карбоната магния. Особенно, высокая жесткость присуща воде морей и океанов. Например, в Черном море магниевая жесткость составляет 53,5 мг-экв/л, а в Тихом океане – 108 мг-экв/л. Наряду с известняком в земной коре часто встречается магнезит – минерал, содержащий карбонат и гидрокарбонат натрия и магний.
Способы умягчения воды
Перед использованием воды, общая жесткость которой превышает 7 мг-экв/л, ее следует освободить от избытка солей – смягчить. Например, в нее можно добавить гидроксид кальция – гашеную известь. Если же одновременно с ней вносить и соду, то можно избавиться и от постоянной (некарбонатной) жесткости. Применяют и более удобные приемы, не требующие нагревания и контакта с агрессивным веществом – щелочью Ca(OH)2. К ним можно отнести использование катионитов.
Принцип действия катионита
Алюмосиликаты и синтетические ионообменные смолы – это катиониты. Они содержат в своем составе подвижные ионы натрия. Пропуская воду через фильтры со слоем, на котором расположен носитель – катионит, частицы натрия будут меняться на катионы кальция и магния. Последние связываются анионами катионита и прочно в нем удерживаются. Если в воде присутствует концентрация ионов Ca 2+ и Mg 2+ , то она будет жесткой. Чтобы восстановить активность ионообменника, вещества помещают в раствор поваренной соли, при этом происходит обратная реакция – натриевые ионы замещают катионы магния и кальция, адсорбированные на катионите. Восстановленный ионообменник вновь готов для процесса умягчения жесткой воды.
Электролитическая диссоциация
Большинство средних и кислых солей в водных растворах расщепляется на ионы, являясь проводником второго рода. То есть вещество подвергается электролитической диссоциации и его раствор способен проводить электрический ток. Диссоциация гидрокарбоната магния приводит к тому, что в растворе присутствуют катионы магния и отрицательно заряженные сложные ионы остатка угольной кислоты. Их направленное движение к разноименно заряженным электродам и обуславливает появление электрического тока.
Гидролиз
Реакции обмена между солями и водой, приводящие к появлению слабого электролита – это гидролиз. Он имеет большое значение не только в неорганической природе, но также является основой процессов обмена белков, углеводов и жиров в живых организмах. Гидрокарбонат калия, магния, натрия и других активных металлов, образованный слабой угольной кислотой и сильным основанием, в водном растворе полностью гидролизуется. При добавлении к нему бесцветного фенолфталеина индикатор окрашивается в малиновый цвет. Это указывает на щелочной характер среды, вследствие накопления избыточной концентрации гидроксид-ионов.
Фиолетовый лакмус в водном растворе кислой соли угольной кислоты становится синим. Избыток гидроксильных частиц в данном растворе можно обнаружить и с помощью еще одного индикатора – метилового оранжевого, меняющего свою окраску на желтую.
Круговорот солей угольной кислоты в природе
Способность гидрокарбонатов растворяться в воде лежит в основе постоянного их перемещения в неживой и живой природе. Подземные воды, насыщенные углекислотой, просачиваются сквозь слои почвы, в состав которых входят магнезит и известняк. Вода с гидрокарбонатом и магнием попадает в почвенный раствор, затем выносится в реки и моря. Оттуда кислые соли поступают в организмы животных и идут на постройку их внешнего (раковины, хитин) или внутреннего скелета. В некоторых случаях, под действием высокой температуры гейзерных или соляных источников, гидрокарбонаты разлагаются, выделяя диоксид углерода и превращаясь в залежи полезных ископаемых: мела, известняка, мрамора.
В статье мы изучили особенности физических и химических свойств гидрокарбоната магния и выяснили пути его образования в природе.
Источник
Гидрокарбонат магния
| Гидрокарбонат магния | |
|---|---|
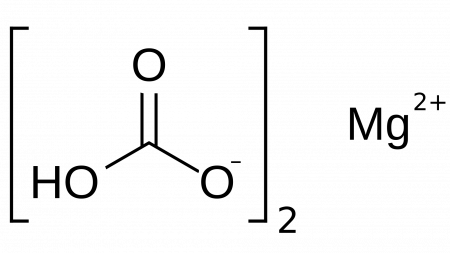 | |
| Систематическое наименование | Гидрокарбонат магния |
| Традиционные названия | Углекислый магний кислый, бикарбонат магния, двууглекислый магний |
| Хим. формула | Mg(HCO3)2 |
| Состояние | раствор |
| Молярная масса | 146,34 г/моль |
| Рег. номер CAS | 2090-64-4 |
| PubChem | 102204 |
| Рег. номер EINECS | 218-240-1 |
| SMILES | |
| Кодекс Алиментариус | E504(ii) |
| ChemSpider | 92335 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрокарбонат магния — неорганическое соединение, кислая соль магния и угольной кислоты с формулой Mg(HCO3)2, существует только в водных растворах.
Содержание
Получение
- Пропускание углекислого газа через суспензию карбоната магния:
MgCO3 + CO2 + H2O → Mg(HCO3)2
- При добавлении к растворимым солям магния карбоната аммония:
5 MgCl2 + 5 (NH4)2CO3 + 2 H2O → Mg(OH)2 ⋅ 3 MgCO3 ↓ + 10 NH4Cl + Mg(HCO3)2
Физические свойства
Гидрокарбонат магния существует только в водных растворах.
Наличие гидрокарбоната магния в воде обуславливает её временную жёсткость.
Источник
Способ получения водного раствора бикарбоната магния
Владельцы патента RU 2681622:
Изобретение может быть использовано в промышленности строительных материалов для получения жидкости затворения. Способ включает карбонизацию водной суспензии магнезиального сырья при температуре не более 20°C и давлении углекислого газа 0,2 МПа в течение 30 мин в автоклаве с мешалкой. В качестве магнезиального сырья используют предварительно прокаленную при 400°C гидромагнезитовую породу. Изобретение обеспечивает упрощенную и недорогую технологию получения водного раствора бикарбоната магния с высокой концентрацией по бикарбонат-иону не менее 3,5 г/л при пониженном избыточном давлении углекислого газа для получения водостойкого магнезиального вяжущего и изделий на его основе. 1 пр.
Изобретение относится к неорганической химии, а именно, к получению раствора бикарбоната и может быть использовано в промышленности строительных материалов в качестве жидкости затворения для получения водостойкого магнезиального вяжущего и изделий на его основе, а также в химической промышленности при получении чистых магнезиальных материалов бикарбонатным способом.
Известен способ получения водного раствора бикарбоната магния [US 20050255174 A1, МПК A61K 33/10, опубл. 17.11.2005], по которому получают раствор бикарбоната магния с оптимальной концентрацией по бикарбонат-иону 500-700 мг/л с рН не более 8,0-8,6. Для приготовления такого раствора используют магнезиальные вещества, карбонат магния, гидроксид магния или гидроксокарбонаты магния. Наиболее подходящим является пентагидрат гидроксикарбоната магния или диппенгит 4MgCO3⋅Mg(OH)2⋅5H2O, полученный искусственным путем. Общее давление карбонизации составляет 0,05-0,5 МПа. Длительность процесса карбонизации до 6 часов. По указанному способу получают водный раствор бикарбоната магния для перорального применения лекарственных средств при снижении кислотности организма, поэтому концентрация раствора низкая.
Способ является дорогостоящим из-за необходимости многократного очищения воды и использования искусственных, специально полученных, чистых карбонатов магния.
Известен способ получения водного раствора бикарбоната магния [RU 2404144 C1 МПК C04B 9/00 (2006.01), опубл. 20.11.2010], включающий карбонизацию суспензии каустического магнезита в автоклаве при давлении углекислого газа 0,5-1,0 МПа. При контакте суспензии каустического магнезита с углекислым газом, растворенным в воде, протекают реакции, в результате которых образуется раствор бикарбоната магния с концентрацией до 35 г/л, определенной методом выпаривания по сухому остатку. Для получения раствора бикарбоната магния используют каустический магнезит, полученный при температуре 800°C. Для обеспечения протекания реакций и получения раствора Mg(HCO3)2 необходимой концентрации углекислый газ подают в автоклав под большим давлением.
Известен способ получения раствора бикарбоната магния [SU 1495300 A1, МПК4 C01F 5/24, опубл. 23.07.1989], выбранный в качестве прототипа, включающий репульпирование измельченного магнезиального сырья водой в автоклаве с мешалкой и карбонизацию полученной суспензии диоксидом углерода. Раствор бикарбоната магния получают при общем давлении 0,5 МПа и парциальном давлении диоксида углерода 0,2 МПа углекислого газа из каустического магнезита, который получен при температуре 800°C.
Такой каустический магнезит должен обладать высокой активностью при содержании активного MgO не менее 93-95%. Концентрация получаемого по данному способу раствора бикарбоната магния составляет 24,8-26,8 г/л (метод выпаривания по сухому остатку).
К магнезиальному сырью предъявляют повышенные требования по содержанию активного MgO в каустическом магнезите, что вызывает необходимость применения только свежеобожженого при 800°C высокомагнезиальной породы. Процесс карбонизации в автоклаве протекает при повышенном давлении углекислого газа — 0,5 МПа.
Предложенное изобретение позволяет осуществить получение раствора бикарбоната магния по упрощенной технологии с повышенной концентрацией и с применением природного недорогостоящего магнезиального сырья.
Способ получения водного раствора бикарбоната магния также, как в прототипе, включает карбонизацию водной суспензии магнезиального сырья в среде углекислого газа в автоклаве с мешалкой.
Согласно изобретению, в качестве магнезиального сырья используют предварительно прокаленную при 400°C гидромагнезитовую породу. Процесс карбонизации суспензии проводят в автоклаве при общем давлении углекислого газа 0,2 МПа в течение 30 мин.
Гидромагнезитовая порода представляет собой смесь минералов гидрокарбонатов магния — гидромагнезита Mg5(CO3)4(OH)2⋅4H2O, дипингита Mg5(CO3)4(OH)2⋅5H2O, несквигонита Mg(HCO3)(OH)⋅2H2O, а также серпентинитовых минералов в виде клинохризотила Mg3Si2O5(OH)4, образованных при выветривании ультраосновных пород — дунитов, базальтов, а также их метаморфических последователей — магнезитов, серпентинитов. Они залегают в виде прожилок и корок в серпентинитах и магнезитах и представляют собой серую высокодисперсную рыхлую породу. Гидромагнезитовая порода имеет следующий химический состав, мас. %: MgO 43,32, SiO2 9,86, Al2O3 0,69, СаО 0,52, Fe2O3 1,17, MnO 0,03, Δmпр 45,33. Большое значение потерь при прокаливании подтверждает гидрокарбонатную структуру.
В силу своей уникальной минералогической и структурной особенности гидромагнезитовая порода наиболее хорошо подходит для получения водного раствора бикарбоната магния. При термообработке до 800-1000°C данная порода проходит ступенчатое преобразование, постепенно теряя структурную воду и претерпевая декарбонизацию:
При этом значительно возрастает удельная поверхность проб за счет образования дефектной структуры. Это является благоприятным фактором при проведении карбонизации, которая проходит по следующим реакциям:
Термическая обработка гидромагнезитов при температуре 400°C позволяет получить высокодефектный продукт xMgCO3⋅yMg(ОН)2, прошедший дегиратацию, частичное дегидроксилирование и начальную декарбонизацию. Данная дефектная структура в большей степени подвержена растворению и переходу бикарбонат-ионов 
Таким образом, использование гидромагнезитовой породы, прокаленной при температуре 400°C, позволяет получать водный раствор бикарбоната магния с концентрацией 38 г/л при карбонизации под давлением углекислого газа 0,2 МПа в течение 30 мин.
По сравнению с прототипом существенным отличием предлагаемого способа является отсутствие необходимости применения повышенного давления газа CO2, что значительно упрощает технологию получения раствора бикарбоната магния.
Для приготовления водного раствора бикарбоната магния использовали тонкоизмельченную до удельной поверхности 280-350 м 2 /г гидромагнезитовую породу Халиловского месторождения следующего химического состава, мас. %: MgO 43,32, SiO2 9,86, Al2O3 0,69, СаО 0,52, Fe2O3 1,17, MnO 0,03, Δmпр 45,33. Породу прокаливали в муфельной печи при температуре 400°C с выдержкой 1 час. При этой температуре получили дегидратированный высокоактивный гидромагнезит по реакции (1). В автоклав периодического действия емкостью 5 литров, снабженный перемешивающим устройством с числом оборотов 4,0-6,0 мин -1 , загрузили воду с температурой 20°C и прокаленный порошок гидромагнезитовой породы в соотношении 10 г порошка на 1 л воды. Автоклав герметично закрыли, подключили перемешивающее устройство для перевода твердых частиц во взвешенное состояние и их репульпирования водой. При этом частицы прокаленного гидромагнезита начинают взаимодействовать с водой. После перешивания суспензии в течение 30 сек, в автоклав из баллона подали углекислый газ под давлением 0,2 МПа. Процесс карбонизации проводили в течение 30 мин при непрерывном перемешивании. После завершения процесса карбонизации прекратили подачу газа CO2, открыли автоклав, водный раствор бикарбоната перелили в приемные емкости.
Концентрация приготовленного водного раствора бикарбоната магния, определенная титриметрическим способом, по бикарбонат иону 
Получаемый таким образом водный раствор бикарбоната магния можно использовать в качестве жидкости затворения при получении водостойкого магнезиального вяжущего, обладающего высокими эксплуатационными свойствами, в том числе коррозионной стойкостью в агрессивных водных средах.
Способ получения водного раствора бикарбоната магния, включающий карбонизацию водной суспензии магнезиального сырья под давлением углекислого газа в автоклаве с мешалкой, отличающийся тем, что в качестве магнезиального сырья используют предварительно прокаленную при 400°С гидромагнезитовую породу, а карбонизацию проводят при давлении углекислого газа 0,2 МПа в течение 30 мин.
Источник






















