Практическая работа № 7. Амины. Аминокислоты. Белки
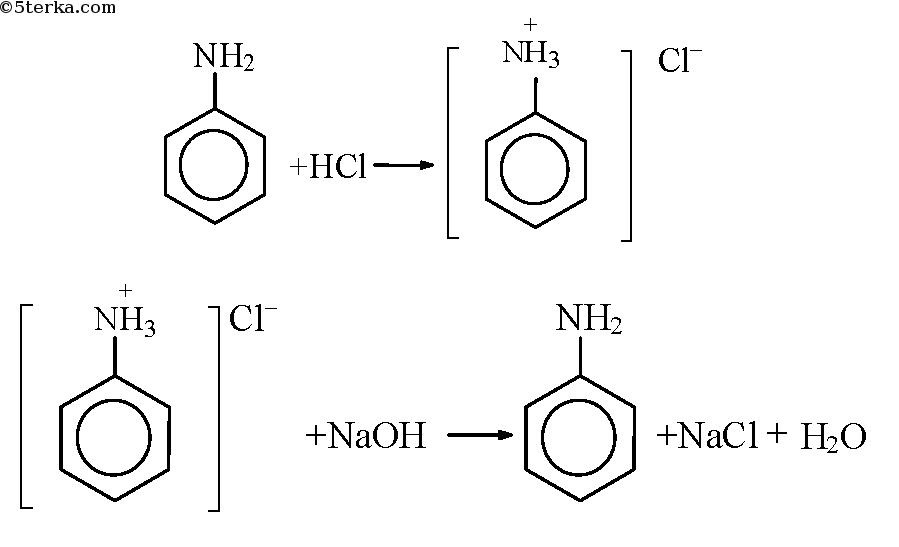
Опыт 1. Образование солей анилина
В пробирку налили чуть-чуть анилина и добавили немного воды, смесь размешали. Наблюдаем образование эмульсии. Добавили по каплям соляную кислоту до полного растворения анилина в воде. К раствору добавили немного раствора щелочи. Наблюдаем разделение раствора на две фазы.
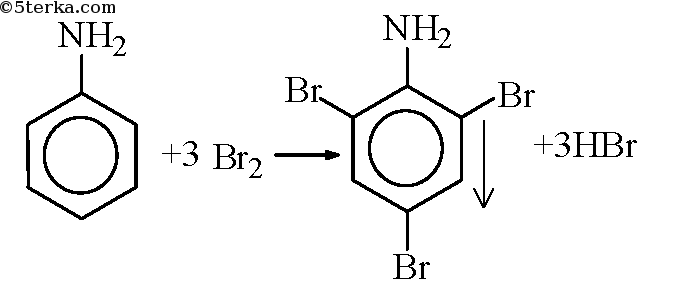
Опыт 2. Бромирование анилина
В пробирку налили чуть-чуть анилина и добавили воду. По каплям прибавляем бромную воду до выпадения белого осадка.
Опыт 3. Получение медной соли глицина
В пробирку налили 2 мл глицина и добавили немного порошка оксида меди (II). Пробирку нагрели. Наблюдаем голубое окрашивание раствора.

Опыт 4. Денатурация белка
Растворили белок куриного яйца в воде. В пробирку налили немного этого раствора и нагрели. Наблюдаем помутнение раствора — произошла денатурация. После охлаждения и разбавления раствор все равно остался мутным, т. к. денатурация — процесс необратимый.
Опыт 5. Осаждение белка солями тяжелых металлов

Опыт 6. Цветные реакции белков
а) Ксантопротеиновая реакция.
В пробирку налили немного раствора белка и прибавили несколько капель концентрированной азотной кислоты. Пробирку нагрели. Наблюдаем образование желтого осадка. Содержимое пробирки охладили и прилили раствор аммиака до щелочной реакции. Наблюдаем изменение цвета осадка на оранжевый.
б) Биуретовая реакция.
В пробирку налили немного раствора белка и добавили немного раствора гидроксида натрия и медного купороса. Наблюдаем окрашивание раствора в сине-фиолетовый цвет.

задача №7
к главе «Химический практикум».
Источник
Конкурсные вопросы в вуз
Программы по химии для поступающих в разные вузы одинаковые. Тем не менее в каждом из них есть свой «конек» – приоритетные вопросы по каким-то разделам программы. Поэтому так популярны подготовительные курсы при вузах, на которых дается именно то, что надо знать на вступительных экзаменах в данный вуз. Рассмотрим задания, в разные годы предлагавшиеся на подготовительных курсах при Московской государственной академии ветеринарной медицины и биотехнологии им. К.И.Скрябина.
Среди заданий встречаются: цепочки химических превращений неорганических и органических веществ (№ 1, 2), расчеты концентрации растворов (№ 3, 4), задачи, связанные с составлением уравнений реакций и выполнением расчетов по ним (№ 5, 6), стандартные задания на определение массовой доли примесей в техническом продукте и выхода продукта реакции (№ 7, 8), интересные вопросы прикладного характера, связанные с применением веществ или с процессами, происходящими в природе (№ 9, 10), вопросы по органической химии, которые представляются совсем простыми при обладании конкретными знаниями (№ 11–15).
ВОПРОСЫ
1. Составьте уравнения реакции для цепочки превращений:
Si 







2. Составьте уравнения реакций для цепочки превращений:
3. В 150 мл воды растворили 20 г кальция. Рассчитайте массовую долю щелочи в полученном растворе. (Растворимость гидроксида кальция при 20 °С равна 0,166 г в 100 г воды.)
4. Смесь анилина, глицина (H2NCH2СООН) и уксусной кислоты массой 10 г обработали 80 г 2%-й бромной воды. При этом один из компонентов смеси полностью вступил в реакцию, и выпало 1,1 г осадка. Если 10 г исходной смеси вовлечь в реакцию с хлороводородом, то расходуется 2,247 л НCl (н.у.). Определите массовую долю уксусной кислоты 
5. Газ, полученный при нагревании 52,8 г сульфата аммония с избытком NaOH, был поглощен раствором, содержащим 78,4 г Н3РО4. Какая соль образовалась при этом?
6. Металл группы IIа периодической системы массой 60 г в реакции с азотом образует нитрид. Этот нитрид реагирует с водой с выделением аммиака и образованием гидроксида металла. В результате каталитического окисления аммиака с выходом 50% получается 11,2 л (н.у.) NО. Определите металл. Напишите уравнения реакций.
7. При правильном кормлении лошадь должна получать в сутки 10 г кальция на 100 г живой массы. Рассчитайте, сколько мела, содержащего 10% примесей, надо дать лошади массой 500 кг.
8. Какую массу бутадиена-1,3 можно получить в результате каталитического превращения 23 л спирта по способу С.В.Лебедева, если массовая доля этанола в спирте равна 95%, а выход продукта реакции составляет 60%? Плотность спирта равна 0,8 кг/л.
9. Для предупреждения малокровия поросятам дают ежедневно по 10 мл раствора, содержащего в 1 л 2,5 г железного купороса (FeSO4•7Н2О) и 1 г медного купороса (CuSO4•5Н2О). Определите массы железа и меди в 10 мл данного раствора.
10. Найдите массу кремнезема (SiO2), необходимого для получения стекла по реакции с 53 кг соды и 50 кг известняка.
11. Бромпроизводное углеводорода общей формулы СnН2n+1Вr содержит 65% брома. Найдите молекулярную формулу соединения.
12. Определите объем газов (н.у.), которые выделяются при взрыве 100 г тринитроглицерина.
13. Имеются два изомерных вещества с 
14. Определите объем кислорода, выделяющегося в процессе фотосинтеза при н.у., если растение поглотило 44,8 л СО2.
15. За один сезон растения поглощают до 75 кг азота с 1 га почвы. Рассчитайте, сколько нитрата аммония следует внести на эту площадь, чтобы возместить потерю азота. Учтите, что 20% азота возвращается в почву в результате естественных процессов.
Решения и ответы
1. Пронумеруем стадии (стрелки) в цепочке превращений и для каждой составим уравнение реакции:
2. Пронумеруем стадии (стрелки) в цепочке превращений и для каждой составим уравнение реакции:

* Палладий на карбонате кальция Pd/СаСО3 – катализатор Линдлара, в который добавляют ацетат свинца и хинолин, чтобы частично дезактивировать (отравить) катализатор. При таком катализе водород присоединяется к алкину, но не присоединяется к алкену.
3. Особенность задачи в том, что кальций не просто растворяется в воде, а химически взаимодействует с ней по уравнению реакции:
Масса образующегося гидроксида кальция:
x = 20•74/40 = 37 г,
масса выделившегося водорода: y = 1 г.
Поскольку масса расходуемой в реакции воды z г, масса воды в растворе равна:
В ней растворяется 0,166•1,32 = 0,22 г Са(ОН)2.
Остальной Са(ОН)2 будет в осадке и не влияет на массовую долю:

Ответ. 
4. Осадок с бромной водой образует анилин:
Масса анилина в смеси:
х = 93•1,1/330 = 0,31 г.
С хлороводородом реагируют анилин и глицин:
Объем хлороводорода, расходуемого в реакции с анилином:
y = 0,31•22,4/93 = 0,075 л.
Объем хлороводорода, реагирующего с глицином, равен:
2,247 – 0,075 = 2,172 л.
Отсюда масса глицина в смеси:
z = 75•2,172/22,4 = 7,27 г.
Масса уксусной кислоты в исходной смеси равна:
10 – 0,31 – 7,27 = 2,42 г.
Массовая доля уксусной кислоты:

Ответ. 
5. Составим уравнение реакции сульфата аммония с гидроксидом натрия:
Масса образующегося аммиака:
х = 52,8•2•17/132 = 13,6 г.
Рассчитаем количества веществ аммиака и фосфорной кислоты:


Реагенты следующей реакции присутствуют в эквимолярных количествах, поэтому образуется монозамещенная соль фосфорной кислоты:
6. Напишем уравнение реакции каталитического окисления аммиака:
Поскольку количества веществ аммиака и оксида азота(II), участвующих в реакции, одинаковы, с учетом 50%-го выхода получаем:
V(NH3) = V(NO)теор = 22,4 л, 
Формула нитрида металла IIа группы – М3N2. Уравнение его реакции с водой:
М3N2 + 6Н2О = 3М(ОН)2 + 2NН3
Из уравнения реакции следует:


Составим уравнение реакции металла IIа группы с азотом:
Согласно уравнению реакции:


Зная массу металла m(M) = 60 г и его количество вещества 
M(M) = m/ 
Ответ. Металл – Са.
7. Лошади массой 500 кг в сутки требуется 50 г кальция.
Поскольку молярная масса мела M(СаСО3) = 100 г/моль, то 40 г Са содержится в 100 г чистого мела, соответственно 50 г Са содержится в 125 г чистого мела.
С учетом 10% примесей в меле его масса равна:
m = 125/0,9 = 139 г.
8. Масса 23 л 95%-го раствора спирта:
m(95%-го р-ра спирта) = 
Масса этанола в 95%-м растворе спирта:
m(этанола) = 
Составим уравнение реакции синтеза бутадиена-1,3 из этанола:
Теоретическая масса образующегося бутадиена:
х = 17,48•54/(2•46) = 10,26 кг.
Поскольку выход бутадиена 60%, практическая масса бутадиена:
Ответ. m(бутадиена-1,3) = 6,16 кг.
9. В 10 мл раствора содержится:
Рассчитаем молярные массы железного и медного купороса:
Составим пропорции, чтобы найти массы металлов, точнее, их ионов:
278 г железного купороса – 56 г Fe 2+ ,
25 мг железного купороса – х мг Fe 2+ ,
отсюда х = 5,04 мг;
250 г медного купороса – 64 г Сu 2+ ,
10 мг медного купороса – у мг Сu 2+ ,
отсюда y = 2,56 мг.
Ответ. 5,04 мг Fe 2+ и 2,56 мг Cu 2+ .
10. Молярные соотношения оксидов натрия, кальция и кремния при получении стекла следующие:



Количества веществ карбонатов:


Поэтому 
m(SiO2) = 
11. Определим относительную молекулярную массу бромуглеводорода в общем виде:
где n – число атомов С в молекуле.
Зная массовую долю брома в соединении, определим n:

1600 = 14n•13 + 13•81,
12. Во-первых, надо знать формулу тринитроглицерина, во-вторых, что взрыв нитроглицерина – реакция разложения, в третьих, правильно записать продукты реакции:
4•227 г тринитроглицерина – 29•22,4 л газов,
100 г тринитроглицерина – х л газов.
Отсюда х = 71,5 л.
Ответ. 71,5 л газов.
13. Молярная масса органического вещества:
M = 
Чтобы при гидролизе получилось два кислородсодержащих вещества, в исходном соединении должен быть хотя бы один атом кислорода. По молярной массе, казалось бы, подходят метилэтиловый эфир СН3ОС2Н5 и пропанол С3Н7ОН.
Однако простые эфиры – малореакционноспособные вещества, при нагревании с раствором щелочи или разбавленной кислотой они не гидролизуются. К тому же реакцией этерификации называют взаимодействие карбоновой кислоты со спиртом.
Поэтому искомые изомеры – НСООСН3 и СН3СООН.
14. При записи схемы фотосинтеза следует запомнить число 6, оно повторяется несколько раз – в индексах и коэффициентах:
Из уравнения видно, что объем кислорода такой же, как углекислого газа, т.е. равен 44,8 л.
Ответ. 44,8 л кислорода.
15. Поскольку 20% азота от требуемых 75 кг на 1 га почвы (т.е. 15 кг) возвращается самопроизвольно, то необходимо внести 60 кг азота. Молярная масса нитрата аммония
М(NH4NO3) = 80 г/моль включает 28 г/моль азота.
* Палладий на карбонате кальция Pd/СаСО3 – катализатор Линдлара, в который добавляют ацетат свинца и хинолин, чтобы частично дезактивировать (отравить) катализатор. При таком катализе водород присоединяется к алкину, но не присоединяется к алкену.
Источник















