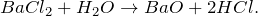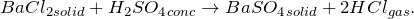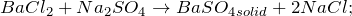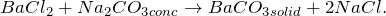- Хлорид бария: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Хлорид бария
- Характеристики и физические свойства хлорида бария
- Получение хлорида бария
- Химические свойства хлорида бария
- Применение хлорида бария
- Примеры решения задач
- BaCl2 + H2O = ? уравнение реакции
- Acetyl
Хлорид бария: способы получения и химические свойства
Хлорид бария BaCl2 — соль щелочноземельного металла бария и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 208,23; относительная плотность для тв. и ж. состояния d = 3,856; tпл = 961º C;
Способ получения
1. Хлорид бария можно получить путем взаимодействия бария и хлора :
2. В результате взаимодействия карбоната бария и разбавленной соляной кислоты образуется хлорид бария, углекислый газ и вода:
3. Гидроксид бария вступает в реакцию с соляной кислотой с образованием хлорида бария и воды:
Качественная реакция
Качественная реакция на хлорид бария — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид бария образует нитрат бария и осадок хлорид серебра:
Химические свойства
1. Хлорид бария вступает в реакцию со многими сложными веществами :
1.1. Хлорид бария реагирует с кислотами:
1.1.1. Твердый хлорид бария реагирует с концентрированной серной кислотой при кипении , образуя сульфат бария и газ хлороводород :
1.2. Хлорид бария вступает в взаимодействие с солями:
1.2.1. В результате реакции между хлоридом бария и концентрированным раствором карбоната натрия образуется карбонат бария и хлорид натрия:
1.2.2. Хлорид бария может реагировать с сульфатом натрия при 800º С с образованием сульфата бария и хлорида натрия:
2. В результате электролиза раствора хлорида бария образуется водород и хлор:
Источник
Хлорид бария
Характеристики и физические свойства хлорида бария
Он хорошо растворяется в воде, при этом не подвергаясь гидролизу, так как образован сильной кислотой и сильным основанием.
Рис. 1. Хлорид бария. Внешний вид.
Основные характеристики хлорида бария приведены в таблице ниже:
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура разложения, o С
Растворимость в воде (20 o С), г/100 мл
Получение хлорида бария
В лабораторной практике для получения хлорида бария используют следующие реакции:
Химические свойства хлорида бария
В водном растворе хлорид бария диссоциирует на ионы:
Он хорошо растворяется в концентрированной азотной кислоте и разлагается серной, но нерастворим в концентрированной хлороводородной кислоте.
Хлорид бария вступает в реакции обмена с другими солями только в случае образования в качестве продуктов нерастворимого вещества, газообразного или малодиссоциирующего соединения:
Применение хлорида бария
Хлорид бария используют в кожевенном деле, при производстве керамических изделий, пигментов, а также в химическом анализе, как качественный реактив для обнаружения сульфат-анионов.
Примеры решения задач
| Задание | Вычислите массу хлорида бария, который может прореагировать с концентрированным раствором серной кислоты объемом 100 мл (массовая доля H2SO4 98%, плотность 1,8365 г/мл). Определите объем хлороводорода, выделяющийся в результате этой реакции. |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора серной кислоты, а также массу растворенного вещества H2SO4 в нем:
msolution =100 × 1,8365 = 183,65г.
Рассчитаем количество моль серной кислоты (молярная масса равна 98 г/моль):
Согласно уравнению реакции n (H2SO4) :n (HCl) = 1: 2. Значит,
n(HCl) = 2 × n(H2SO4) = 2 × 1,84 = 3,86 моль.
Тогда, объем выделившегося хлороводорода будет равен:
V (HCl) = 3,86 × 22,4 = 82,432 л.
Согласно уравнению реакции n(H2SO4) :n (BaCl2) = 1: 1. Значит,количество вещества карбоната хлорида бария равно:
Тогда масса хлорида бария, вступившего в реакцию будет равна (молярная масса – 208 г/моль):
m (BaCl2) = 1,84 × 208 = 382,72г.
| Задание | Вычислите массу бария, который необходим для получения хлорида бария массой 7,9 г по реакции взаимодействия с хлором. |
| Решение | Запишем уравнение реакции взаимодействия бария и хлора с образованием хлорида бария: |
Рассчитаем число моль хлорида бария (молярная масса – 208 г/моль):
n (BaCl2) = 7,9 / 208 = 0,04моль.
Согласно уравнению реакции n(BaCl2) :n(Ba) = 1:1, значит,
Масса бария необходимого для получения хлорида бария по реакции взаимодействия с хлоромравна (молярная масса – 137 г/моль):
Источник
BaCl2 + H2O = ? уравнение реакции
Происходит ли химическая реакция между хлоридом бария и водой (BaCl2 + H2O = ?)? Укажите основные физические и химические свойства, способы применения вышеупомянутой соли. В каких отраслях народного хозяйства она нашла применение?
В результате растворения хлорида бария в воде (BaCl2 + H2O = ?) происходит образование оксида бария и хлороводорода. Реакцию проводят при нагревании в температурном диапазоне 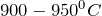
Хлорид бария – средняя соль, образованная сильным основанием – гидроксидом бария и сильной кислотой – соляной, а, значит в водном растворе не подвержена гидролизу.
Хлорид бария образуется в виде кристаллов белого цвета при взаимодействии металлического бария с хлором, а также в ходе растворения оксида / гидроксида / сульфида бария в соляной кислоте.
Эта соль хорошо растворяется в азотной кислоте, но нерастворима в концентрированной хлороводородной кислоте. Разлагается концентрированной серной кислотой:
Вступает в реакции обмена.
Хлорид бария нашел применение в качестве сырья при производстве пигментов, компонента керамических изделий; используется в кожевенном деле для утяжеления и осветления кожи.
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |