- Карбонат аммония
- Характеристики и физические свойства карбоната аммония
- Получение карбоната аммония
- Химические свойства карбоната аммония
- Применение карбоната аммония
- Примеры решения задач
- Соли аммония: получение и химические свойства
- Соли аммония
- Способы получения солей аммония
- Химические свойства солей аммония
- Гидролиз карбоната аммония
- Общие сведения о гидролизе карбоната аммония
- Гидролиз карбоната аммония
- Примеры решения задач
- Карбонат аммония
- Содержание
- Свойства
- Применение
- Карбонат аммония: получение, химические свойства, спектр применения
- Описание реактива, физические свойства
- Синтез углекислого аммония
- Химические свойства
- Химический фонтан из колбы
- Незаменимый разрыхлитель
- Влияние углекислого аммония на организм человека
- Применение в других областях промышленности
Карбонат аммония
Характеристики и физические свойства карбоната аммония
В виде раствора он несколько более устойчив к нагреванию. Хорошо растворяется в воде (гидролизуется по аниону), образует сильнощелочной раствор. Кристаллогидратов не имеет.
Рис. 1. Карбонат аммония. Внешний вид.
Основные характеристики карбоната аммония приведены в таблице ниже:
Молярная масса, г/моль
Температура разложения, o С
Получение карбоната аммония
Выделение карбоната аммония в качестве самостоятельного вещества было осуществлено из роговых образований кожи человека и животных (волосы, ногти, рога и т.д.), которые содержат в своем составе азот, путем дистилляции при воздействии высоких температур.
В настоящее время основным способом получения карбоната аммония является нагревание хлористого аммония.
Химические свойства карбоната аммония
Карбонат аммония – средняя соль, образованная слабым основанием – гидроксидом аммония (NH4OH) и слабой кислотой – угольной (H2CO3). В водном растворе он гидролизуется по анионуи катиону. Характер среды – нейтральный. Уравнение гидролиза выглядит следующим образом:
CO3 2- + HOH ↔ HCO3 — + OH — (гидролиз по аниону);
NH4 + + HOH↔NH4OH + H + (гидролиз по катиону);
2NH4 + + CO3 2- + HOH ↔ HCO3 — + NH4OH (ионное уравнение)
Карбонат аммония относится к классу неорганических солей. Он способен взаимодействовать:
- Подвергается разложению при нагревании
Применение карбоната аммония
Карбонат аммония используется в пищевой промышленности в качестве добавки к пище Е503, которая выступает в роли заменителя дрожжей и соды. Кроме этого его используют в фармации и при производстве косметических средств.
Примеры решения задач
| Задание | Сколько литров углекислого газа выделится при термическом разложении 104 г карбоната кальция? |
| Решение | Запишем уравнение реакции термического разложения карбоната кальция: |
Найдем количество вещества карбоната кальция:
n(CaCO3) =104/100 = 1,04 моль.
Согласно уравнению реакции:
Тогда, объем выделившегося углекислого газа:
V(CO2) = 1,04 × 22,4 = 23, 296 л.
| Задание | Осуществите ряд превращений |
При действии углерода в виде коксованного угля на углекислый газ происходит выделение угарного газа:
При окислении угарного газа вновь образуется углекислый газ:
При пропускании углекислого газа через раствор известковой воды он мутнеет — образуется карбонат кальция:
Источник
Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Источник
Гидролиз карбоната аммония
Общие сведения о гидролизе карбоната аммония
Формула – (NH4)2CO3. Представляет собой бесцветные кристаллы. Молярная масса – 96 г/моль.Неустойчив, даже на воздухе мгновенно разлагается на аммиак, углекислый газ и воду.
Рис.1. Карбонат аммония. Внешний вид.
Гидролиз карбоната аммония
Гидролизуется по аниону и катиону. Характер среды – нейтральный. Уравнение гидролиза выглядит следующим образом:
CO3 2- + HOH ↔ HCO3 — + OH — (гидролиз по аниону);
NH4 + + HOH↔NH4OH + H + (гидролиз по катиону);
2NH4 + + CO3 2- + HOH ↔ HCO3 — + NH4OH (ионное уравнение)
Примеры решения задач
| Задание | Опишите с помощью уравнений химические свойства карбоната аммония. |
| Ответ | Карбонат аммония относится к классу неорганических солей. Он способен взаимодействовать:
|
c другими солями
Подвергается разложению при нагревании
| Задание | Определите, какой объем углекислого газа выделится в ходе реакции взаимодействия 100 г карбоната аммония, содержащего 10% неазотистых примесей с серной кислотой. |
| Решение | Запишем уравнение реакции: |
Рассчитаем долю карбоната аммония не содержащего примеси:
Найдем массу карбоната аммония не содержащего примеси:
Определим количество молей карбоната аммония не содержащего примеси (молярная масса – 96 г/моль):
Согласно уравнению υ ((NH4)2CO3) = υ (CO2) =0,94 моль. Тогда, объем выделившегося углекислого газа будет равен:
Источник
Карбонат аммония
| Карбонат аммония | |
|---|---|
 | |
 | |
| Традиционные названия | углекислый аммоний |
| Хим. формула | (NH4)2CO3 |
| Плотность | 1,6 г/см³ |
| Температура | |
| • разложения | 60 °C |
| Растворимость | |
| • в воде | растворим (0 °C) 100,1 (15 °C) Разл. (100 °C) |
| ГОСТ | ГОСТ 3770-75 ГОСТ 9325-79 |
| Рег. номер CAS | 506-87-6 |
| PubChem | 10480 |
| Рег. номер EINECS | 208-058-0 |
| SMILES | |
| Кодекс Алиментариус | E503i |
| ChEBI | 10048 |
| ChemSpider | 10048 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
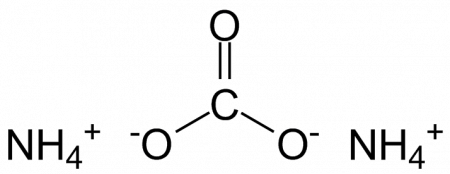
Карбонат аммония, углекислый аммоний, (NH4)2CO3 — аммониевая соль угольной кислоты.
Содержание
Свойства
Бесцветные кристаллы соединения хорошо растворимы в воде. Карбонат аммония очень неустойчив как на воздухе, так и в растворе, так как уже при комнатной температуре выделяет аммиак, превращаясь в гидрокарбонат аммония NH4HCO3 . При температуре 60 °C быстро распадается на NH3 , CO2 и H2O .
(NH4)2CO3 + H2O ⇄ NH4HCO3 + NH4OH 
Применение
На процессе разложения, связанном с выделением газов, основано применение карбоната аммония вместо дрожжей в хлебопечении и кондитерской промышленности (пищевая добавка E503). Получают карбонат аммония взаимодействием газообразных NH3 , CO2 и H2O при быстром охлаждении продуктов реакции. Технический продукт содержит наряду с (NH4)2CO3 соединение гидрокарбоната аммония с карбаминатом аммония NH4HCO3 ⋅ NH4COONH2 .
Карбонат аммония применяется для получения сульфата аммония из гипса по реакции
При этом карбонат аммония можно вводить в виде раствора (жидкостный процесс конверсии), вместо карбоната аммония можно вводить газообразные NH3 и CO2 (газовый процесс конверсии), а также можно вводить газообразные NH3 и CO2 дополнительно к раствору (NH 4)2CO3 в количестве 10—15 % стехиометрического количества в расчёте на CaSO4 (газожидкостный процесс конверсии). В последнем случае при растворении газов выделяется дополнительная теплота, необходимая для протекания реакции. Карбонат аммония может рассматриваться как источник карбонат-ионов и в перспективе может применяться, например, для осаждения солей магния для отделения его от солей калия. При добыче калия из морской воды соли калия выделяются вместе с солями магния и не могут быть очищены от него перекристаллизацией. При добавлении карбоната аммония магний выпадает в осадок в виде карбоната, в растворе остаются в основном хлорид калия и хлорид аммония, которые впоследствии могут быть разделены (рекристаллизацией или возгонкой), либо не разделяться, а использоваться как азотно-калийное удобрение. Также карбонат аммония применяется:
- в лекарственных препаратах (сиропы от кашля, нашатырь и др.);
- в качестве ускорителя ферментации при производстве вина;
- в качестве компонента огнетушащих составов
- в косметике в качестве красителей
- в качестве компонента раствора чистки стволов огнестрельного оружия (РЧС)
Источник
Карбонат аммония: получение, химические свойства, спектр применения
Большинство современных продуктов питания имеют на упаковке странные кодировки символом «Е». Некоторых компонентов стоит опасаться, но, по мнению учёных, карбонат аммония является совершенно безвредным для организма человека. Какими свойствами обладает это вещество, как его получают и где применяют? Об этом будет рассказано в данной статье.
Описание реактива, физические свойства
Соединение с формулой (NH4)2CO3 – это не что иное, как соль угольной кислоты. Всем известны её крайне нестабильные свойства, уже в процессе многих реакций она распадается на CO2 и H2O. Видимо, реактиву под названием карбонат аммония они передались по наследству. Пищевая добавка Е503 – это кристаллическое вещество с кубической решёткой. Бесцветные крупинки обладают характерным запахом, обусловленным присутствием катиона NH4 + . Он придаёт кристаллам аромат аммиака.
Плотность вещества составляет 1,5 г/см 3 . Молярная масса соли – 96,09 грамм/моль. Температура плавления реактива – 58 ⁰C. Соединение хорошо растворяется в воде, но имеет крайнюю неустойчивость. Соль начинает разлагаться при температуре 18-25 ⁰C. В ходе реакции выделяется газообразный аммиак и гидрокарбонат аммония. Это свойство реактива позволяет использовать Е503 в пищевой промышленности. По той же причине хранить его в открытых ёмкостях не стоит, ведь всего за несколько дней соединение полностью улетучится.
Синтез углекислого аммония
Первоначальным сырьём для синтеза аммонийной соли угольной кислоты служили природные продукты, содержащие азот. Для этих целей брали волосяной покров, костные выросты полорогих животных и ногтевые пластины. Под воздействием высоких температур компоненты подвергали дистилляции. Сегодня сложно представить массовое производство реактива из таких ингредиентов. Современный синтез предполагает простоту процесса и его дешевизну. Для этого используют обратную разложению реакцию, смешивая газ NH3, двуокись углерода и водяные пары. Обязательным условием этого метода является быстрое охлаждение. Есть и альтернативный способ промышленного синтеза вещества под названием карбонат аммония. Получение пищевой добавки проходит путём пропускания углекислого газа через водные растворы аммиака.
Химические свойства
Как уже было описано выше, углекислому аммонию присуща нестабильность. Это соединение способно разлагаться при воздействии температур с образованием различных реагентов. Так, продуктами полного термического распада станут аммиак, углекислый газ и вода, происходит это при нагревании соли до 58 ⁰C. При комнатной температуре возможно образование карбамата NH2COONH4 или гидрокарбоната NH4HCO3 аммония. С солями Е503 вступает в реакции обмена или образует комплексные соединения.
Продуктами взаимодействия со щелочами станут углекислые соли и водный раствор аммиака, обладающий характерным резким запахом. В обиходе его именуют нашатырным спиртом. Эта реакция является качественной для определения иона NH4 + в соединении под названием карбонат аммония. Взаимодействие с кислотой протекает бурно. При этом происходит реакция обмена, и получается новая соль и H2CO3, которая тут же распадается на двуокись углерода и воду. Выделение CO2 сопровождается вскипанием раствора.
Химический фонтан из колбы
Существует множество красивых опытов, способных впечатлить юных химиков. Именно этим чаще всего пользуются учителя, чтобы сделать столь «скучную» науку максимально привлекательной для подрастающего поколения. Для проведения опыта используются следующие компоненты: карбонат аммония, нашатырный спирт, концентрированная соляная кислота.
В качестве сосуда берётся плоскодонная коническая колба. На её дно помещают небольшое количество (NH4)2CO3. К сухой соли добавляют 5-10 мл водного раствора аммиака. Следующий реагент – хлороводородная кислота, её должно быть в избытке. В химическом сосуде одновременно протекают две бурные реакции. Выделяется плотный белый дым хлорида аммония, а образующийся вследствие нейтрализации кислоты с солью CO2 активно выталкивает его из колбы. На лабораторном столе наблюдается настоящий химический фонтан.
Незаменимый разрыхлитель
Из-за лёгкого разложения на газообразные компоненты карбонат аммония нашёл применение в изготовлении кондитерских изделий. Его используют как разрыхлитель теста и заменитель живых дрожжей. В отличие от пищевой соды, которая в больших количествах оставляет неприятный привкус и «хруст» на зубах, данный компонент не требует строгой дозировки.
Газообразные продукты распада углекислого аммония придают пористость тесту в процессе выпечки. Изделия с использованием пищевой добавки Е503 в рецептуре длительно сохраняют свою свежесть и объем. Вещество входит в состав тортов, печенья, булочек и может быть использовано в питании детей. Его вводят в тесто прямо перед выпечкой, чтобы избежать улетучивания газов, которые необходимы для подъёма.
Влияние углекислого аммония на организм человека
Как и другие «ешки», карбонат аммония оброс неправдоподобными байками о вреде для организма человека. Его прочно связывают с токсичностью газообразного аммиака, выделяемого в ходе термического разрушения пищевой добавки. На самом деле это соединение настолько летуче, что практически сразу покидает выпечку. Углекислый газ не опасен, как и вода, которая является конечным продуктом реакции разложения Е503.
Гипотезу о накоплении аммиака опровергли учёные Великобританского органа сертификации (FSA), пользующиеся заслуженным уважением по всему миру. Работа с порошкообразным реактивом под названием углекислый аммоний способна нанести вред человеку. При взаимодействии с кожными покровами Е503 вызывает раздражение, зуд, местные реакции в виде крапивницы и сыпи. Вдыхание паров аммиака, который выделяется уже при комнатной температуре, способно привести к отравлению, спазмам бронхов, слезотечению и поражению слизистых оболочек. Для проведения работ рекомендуется защитить кожные покровы и органы дыхания, использовать специальные очки.
Применение в других областях промышленности
Помимо приготовления сдобы, углекислый аммоний применяется для синтеза нашатырного спирта и других азотсодержащих солей. Его используют при промышленной очистке газов от сероводорода. Ускорить ферментацию вина также помогает данное соединение. Фармацевты готовят на основе реактива лекарственные средства от кашля, отравлений и сердечной недостаточности. В косметологии карбонат аммония применяется как краситель и стабилизатор водородного показателя.
Источник












