- Магний: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Формула гидрида магния, химическая структура и свойства
- Подготовка и формула
- Химическая структура
- Физико-химические свойства
- физическое
- химическая
- приложений
- Хранение водорода
- Реакции гидрирования и дегидрирования
- грязи
- Топливные элементы
- Транспорт и энергия
- алкилирование
- риски
- Реакция с водой
- Это пирофор
- Реакция магния с водой
- Реакция взаимодействия магния с водой.
- Уравнение реакции взаимодействия магния с водой:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Источник
Формула гидрида магния, химическая структура и свойства
гидрид магния (MGH2 молекулярной формулы), представляет собой химическое соединение с содержанием по массе 7,66% водорода, встречающееся в природе в виде белого кристаллического твердого вещества. Он используется в основном для приготовления других химических веществ, хотя он также был изучен как потенциальный носитель водорода.
Он принадлежит к семейству солевых (или ионных) гидридов, определяемых отрицательно заряженным ионом H. Эти гидриды считаются такими, которые образуются из щелочных металлов и щелочноземельных металлов, но в случае магния (и бериллия) имеют ковалентные связи, в дополнение к ионам, которые характеризуют это семейство гидридов..
- 1 Приготовление и формула
- 2 Химическая структура
- 3 Физические и химические свойства
- 3.1 Физический
- 3.2 Химические вещества
- 4 использования
- 4.1 Хранение водорода
- 4.2 Реакции гидрирования и дегидрирования
- 4.3 Грязь
- 4.4 Топливные элементы
- 4.5 Транспорт и энергия
- 4.6 Алкилирование
- 5 рисков
- 5.1 Реакция с водой
- 5.2 Это пирофорный
- 6 Ссылки
Подготовка и формула
Гидрид магния образуется путем прямого гидрирования металлического магния (Mg) в условиях высокого давления и температуры (200 атмосфер, 500ºC) с катализатором MgI.2. Его реакция эквивалентна:
Производство MgH также было исследовано2 при более низких температурах с использованием нанокристаллического магния, получаемого в шаровых мельницах.
Существуют и другие способы получения, но они представляют собой более сложные химические реакции (гидрирование магния-антрацена, реакция между диэтилмагнием с литий-алюминиевым гидридом и как продукт комплекса MgH.2).
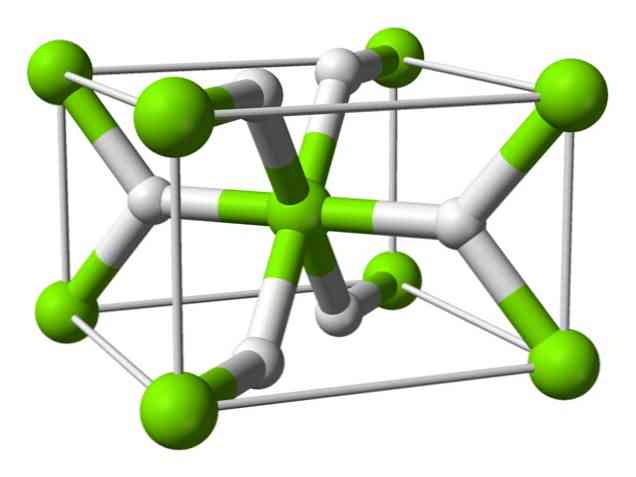
Химическая структура
Этот атом имеет структуру рутила при комнатной температуре, с тетрагональной кристаллической структурой. Он имеет по меньшей мере четыре различные формы в условиях высокого давления, и также наблюдается нестехиометрическая структура с недостатком водорода; последний встречается только в очень небольших количествах частиц при образовании.
Как упомянуто выше, связи, которые существуют в структуре рутила, имеют частично ковалентные свойства, а не являются чисто ионными, как другие солевые гидриды.
Это приводит к тому, что атом магния имеет сферическую форму, полностью ионизированную, но его гидрид-ион имеет удлиненную структуру.
Физико-химические свойства
физическое
- Внешний вид: белые кристаллы.
- Молярная масса: 26,3209 г / моль
- Плотность: 1,45 г / см 3
- Температура плавления: 285 ° C разлагается
- Растворимость: в воде разлагается.
Это химическое соединение имеет молекулярную массу 26,321 г / моль, плотность 1,45 г / см3 и температуру плавления 327 ° С..
химическая
- Прекурсор для изготовления других химических веществ.
- Хранение водорода, как возможный источник энергии.
- Восстановитель в органическом синтезе.
Важно указать, что это соединение нельзя довести до жидкого состояния, и когда его переносят или его температура плавления или вводят в воду, оно разлагается. Этот гидрид нерастворим в эфире.
Это очень реактивное и легковоспламеняющееся вещество, а также пирофорное, то есть оно может самовозгораться в воздухе. Эти три условия представляют риски для безопасности, которые будут упомянуты в последнем разделе этой статьи.
приложений
Хранение водорода
Гидрид магния легко реагирует с водой с образованием газообразного водорода посредством следующей химической реакции:
Кроме того, это вещество разлагается при температуре 287 ° С и давлении 1 бар следующим образом:
Поэтому было предложено использовать гидрид магния в качестве носителя для хранения водорода для его использования и транспортировки..
Гидрирование и дегидрирование некоторого количества металлического магния предлагается в качестве способа транспортировки количеств газообразного водорода, таким образом обеспечивая отсутствие утечки при его транспортировке и представляя более безопасный и практичный способ, чем при использовании сосудов высокого давления..
Реакции гидрирования и дегидрирования
Хотя температура разложения гидрида магния представляет собой ограничивающий фактор для его использования, были предложены способы для улучшения кинетики реакций гидрирования и дегидрирования. Одним из них является уменьшение размера частиц магния с помощью шаровых мельниц.
грязи
Кроме того, была предложена система, которая производит гидрид магния в форме грязи (более управляемой и безопасной, чем в порошке или других твердых частицах), которая будет реагировать с водой для получения желаемого водорода.
Предполагается, что ранее названный шлам будет образован тонко измельченным гидридом, защищен защитным слоем масел и суспендирован в диспергирующих агентах, чтобы гарантировать, что он сохраняет свою консистенцию без потери материала и что он не впитывает влагу из окружающей среды..
Преимущество этого ила состоит в том, что его можно перекачивать через любой обычный дизельный, бензиновый или водяной насос, что делает это экономическое предложение также эффективным.
Топливные элементы
Гидрид магния может быть использован в производстве современных топливных элементов, а также в создании аккумуляторов и накопителей энергии..
Транспорт и энергия
В течение последних десятилетий рассматривалось использование водорода в качестве источника энергии. Имплантация водорода в качестве топлива требует поиска безопасных и обратимых систем хранения и с большими объемными емкостями (количество водорода на единицу объема) и гравиметрическими (количество водорода на единицу массы).
алкилирование
Алкилирование (добавляют СН алкильные группы3R) органических соединений в основной среде, где присутствуют группы -ОН при низких концентрациях и температурах, превышающих температуру плавления гидрида.
В этом случае водороды присутствуют в гидриде магния (MgH2), присоединяются к группам -ОН, образующим воду. Свободный магний может получить галоген, который часто сопровождает алкильную молекулу, которая предназначена для связывания с углеводородной цепью.
риски
Реакция с водой
Как уже упоминалось, гидрид магния является веществом, которое очень легко и бурно реагирует с водой, демонстрируя способность взрываться при более высоких концентрациях..
Это происходит потому, что его экзотермическая реакция генерирует достаточно тепла, чтобы зажечь газообразный водород, выделяющийся в реакции разложения, что приводит к довольно опасной цепной реакции..
Это пирофор
Гидрид магния также пирофорен, что означает, что он может самопроизвольно воспламеняться в присутствии влажного воздуха и образует оксид магния и воду.
Его вдыхание не рекомендуется в твердом состоянии или в контакте с его парами: вещество в своем естественном состоянии и продукты его разложения могут вызвать серьезные травмы или даже смерть.
Он может генерировать коррозийные растворы при контакте с водой и ее загрязнении. Контакт с кожей и глазами не рекомендуется, а также вызывает раздражение слизистых оболочек.
Не было продемонстрировано, что гидрид магния может вызывать хронические последствия для здоровья, такие как рак, репродуктивные дефекты или другие физические или психические последствия, но рекомендуется использовать защитное оборудование при обращении с ним (особенно респираторы или маски, для его мелкий пыль характер).
При работе с этим веществом влажность воздуха должна поддерживаться на низком уровне, гасить все источники возгорания и транспортировать его в бочках или других контейнерных контейнерах..
Всегда следует избегать работы с большими концентрациями этого вещества, когда его можно избежать, так как вероятность взрыва значительно уменьшается.
В случае разлива гидрида магния рабочая зона должна быть изолирована, а пыль собирается пылесосом. Вы никогда не должны использовать сухой метод подметания; увеличивает шансы реакции с гидридом.
Источник
Реакция магния с водой
Реакция взаимодействия магния с водой.
Уравнение реакции взаимодействия магния с водой:
Реакция магния с водой протекает при обычных условиях.
Для проведения реакции используется горячая вода . В иных случаях реакция протекает медленно.
В результате реакции магния с водой образуются гидроксид магния и водород .
Примечание: © Фото https://www.pexels.com, https://pixabay.com

Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 485)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 492)
- Метан, получение, свойства, химические реакции (23 734)
- Этилен (этен), получение, свойства, химические реакции (22 819)
- Природный газ, свойства, химический состав, добыча и применение (21 169)
- Крахмал, свойства, получение и применение (20 574)
- Целлюлоза, свойства, получение и применение (19 422)
- Пропилен (пропен), получение, свойства, химические реакции (19 105)
- Прямоугольный треугольник, свойства, признаки и формулы (18 729)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник