Гидролиз нитрата свинца (II)
Общие сведения о гидролизе нитрата свинца (II)
Формула – Pb(NO3)2. Представляет собой порошок белого цвета. Молярная масса – 331 г/моль.
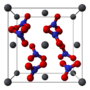
Рис. 1. Внешний вид нитрата свинца (II).
Гидролиз нитрата свинца (II)
Гидролизуется по катиону. Характер среды водного раствора нитрата свинца (II) кислый. Уравнение гидролиза будет выглядеть следующим образом:
Pb 2+ + 2NO3 — + H2O↔PbOH + + H + + 2NO3 — (полное ионное уравнение);
Pb 2+ + H2O ↔ PbOH + + H + (сокращенное ионное уравнение);
Теоретически возможна вторая ступень:
Pb(OH)NO3↔PbOH + +NO3 — (диссоциация соли);
PbOH + + NO3 — + H2O ↔ Pb(OH)2 + H + + NO3 — (полное ионное уравнение);
PbOH + + H2O ↔ Pb(OH)2 + H + (сокращенное ионное уравнение);
Примеры решения задач
| Задание | Установите соответствие между названием соли и цветом индикатора в растворе этой соли. | ||||||||||||||||||||||||||||||||
| Ответ | а) нитрат бария представляет собой соль, образованную сильной кислотой (азотной) и сильным основанием (гидроксидом бария): Гидролизу не подвергается. Реакция среды раствора нитрата бария нейтральная, значит окраска лакмуса будет фиолетовой, а фенолфталеин будет бесцветным. Вариант 3. б) хлорид железа (III) представляет собой соль, образованную сильной кислотой (хлороводородной) и слабым основанием (гидроксидом железа (III)): Гидролизуется по катиону: Наличие ионов водорода свидетельствует о том, что реакция среды раствора хлорида железа (III) кислая, а значит окраска и лакмуса, и фенолфталеина будет красной. Вариант 4. в) сульфат аммония представляет собой соль, образованную сильной кислотой (серной) и слабым основанием (гидроксидом аммония): Гидролизуется по катиону: Наличие ионов водорода свидетельствует о том, что реакция среды раствора сульфата аммония кислая, а значит окраска и лакмуса, и фенолфталеина будет красной. Вариант 4. г) ацетат калия представляет собой соль, образованную слабой кислотой (уксусной) и сильным основанием (гидроксидом калия): Гидролизуется по аниону: Наличие гидроксид-ионов свидетельствует о том, что реакция среды раствора ацетата калия щелочная, а значит окраска лакмуса будет синей, а фенолфталеин останется бесцветным. Вариант 1. Источник Нитрат свинца(II)
(100 °C) 127 г/100 мл | ||||||||||||||||||||||||||||||||
| Растворимость в остальных веществах | в азотной кислоте, этаноле: нерастворим | ||||||||||||||||||||||||||||||||
| Оптические свойства | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Показатель преломления | 1.782 [1] | ||||||||||||||||||||||||||||||||
| Структура | |||||||||||||||||||||||||||||||||
| Координационная геометрия | кубооктаэдрическая | ||||||||||||||||||||||||||||||||
| Кристаллическая структура | гранецентрированная кубическая | ||||||||||||||||||||||||||||||||
| Классификация | |||||||||||||||||||||||||||||||||
| Рег. номер CAS | 10099-74-8 | ||||||||||||||||||||||||||||||||
| Номер ООН | 1469 | ||||||||||||||||||||||||||||||||
| RTECS | OG2100000 | ||||||||||||||||||||||||||||||||
| Безопасность | |||||||||||||||||||||||||||||||||
| Токсичность | |||||||||||||||||||||||||||||||||
| Растворимость в воде, г/100 г | 45,5 | 52,2 | 58,5 | 91,6 | 116,4 |
| Температура, °C | 10 | 20 | 25 | 60 | 80 |
Водный раствор диссоциирует на катионы свинца и нитрат-анионы:
Раствор нитрата свинца(II) подвергается гидролизу и имеет слабокислую реакцию, которая имеет показатель рН от 3,0 до 4,0 для 20 % водного раствора [10] . При избытке ионов NO3 − в растворе образуются нитратокомплексы [Pb(NO3)3] − , [Pb(NO3)4] 2− и [Pb(NO3)6] 3− . При повышении pH раствора образуются гидроксонитраты переменного состава Pb(OH)x(NO3)y, некоторые из них выделены в твёрдом состоянии.
Так как только динитрат и ацетат свинца(II) являются растворимыми соединениями свинца, то все остальные соединения можно получить обменными реакциями:



Любое соединение, содержащее катион свинца(II), будет реагировать с раствором, содержащим йодид анион с образованием осадка оранжево-желтого цвета (иодид свинца(II)). Из-за разительной перемены цвета эта реакция часто используется для демонстрации под названием золотой дождь [11] :
Аналогичная реакция обмена проходит и в твердой фазе. Например, при смешении бесцветных йодида калия и динитрата свинца, и сильного измельчения, например, перетиранием в ступе, происходит реакция:
Цвет полученной смеси будет зависеть от относительного количества использованных реагентов и степени измельчения.
При растворении нитрата свинца в пиридине или жидком аммиаке образуются продукты присоединения, например Pb(NO3)2·4C5H5N и Pb(NO3)2·n NH3, где n=1, 3, 6.
Динитрат свинца является окислителем. В зависимости от типа реакции он может быть как Pb 2+ -ион, который имеет стандартный редокс-потенциал (E 0 ) −0.125 V, или нитрат-ион, который в кислой среде имеет (E 0 ) +0.956 V [12] .
При нагревании кристаллов динитрата свинца они начинают разлагаться на диоксид свинца, кислород и диоксид азота, процесс сопровождается характерным треском. Этот эффект называется декрепитация:
Благодаря этому свойству нитрат свинца иногда используется в пиротехнике [13] .
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В связи с опасным характером данного соединения, в промышленной сфере отдается предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках [14] . Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились.
Динитрат свинца используется как ингибитор полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида [6] .
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Примерно с 2000 года нитрат свинца(II) начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество (от 10 до 100 мг динитрата свинца на килограмм золота) [15] [16] .
В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов [17] . Он также нашел применение для получения изотиоцианатов из дитиокарбаматов [18] . Из-за своей токсичности он стал находить все меньшее применение, но по прежнему находит нерегулярное использование в [19] .
Меры предосторожности
Динитрат свинца токсичен, является окислителем и классифицируется (как и все неорганические соединения свинца) вероятно канцерогенное вещество для человека (категория 2А) со стороны Международного агентства по изучению рака [20] . Следовательно, он должен обрабатываться и храниться с соблюдением соответствующих мер предосторожности для того, чтобы предотвратить вдыхание, приём внутрь или контакт с кожей. Из-за опасного характера и ограниченного применения вещество должно находиться под постоянным контролем. ПДК = 0,01 мг/м³.
При приеме внутрь может привести к острому отравлению, так же как и другие растворимые соединения свинца [21] .
Отравления приводят к раку почек и глиомы у подопытных животных и рака почек, рака мозга и рака легких у людей, хотя исследования работников, подвергающихся воздействию свинца, часто осложнялись одновременным воздействием мышьяка [20] . Свинец известен как заменитель цинка в ряде ферментов, в том числе дегидратазы δ-аминолевулиновой кислоты (англ. δ-aminolevulinic acid dehydratase ) в биосинтезе гема, который важен для правильного метаболизма ДНК, следовательно может вызывать ущерб плоду матери [22] .
Источник