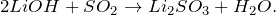- Оксид лития: способы получения и химические свойства
- Способ получения
- Химические свойства
- Li2O + H2O = ? уравнение реакции
- Оксид лития, характеристика, свойства и получение, химические реакции
- Оксид лития, характеристика, свойства и получение, химические реакции.
- Краткая характеристика оксида лития:
- Физические свойства оксида лития:
- Получение оксида лития:
- Химические свойства оксида лития. Химические реакции оксида лития:
- Применение и использование оксида лития:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Реакция оксида лития с водой уравнение реакции
Оксид лития: способы получения и химические свойства
Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса = 29,88; относительная плотность для тв. и ж. состояния = 2, 013; tпл = 1453º C; tкип ≈ 2600º C.
Способ получения
1. Оксид лития можно получить путем взаимодействия лития и кислорода :
2. Оксид лития получается при разложении гидроксида лития:
2LiOН → Li2O + Н2O
3. Путем термического разложения карбоната лития с образованием оксида лития и оксида углерода:
4. При термическом разложении нитрата лития образуется оксид лития, оксид азота и кислород:
Химические свойства
1. Литий вытесняется из оксида в результате взаимодействия с другими металлами :
1.1. Оксид лития взаимодействует с металлами и некоторыми неметаллами с образованием лития и оксида металла:
Li2O + Si = 4Li + SiO2
Li2O + Mg = 2Li + MgO
3Li2O + 2Al = 6Li + Al2O3
2. Оксид лития взаимодействует со сложными веществами:
2.1. Оксид лития реагирует с водой . Образуется гидроксид лития:
Li2O + H2O = 2LiOH
2.2. Оксид л ития взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид лития с соляной кислотой образует хлорид лития и воду:
2.3. При взаимодействии лития с оксидами образуются соли:
Источник
Li2O + H2O = ? уравнение реакции
Закончите уравнение реакции Li2O + H2O = ? Расставьте стехиометрические коэффициенты. Запишите молекулярное уравнение реакции. Охарактеризуйте полученное вещество: приведите его основные физические и химические свойства. Каким образом его можно получить в лаборатории? А в промышленности?
В результате взаимодействия оксида лития с водой (Li2O + H2O = ?) происходит образование гидроксида лития (соединение). Молекулярное уравнение реакции имеет вид:
Данная реакция не относится к окислительно-восстановительным, поскольку ни один химический элемент не изменяет своей степени окисления.
Гидроксид лития представляет собой твердое вещество белого цвета, кристаллы которого плавятся без без разложения, но при дальнейшем нагревании в атмосфере водорода разлагаются. Он хорошо растворяется в воде.
Проявляет свойства основных гидроксидов (щелочь), реагирует с кислотами, кислотными оксидами, поглощает углекислый газ из воздуха.
В лабораторных условиях гидроксид лития получают по реакция растворения металлического лития в воде, а также реакциям обмена между солями лития и гидроксидами металлов:
Источник
Оксид лития, характеристика, свойства и получение, химические реакции
Оксид лития, характеристика, свойства и получение, химические реакции.
Оксид лития – неорганическое вещество, имеет химическую формулу Li2O.
Краткая характеристика оксида лития:
Оксид лития – неорганическое вещество, без цвета.
Так как валентность лития равна одному, то оксид лития содержит один атом кислорода и два атома лития .
Химическая формула оксида лития Li2O.
В воде не растворяется, а вступает в реакцию с ней.
Оксид лития – единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).
Физические свойства оксида лития:
| Наименование параметра: | Значение: |
| Химическая формула | Li2O |
| Синонимы и названия иностранном языке | lithium oxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м 3 | 2013 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см 3 | 2,013 |
| Температура кипения, °C | 2600 |
| Температура плавления, °C | 1570 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 29,8774 |
Получение оксида лития:
Оксид лития получается в результате следующих химических реакций:
- 1. путем разложения пероксида лития:
- 2.путем взаимодействия лития с кислородом:
Химические свойства оксида лития. Химические реакции оксида лития:
Химические свойства оксида лития аналогичны свойствам оксидов других щелочных металлов . Поэтому для него характерны следующие химические реакции:
1. реакция оксида лития с магнием:
Li2O + Mg → 2Li + MgO (t > 800 o C).
В результате реакции образуется оксид магния и литий .
2. реакция оксида лития с магнием и водородом :
Li2O + Mg + H2 → 2LiH + MgO (t = 450-500 o C).
В результате реакции образуется оксид магния и гидрид лития.
3. реакция оксида лития с алюминием :
В результате реакции образуется оксид алюминия и литий.
4. реакция оксида лития с алюминием и водородом:
В результате реакции образуется оксид алюминия и гидрида лития.
5. реакция оксида лития с кремнием :
2Li2O + Si → 4Li + SiO2 (t = 1000 o C).
В результате реакции образуется оксид кремния и литий.
6. реакция оксида лития с водой:
Оксид лития медленно реагирует с водой , образуя гидроксид лития.
7. реакция оксида лития с оксидом углерода (углекислым газом):
Оксид лития на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат лития.
8. реакция оксида лития с оксидом кремния:
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – метасиликат лития.
9. реакция оксида лития с оксидом серы:
Оксид серы также является кислотным оксидом. В результате реакции образуется соль – сульфит лития.
10. реакция оксида лития с оксидом азота (IV) и оксидом азота (II):
В результате реакции образуются соль – нитрит лития.
11. реакция оксида лития с оксидом ванадия:
В результате реакции образуется диоксованадат лития.
12. реакция оксида лития с оксидом теллура:
В результате реакции образуется теллурит лития.
13. реакция оксида лития с оксидом марганца:
В результате реакции образуется оксид марганца-лития.
14. реакция оксида лития с йодоводородом:
В результате химической реакции получается соль – йодид лития и вода .
15. реакция оксида лития с сероводородом:
В результате химической реакции получается соль – сульфид лития и вода .
16. реакция оксида лития с плавиковой кислотой:
В результате химической реакции получается соль – фторид лития и вода.
17. реакция оксида лития с азотной кислотой:
В результате химической реакции получается соль – нитрат лития и вода .
Аналогично проходят реакции оксида лития и с другими кислотами.
18. реакция оксида лития с бромистым водородом (бромоводородом):
В результате химической реакции получается соль – бромид лития и вода .
Применение и использование оксида лития:
Оксид лития используется как компонент в производстве стекол , а также в химической промышленности.
Примечание: © Фото //www.pexels.com, //pixabay.com

оксид лития реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида лития
реакции с оксидом лития
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 481)
- Экономика Второй индустриализации России (102 474)
- Программа искусственного интеллекта ЭЛИС (27 488)
- Метан, получение, свойства, химические реакции (23 725)
- Этилен (этен), получение, свойства, химические реакции (22 777)
- Природный газ, свойства, химический состав, добыча и применение (21 158)
- Крахмал, свойства, получение и применение (20 566)
- Целлюлоза, свойства, получение и применение (19 411)
- Пропилен (пропен), получение, свойства, химические реакции (19 080)
- Прямоугольный треугольник, свойства, признаки и формулы (18 724)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Реакция оксида лития с водой уравнение реакции
1) Составьте молекулярное уравнение реакции гидроксида лития с серной кислотой, о которой говорилось в тексте;
2) Укажите признак, который наблюдается при протекании этой реакции в присутствии индикатора фенолфталеина, добавленного в раствор гидроксида лития.
Прочитайте следующий текст и выполните задания 5—7.
Литий — мягкий лёгкий металл серебристо-белого цвета, наименее активный среди щелочных металлов. При окислении лития кислородом образуется соединение , которое активно взаимодействует с водой с образованием гидроксида лития
. Гидроксид лития проявляет свойства, характерные для щелочей: взаимодействует с кислотами и кислотными оксидами. Примерно половина всего промышленно выпускаемого лития используется для изготовления литий-ионных аккумуляторов. Ячейка такого аккумулятора состоит из двух электродов, разделённых пористым материалом, пропитанным раствором электролита. Один из электродов изготавливают из лития, а другой — из соединений кобальта или железа. Для приготовления растворов электролитов обычно используют сульфат лития
и органические растворители, например некоторые простые и сложные эфиры. Сульфат лития можно получить в результате взаимодействия гидроксида лития с серной кислотой
.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить соляная кислота .
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является карбонат натрия .
Ответ: оксид — , основание —
, кислота —
, соль —
.
Источник