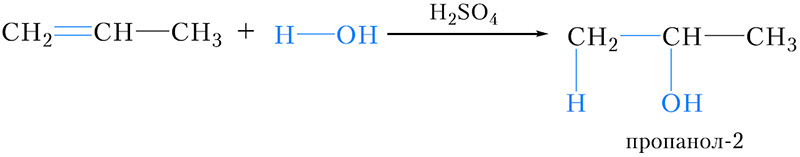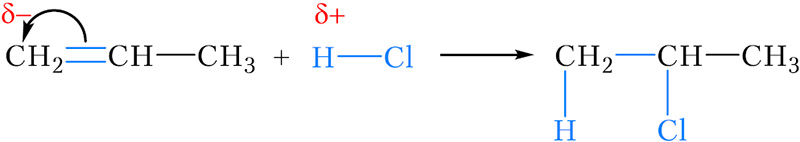- Химия. 10 класс
- *§ 15-1. Присоединение галогеноводородов и воды к алкенам. Правило Марковникова
- Правило Марковникова
- Пропилен (пропен), получение, свойства, химические реакции
- Пропилен (пропен), получение, свойства, химические реакции.
- Пропилен (пропен), формула, газ, характеристики:
- Физические свойства пропилена (пропена):
- Химические свойства пропилена (пропена):
- Получение пропилена (пропена). Химические реакции – уравнения получения пропилена (пропена):
- Применение и использование пропилена (пропена):
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
Химия. 10 класс
*§ 15-1. Присоединение галогеноводородов и воды к алкенам. Правило Марковникова
Правило Марковникова
Правило Марковникова
Реакции присоединения галогеноводородов и воды к гомологам этилена имеют некоторые особенности.
Присоединение галогеноводородов. Гидрогалогенирование
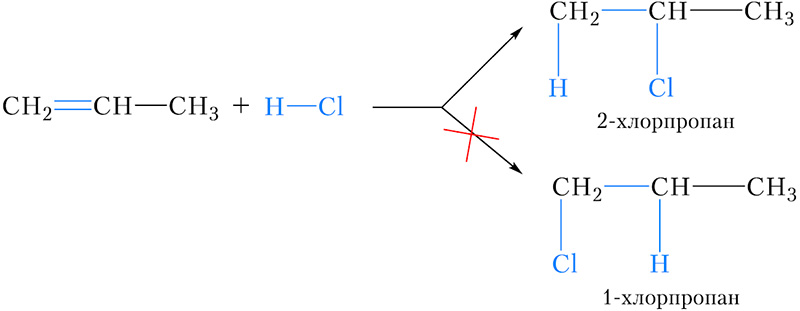
Рассмотрим реакцию присоединения хлороводорода к пропену. В результате этой реакции, в принципе, возможно образование двух продуктов — 2-хлорпропана и 1-хлорпропана :
В действительности, преимущественным продуктом этой реакции является 2-хлорпропан .
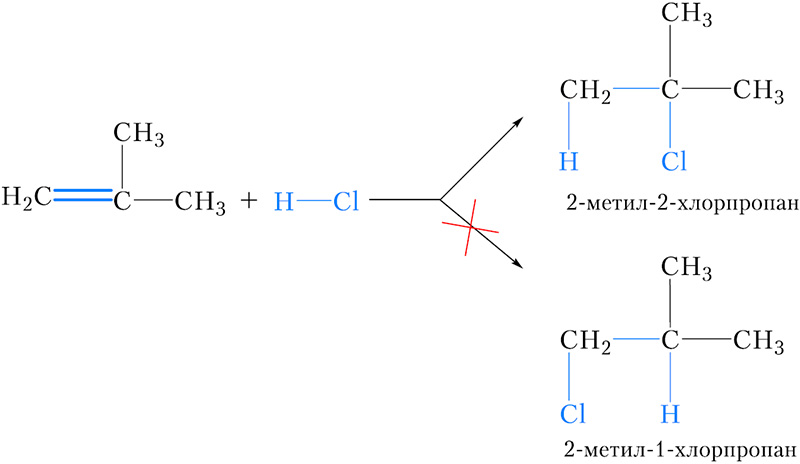
То же явление (образование одного из двух возможных продуктов) наблюдается при присоединении хлороводорода к метилпропену:
Можно заметить, что в обоих случаях водород присоединяется к тому атому углерода двойной связи, с которым соединено большее число атомов водорода (более гидрогенизированному атому углерода). Эта закономерность называется правилом Марковникова.
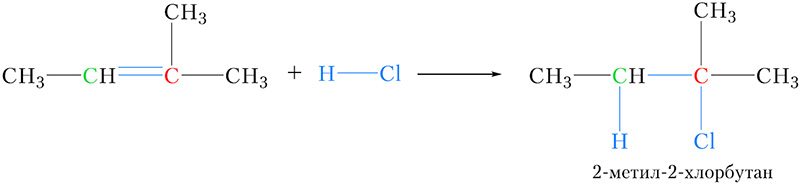
В качестве ещё одной иллюстрации правила Марковникова запишем уравнение реакции присоединения хлороводорода к метилбутену-2 :
Атом углерода, выделенный зелёным цветом, соединён с одним атомом водорода, в то время как у другого атома углерода двойной связи (выделен красным цветом) атомы водорода отсутствуют. В соответствии с правилом Марковникова водород присоединяется к более гидрогенизированному атому углерода.
Присоединение воды. Гидратация
Присоединение воды к пропену и другим несимметричным алкенам также протекает в соответствии с правилом Марковникова:
Правило Марковникова. При присоединении галогеноводородов и воды к алкенам атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.
Интересно знать
Правило Марковникова носит имя его первооткрывателя — русского химика Владимира Васильевича Марковникова, ученика А. М. Бутлерова. В. В. Марковников внёс значительный вклад в развитие положений теории строения органических соединений, касающихся изомерии и взаимного влияния атомов в молекулах органических веществ. В. В. Марковников открыл циклоалканы в составе кавказских нефтей, известны его работы по исследованию состава соляных источников и соляных озер России.
Объяснение правила Марковникова. Электронодонорные и электроноакцепторные заместители
Правило Марковникова объясняется влиянием заместителей на электроны π-связи. По этому признаку все заместители можно разделить на две группы:
1. Заместители, которые притягивают электроны π-связи. Такие заместители называются электроноакцепторными (от англ. to accept — принимать). Примеры электроноакцепторных заместителей: карбоксильная группа 

2. Заместители, которые отталкивают электроны π-связи (электронодонорные заместители). К электронодонорным заместителям относятся алкильные радикалы 



Рассмотрим присоединение хлороводорода к пропену с учётом влияния заместителей на электроны π-связи:
Положительно заряженный атом водорода молекулы хлороводорода присоединяется к атому углерода двойной связи, несущему отрицательный заряд. Этим атомом углерода является более гидрогенизированный атом C(1), что соответствует правилу Марковникова.
Присоединение галогеноводородов и воды к несимметричным алкенам протекает по правилу Марковникова — водород присоединяется к более гидрогенизированному атому углерода двойной связи.
Правило Марковникова объясняется влиянием заместителей на электроны π-связи. Электроноакцепторные заместители ( 



Источник
Пропилен (пропен), получение, свойства, химические реакции
Пропилен (пропен), получение, свойства, химические реакции.
Пропилен (пропен), C3H6 – органическое вещество класса алкенов. Пропилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Пропилен (пропен), формула, газ, характеристики:
Пропилен (пропен) – органическое вещество класса алкенов, состоящий из трех атомов углерода и шести атомов водорода . Пропилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула пропилена C3H6, рациональная формула H2CCHCH3, структурная формула CH2=CH-CH3. Изомеров не имеет.
Пропилен – бесцветный газ, без вкуса, со слабым запахом.
Пожаро- и взрывоопасен.
Плохо растворяется в воде . Зато хорошо растворяется в углеводородах.
Пропилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007, но оказывает вредное воздействие на человека более сильным, чем этилен (этен).
Физические свойства пропилена (пропена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,184 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,9149 |
| Температура плавления, °C | -185,25 |
| Температура кипения, °C | -47,6 |
| Температура вспышки, °C | 107,8 |
| Температура самовоспламенения, °C | 410 |
| Критическая температура*, °C | 91,4 |
| Критическое давление, МПа | 4,6 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,3 до 11,1 |
| Удельная теплота сгорания, МДж/кг | 45,694 |
| Молярная масса, г/моль | 42,08 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства пропилена (пропена):
Пропилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства пропилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое гидрирование (восстановление) пропилена:
В результате данной химической реакции образуется пропан.
- 2. галогенирование пропилена:
- 3. гидрогалогенирование пропилена:
Водород кислоты HBr присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Br связывается с атомом углерода, при котором находится меньшее число атомов водорода.
- 4. гидратация пропилена:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется изопропанол (изопропиловый спирт).
- 5. горение пропилена:
В результате горения пропилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода.
- 6. полимеризация пропилена:
В результате образуется полипропилен.
Получение пропилена (пропена). Химические реакции – уравнения получения пропилена (пропена):
Пропилен получают как в лабораторных условиях, так и в промышленных масштабах.
Обычно пропилен получают при пиролизе углеводородного сырья и каталитическом крекинге нефтяных фракций.
В промышленных масштабах пропилен получают, например, в результате следующей химической реакции:
Пропилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. дегидратация изопропилового спирта:
- 2. дегалогенирования дигалогенпроизводных пропана:
- 3. неполное гидрирование пропина:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Применение и использование пропилена (пропена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: оксида пропилена, изопропилового спирта, ацетона, альдегидов, акриловой кислоты, акрилонитрила, полипропилена,
– в производстве полимеров , пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить пропилен реакция ацетилен пропен 1 2 вещество пропилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение пропилена
напишите уравнение реакций пропилен
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 489)
- Экономика Второй индустриализации России (102 477)
- Программа искусственного интеллекта ЭЛИС (27 503)
- Метан, получение, свойства, химические реакции (23 759)
- Этилен (этен), получение, свойства, химические реакции (22 874)
- Природный газ, свойства, химический состав, добыча и применение (21 183)
- Крахмал, свойства, получение и применение (20 587)
- Целлюлоза, свойства, получение и применение (19 445)
- Пропилен (пропен), получение, свойства, химические реакции (19 142)
- Прямоугольный треугольник, свойства, признаки и формулы (18 745)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник