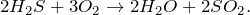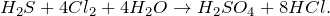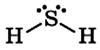- Сероводород
- Сероводород
- Строение молекулы и физические свойства
- Способы получения сероводорода
- Химические свойства сероводорода
- Сероводород H2S и сульфиды- химические свойства
- Сульфиды — получение и химический свойства
- H2S + H2O = ? уравнение реакции
- Пожалуйста, зарегистрируйтесь или войдите, чтобы добавить ответ.
- Сероводород (H2S)
- Химические свойства сероводорода
- Получение и применение сероводорода
- Сероводород: решение задач методом электронного баланса
- Уравнения окислительно-восстановительных реакций сероводорода
Сероводород
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Источник
Сероводород H2S и сульфиды- химические свойства
Физические свойства сероводорода:
Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде (в 1V H2O растворяется 3V H2S при н.у.); t°пл. = -86°C; t°кип. = -60°С.
Получение сероводорода:
1) Из простых веществ: H2 + S t° → H2S
2) Реакцией обмена: FeS + 2HCl→FeCl2 + H2S
Химические свойства сероводорода:
1) Раствор H2S в воде – слабая двухосновная кислота.
Сероводородная кислота образует два ряда солей — средние (сульфиды) и кислые (гидросульфиды).
2) Взаимодействует с основаниями:
3) Качественная реакция на сероводород и растворимые сульфиды — образование темно-коричневого (почти черного) осадка PbS:
4) H2S проявляет очень сильные восстановительные свойства:
5) Сероводород окисляется кислородом:
при недостатке O2
6) Серебро при контакте с сероводородом чернеет:
Сульфиды — получение и химический свойства
Получение сульфидов:
1) Многие сульфиды получают нагреванием металла с серой:
Hg + S → HgS (при комнатной температуре)
2) Растворимые сульфиды получают действием сероводорода на щелочи:
3) Нерастворимые сульфиды получают обменными реакциями:
Химические свойства сульфидов:
1) Растворимые сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют щелочную реакцию:
S 2- + H2O ↔ HS — + OH —
2) Нерастворимые сульфиды можно перевести в растворимое состояние действием концентрированной HNO3:
3) Водорастворимые сульфиды растворяют серу с образованием полисульфидов:
Полисульфиды при окислении превращаются в тиосульфаты, например:
Источник
H2S + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме H2S + H2O = ? Охарактеризуйте химическое соединение сероводород: укажите его основные физические и химические свойства, а также способы получения.
Сероводород в обычных условиях представляет собой бесцветный газ с характерным запахом гниющего белка. Он немного тяжелее воздуха и горит голубоватым пламенем, образуя диоксид серы и воду:
Сероводород легко воспламеняется; смесь его с воздухом взрывает. Очень ядовит. При 
Сероводород – сильный восстановитель. При действии сильных окислителей он окисляется до диоксида серы или до серной кислоты; глубина окисления зависит от условий: температуры, рН раствора, концентрации окислителя. Например, реакция с хлором обычно протекает до образования серной кислоты:
В лабораторных условиях для получения сероводорода наиболее часто используют следующие реакции:
— действие разбавленных растворов кислот на сульфиды
— взаимодействие сульфида алюминия с водой
Пожалуйста, зарегистрируйтесь или войдите, чтобы добавить ответ.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Источник
Сероводород (H2S)
Сера с водородом образует летучее соединение H2S — сероводород, являющийся ядовитым бесцветным газом с характерным весьма неприятным запахом, напоминающим запах тухлых яиц.
В природе сероводород выделяется в процессе гниения белковых веществ, а также содержится в воде некоторых минеральных источников.
Молекула сероводорода полярна, атом серы связан с двумя атомами водорода угловой связью. Сероводород в меньшей степени способен образовывать водородные связи, нежели вода, поэтому, при н.у. сероводород является газом, хорошо растворимым в воде (в 1 объеме воды растворяется 2,5 объема сероводорода).
Химические свойства сероводорода
Растворяясь в воде, сероводород образует слабую двухосновную кислоту, называемую сероводородной водой:
Реакции сероводородной воды:
- с основными оксидами образует соли-сульфиды:
- с основаниями образует сульфиды и гидросульфиды (при избытке H2S):
- с солями образует малорастворимые сульфиды:
- с металлами образует соли-сульфиды:
Растворимость в воде:
- гидросульфиды (кислые соли сероводородной кислоты) хорошо растворяются в воде (NaHS, Ca(HS)2);
- сульфиды щелочных и щелочноземельных металлов (нормальные соли), сульфид аммония (NH4)2S — растворимы в воде;
- сульфиды остальных металлов нерастворимы в воде;
- сульфиды меди, свинца, серебра, ртути, других тяжелых металлов нерастворимы ни в воде, ни в кислотах (за исключением азотной кислоты).
- PbS, CuS — черный цвет;
- CdS — желтый цвет;
- ZnS, MgS — белый цвет;
- MnS — розовый цвет.
Качественная реакция на сероводородную кислоту и ее соли (взаимодействие с растворимыми солями свинца с выделением сульфида свинца (II) в виде черного осадка):
В окислительно-восстановительных реакциях сероводород и его кислота выступают только в роли сильного восстановителя, что объясняется низшей возможной степенью окисления серы (-2).
- кислородом воздуха:
- бромной водой, которая обесцвечивается, теряя желто-оранжевый оттенок, при пропускании через нее сероводорода:
- марганцовкой — сероводород обесцвечивает раствор перманганата калия:
- более слабыми окислителями, например, солями железа и сернистой кислотой:
Получение и применение сероводорода
В промышленном производстве сероводород получают в процессе очистки нефтяных газов, как побочный продукт.
В лабораторных условиях сероводород получают реакцией кислот с сульфидами:
Сероводород можно получить из простых веществ:
В промышленных целях сероводород используется для получения сульфидов, сераорганических веществ, серной кислоты. В медицине сероводородная вода используется при лечении ревматизма и различных кожных заболеваний. Сероводород входит в состав многих минеральных вод.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Сероводород: решение задач методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры решения задач ОВР сероводорода (См. Свойства сероводорода).
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Уравнения окислительно-восстановительных реакций сероводорода
1. Уравнение реакции окисления сероводорода при недостатке кислорода с образованием серы и воды:
2. Уравнение реакции окисления сероводорода в избытке кислорода с образованием сернистого ангидрида и воды:
3. Уравнение реакции окисления железа в сероводородной среде с образованием сульфида железа и воды:
4. Уравнение реакции окисления серебра в сероводородной среде с образованием сульфида серебра и воды:
5. Уравнение реакции сероводорода с цинком с образованием сульфида цинка и газообразного водорода:
6. Уравнение реакции сероводорода с сернистым ангидридом с образованием серы и воды:
7. Уравнение реакции сероводорода с концентрированной серной кислотой:
8. Уравнение реакции сероводорода с концентрированной серной кислотой при высокой температуре:
9. Уравнение реакции сероводорода с оксидом железа:
Поскольку часть сульфид-ионов из молекул сероводорода окисляется до серы, а другая — переходит без изменения степени окисления в состав молекул сульфида железа, поэтому, в первую очередь уравнивают коэффициенты перед FeS и S, и только потом ставится коэффициент перед H2S.
10. Уравнение реакции сероводорода с дихроматом калия в кислой среде:
11. Уравнение реакции сероводорода с перманганатом калия:
12. Уравнение реакции сероводорода с хлоридом железа:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник