- Соли, растворимость и устойчивость
- Растворение соли в воде: химические или физические изменения? — 2021
- ÐÑÐµÐ¼Ñ Ð¸ СÑекло Так вÑпала ÐаÑÑа HD VKlipe Net
- Почему растворение соли будет химическим изменением
- Почему некоторые люди считают растворение соли физическим изменением
- Вольфрам или Вольфрам — химические и физические свойства
- Химические и физические изменения
- Растворение сахара в воде: химические или физические изменения?
- Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей
- Гидролиз солей
- Р. Фейнман об испарении воды и растворении соли
- 1. О процессах, происходящих на поверхности воды
- 2. О том, что происходит с водой при испарении
- 3. О растворении соли
Соли, растворимость и устойчивость
Соль можно определить как соединение, которое образуется в результате реакции между кислотой и основанием, но не является водой. В данном разделе будут рассмотрены те свойства солей, которые связаны с ионными равновесиями.
реакции солей в воде
Несколько позже будет показано, что растворимость—это относительное понятие. Однако для целей предстоящего обсуждения мы можем грубо подразделить все соли на растворимые и нерастворимые в воде.
Некоторые соли при растворении в воде образуют нейтральные растворы. Другие соли образуют кислые либо щелочные растворы. Это обусловлено протеканием обратимой реакции между ионами соли и водой, в результате которой образуются сопряженные кислоты либо основания. Окажется ли раствор соли нейтральным, кислым или щелочным-зависит от типа соли. В этом смысле существуют четыре типа солей.
Соли, образуемые сильными кислотами и слабыми основаниями. Соли этого типа при растворении в воде образуют кислый раствор. В качестве примера приведем хлорид аммония NH4Cl. При растворении этой соли в воде ион аммония действует как

Избыточное количество ионов H3O+, образуемое в этом процессе, обусловливает кислые свойства раствора.
Соли, образуемые слабой кислотой и сильным основанием. Соли этого типа при растворении в воде образуют щелочный раствор. В качестве примера приведем ацетат натрия CH3COONa1 Ацетат-ион действует как основание, акцептируя протон у воды, которая выступает в этом случае в роли кислоты:

Избыточное количество ионов ОН-, образующихся в этом процессе, обусловливает щелочные свойства раствора.
Соли, образуемые сильными кислотами и сильными основаниями. При растворении в воде солей этого типа образуется нейтральный раствор. В качестве примера приведем хлорид натрия NaCl. При растворении в воде эта соль полностью ионизируется, и, следовательно, концентрация ионов Na+ оказывается равной концентрации ионов Cl-. Поскольку ни тот, ни другой ион не вступает в кислотно-основные реакции с водой, в растворе не происходит образования избыточного количества ионов H3O+ либо ОН . Поэтому раствор оказывается нейтральным.
Соли, образуемые слабыми кислотами и слабыми основаниями. Примером солей такого типа является ацетат аммония. При растворении в воде ион аммония реагирует с водой как кислота, а ацетат-ион реагирует с водой как основание. Обе эти реакции описаны выше. Водный раствор соли, образованной слабой кислотой и слабым основанием, может быть слабокислым, слабощелочным либо нейтральным в зависимости от относительных концентраций ионов H3O+ и ОН-, образуемых в результате реакций катионов и анионов соли с водой. Это зависит от соотношения между значениями констант диссоциации катиона и аниона.
Источник
Растворение соли в воде: химические или физические изменения? — 2021
ÐÑÐµÐ¼Ñ Ð¸ СÑекло Так вÑпала ÐаÑÑа HD VKlipe Net
Когда вы растворяете столовую соль (хлорид натрия, также известный как NaCl) в воде, вы производите химическое изменение или физическое изменение? Физическое изменение приводит к изменению внешнего вида материала, но никаких новых химических продуктов не возникает. Химическое изменение включает в себя химическую реакцию с появлением новых веществ в результате изменения.
Почему растворение соли будет химическим изменением
При растворении соли в воде хлорид натрия диссоциирует в Na + ионы и Cl — ионы, которые можно записать в виде химического уравнения:
NaCl (s) → Na + (aq) + Cl — (Водно)
Следовательно, растворение соли в воде является примером химического изменения. Реагент (хлорид натрия или NaCl) отличается от продуктов (катион натрия и анион хлора). Таким образом, любое ионное соединение, которое растворимо в воде, подвергнется химическому изменению. Напротив, растворение ковалентного соединения, такого как сахар, не приводит к химической реакции. Когда сахар растворяется, молекулы рассеиваются по воде, но они не меняют свою химическую идентичность.
Почему некоторые люди считают растворение соли физическим изменением
Если вы будете искать в Интернете ответ на этот вопрос, вы увидите примерно одинаковое количество ответов, в которых утверждается, что растворение соли — это физическое изменение, а не химическое изменение. Путаница возникает из-за того, что один общий тест, помогающий отличить химические и физические изменения, заключается в том, можно ли восстановить исходный материал в результате изменений, используя только физические процессы. Если вы выпарите воду из солевого раствора, вы получите соль.
Итак, вы прочитали обоснование. Как вы думаете? Согласитесь ли вы, что растворение соли в воде — это химическое изменение?
Вольфрам или Вольфрам — химические и физические свойства
Получите таблицу фактических данных о химических и физических свойствах элемента вольфрама или вольфрама.
Химические и физические изменения
Химические и физические изменения относятся к свойствам вещества. Узнайте, что это за изменения, приведите примеры и научитесь отличать их друг от друга.
Растворение сахара в воде: химические или физические изменения?
Является ли растворение сахара в воде примером химических или физических изменений? Вот ответ и объяснение процесса.
Источник
Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей



Гидролиз солей
Правило направления протекания ионных реакций: реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Гидролизу подвергаются соли образованные:
— слабым основанием и сильной кислотой (например, MgCl2, CuSO4), и гидролиз идет по катиону, т.к. молекулы слабого электролита образуются за счет катионов;
— слабой кислотой и сильным основанием (например, Na2CO3, K2S, CH3COONa), и гидролиз идет по аниону, т.к. молекулы слабого электролита образуются за счет анионов;
— слабым основанием и слабой кислотой (например, NH4CN, CH3COONH4), и гидролиз идет по аниону и катиону, т.к. молекулы слабого электролита образуются за счет анионов и катионов.
Соли, образованные сильным основанием и сильной кислотой (например, NaCl, Na2SO4, KNO3) гидролизу не подвергаются , т.к. в этом случае не образуются молекулы слабого электролита.
Уравнения реакций гидролиза пишутся аналогично другим ионным уравнениям: малодиссициированные (в том числе вода) и малорастворимые, а также газообразные продукты гидролиз и исходные вещества пишутся в виде молекул, сильные электролиты записываются в ионной форме. Краткое ионное уравнение показывает какие ионы (Н + или ОН – ) накапливаются в растворе данной соли при растворении, что позволяет определить реакционную среду рассматриваемой соли.
Так, если в кратком ионном уравнении имеются ионы Н + , то реакция среды раствора этой соли кислая, а гидролиз будет идти по катиону. Если в кратком ионном уравнении имеются ОН – , то реакция среды раствора этой соли щелочная, а гидролиз будет идти по аниону. Если же краткое ионное уравнение показывает, что в растворе присутствуют и ионы Н + и ОН – , то реакция среды нейтральная, а гидролиз будет идти и по и аниону и по катиону.
Пример. Составить уравнение гидролиза ацетата натрия СН3СООNа (соль сильного основания и слабой кислоты) и определить реакцию среды в растворе этой соли.
– запишем уравнение реакции гидролиза в молекулярной форме:
СН3СООNа + Н2О 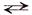
(образовался слабый электролит – уксусная кислота)
– составим полное ионное уравнение данной реакции:
СН3СОО – + Nа + + Н2О 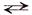
– составим краткое ионное уравнение данной реакции:
СН3СОО – + Н2О 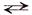
Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы ОН – и реакция среды будет щелочной (рН > 7).
Пример. Составить уравнение гидролиза хлорида железа (II) – соли слабого основания и сильной кислоты, определить реакцию среды в растворе этой соли.
FеСl2 + Н2O 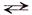
Fе 2+ + 2Сl – + Н2O 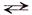
Fе 2+ + Н2O 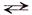
По второй ступени гидролиз протекает следующим образом:
Fе(ОН)Сl + Н2O 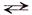
Fе(ОН) – + Сl – + Н2O 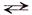
Fе(ОН) – + Н2O 
Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы Н + и реакция среды будет кислой (рН 7;
— если соль образована слабым основанием и сильной кислотой, то рН – и кислотного остатка, например, FеОНСl2 – гидроксохлорид железа III);
— при гидролизе солей, образованных слабой многоосновной кислотой и сильным основанием, образуются кислые соли (содержащие анионы кислотного остатка, катионы металла и Н + , например, КНСО3 – гидрокарбонат калия).
Гидролиз по второй и, особенно, по третьей ступени выражен незначительно.
Пример. Составить уравнения гидролиза и определить реакцию среды в растворе хлорида железа (III).

Реакция гидролиза FеСl3 проходит в три стадии, так как заряд иона железа равен 3+:
1) составим молекулярное, полное и краткое ионное уравнение первой ступени гидролиза:
— молекулярное уравнение: FеСl3 + НОН ↔ FеОНСl2 + НСl
— полное ионное уравнение: Fе 3+ + 3Cl – + НОН ↔ (FеОН) 2+ + 2Сl – + H + + Сl –
— краткое ионное уравнение: Fе 3+ + НОН ↔ (FеОН) 2+ + H +
2) составим молекулярное, полное и краткое ионное уравнение второй ступени гидролиза:
— FеОН 2+ + 2Сl – + НОН ↔ (Fе(ОН)2) + + Сl – + H + + Сl –
— FеОН 2+ + НОН ↔ (Fе(ОН)2) + + H +
3) составим молекулярное, полное и краткое ионное уравнение третьей ступени гидролиза:
— Fе(ОН)2 + + Сl – + НОН ↔ Fе(ОН)3↓ + H + + Сl –
4) общее уравнение реакции гидролиза в молекулярной полной и краткой ионной форме имеет вид:
— Fе 3+ + 3Сl – + 3НОН ↔ Fе(ОН)3↓ + 3H + + 3Сl –
— Fе 3+ + 3НОН ↔ Fе(ОН)3↓ + 3H +
Таким образом, гидролиз соли, образованной слабым трехкислотным основанием и сильной кислотой идет по катиону в три стадии, а накопление ионов H + приводит к тому, что рН – + HOH → OH – + HCN
Концентрация недиссоциированных молекул воды постоянна, тогда
Так как [H + ][ОН – ] = Кводы, то [ОН – ] = Кводы / [H + ], и преобразуя константу гидролиза получим:
Аналогично, константа гидролиза соли слабого основания и сильной кислоты выражается соотношением ионного произведения воды и константы диссоциации соответствующего основания: КГ = Кводы / Коснования
Источник
Р. Фейнман об испарении воды и растворении соли
Продолжаем изучать лекции Р. Фейнмана. О том, как они появились и о том, как Фейнман объяснял студентам строение тел вы можете прочитать здесь >>>
Сегодня вместе с Фейнманом поговорим об атомных процессах.
1. О процессах, происходящих на поверхности воды
Что здесь происходит? Мы усложним себе задачу, приблизим ее к реальной действительности, предположив, что над поверхностью находится воздух. Взгляните на рис. 1.5.
Мы по-прежнему видим молекулы, образующие толщу воды, но, кроме того, здесь изображена и ее поверхность, а над нею — различные молекулы: прежде всего молекулы воды в виде водяного пара, который всегда возникает над водной поверхностью (пар и вода находятся в равновесии, о чем мы вскоре будем говорить). Кроме того, над водой витают и другие молекулы — то скрепленные воедино два атома кислорода, образующие молекулу кислорода, то два атома азота, тоже слипшиеся в молекулу азота. Воздух почти весь состоит из азота, кислорода, водяного пара и меньших количеств углекислого газа, аргона и прочих примесей.
Итак, над поверхностью воды находится воздух — газ, содержащий некоторое количество водяного пара. Что происходит на этом рисунке? Молекулы воды все время движутся. Время от времени какая-нибудь из молекул близ поверхности получает толчок сильнее остальных и выскакивает вверх. На рисунке этого, конечно, не видно, потому что здесь все неподвижно. Но попробуйте просто представить себе, как одна из молекул только что испытала удар и взлетает вверх, а с другой случилось то же самое и т. д. Так, молекула за молекулой вода исчезает — она испаряется. Если закрыть сосуд, мы обнаружим среди молекул находящегося в нем воздуха множество молекул воды. То и дело некоторые из них снова попадают в воду и остаются там. То, что казалось нам мертвым и неинтересным (скажем, прикрытый чем-нибудь стакан воды, который, может быть, 20 лет простоял на своем месте), на самом деле таит в себе сложный и интересный, беспрерывно идущий динамический процесс. Для нашего грубого глаза в нем ничего не происходит, но стань мы в миллиард раз зорче, мы бы увидали, как все меняется: одни молекулы взлетают, другие оседают.
Почему же мы не видим этих изменении? Да потому, что сколько взлетает молекул, столько же и оседает! В общем-то там «ничего не происходит». если раскрыть стакан и сдуть влажный воздух, на смену ему притечет уже сухой; число молекул, покидающих воду, останется прежним (оно ведь зависит только от движения в воде), а число возвращающихся молекул сильно уменьшится, потому что их уже над водой почти не будет. Число улетающих молекул превысит число оседающих, вода начнет испаряться. Поэтому, если вам нужно испарять воду, включайте вентилятор!
2. О том, что происходит с водой при испарении
Давайте подумаем, какие молекулы вылетают из воды? Если уж молекула выскочила, то это значит, что она случайно вобрала в себя излишек энергии; он ей понадобился, чтобы разорвать путы притяжения соседей. Энергия вылетающих молекул превосходит среднюю энергию молекул в воде, поэтому энергия остающихся молекул ниже той, которая была до испарения. Движение их уменьшается. Вода от испарения постепенно остывает. Конечно, когда молекула пара опять оказывается у поверхности воды, она испытывает сильное притяжение и может снова попасть в воду. Притяжение разгоняет ее, и в итоге возникает тепло. Итак, уходя, молекулы уносят тепло; возвращаясь — приносят. Когда стакан закрыт, баланс сходится, температура воды не меняется. Если же дуть на воду, чтобы испарение превысило оседание молекул, то вода охлаждается. Поэтому, чтобы остудить суп, дуйте на него!
3. О растворении соли
Перейдем теперь к другому процессу. На рис. 1.6 мы видим, как (с атомной точки зрения) соль растворяется в воде.
Источник









