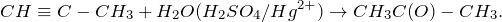- Пропилен (пропен), получение, свойства, химические реакции
- Пропилен (пропен), получение, свойства, химические реакции.
- Пропилен (пропен), формула, газ, характеристики:
- Физические свойства пропилена (пропена):
- Химические свойства пропилена (пропена):
- Получение пропилена (пропена). Химические реакции – уравнения получения пропилена (пропена):
- Применение и использование пропилена (пропена):
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- пропин + H2O = ? уравнение реакции
- Химические свойства алкинов
- Химические свойства алкинов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкинов
- 1.3. Гидрогалогенирование алкинов
- 1.4. Гидратация алкинов
- 1.5. Димеризация, тримеризация и полимеризация
- 2. Окисление алкинов
- 2.1. Горение алкинов
- 2.2. Окисление алкинов сильными окислителями
- 3. Кислотные свойства алкинов
Пропилен (пропен), получение, свойства, химические реакции
Пропилен (пропен), получение, свойства, химические реакции.
Пропилен (пропен), C3H6 – органическое вещество класса алкенов. Пропилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Пропилен (пропен), формула, газ, характеристики:
Пропилен (пропен) – органическое вещество класса алкенов, состоящий из трех атомов углерода и шести атомов водорода . Пропилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула пропилена C3H6, рациональная формула H2CCHCH3, структурная формула CH2=CH-CH3. Изомеров не имеет.
Пропилен – бесцветный газ, без вкуса, со слабым запахом.
Пожаро- и взрывоопасен.
Плохо растворяется в воде . Зато хорошо растворяется в углеводородах.
Пропилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007, но оказывает вредное воздействие на человека более сильным, чем этилен (этен).
Физические свойства пропилена (пропена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,184 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,9149 |
| Температура плавления, °C | -185,25 |
| Температура кипения, °C | -47,6 |
| Температура вспышки, °C | 107,8 |
| Температура самовоспламенения, °C | 410 |
| Критическая температура*, °C | 91,4 |
| Критическое давление, МПа | 4,6 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,3 до 11,1 |
| Удельная теплота сгорания, МДж/кг | 45,694 |
| Молярная масса, г/моль | 42,08 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства пропилена (пропена):
Пропилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства пропилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое гидрирование (восстановление) пропилена:
В результате данной химической реакции образуется пропан.
- 2. галогенирование пропилена:
- 3. гидрогалогенирование пропилена:
Водород кислоты HBr присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Br связывается с атомом углерода, при котором находится меньшее число атомов водорода.
- 4. гидратация пропилена:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется изопропанол (изопропиловый спирт).
- 5. горение пропилена:
В результате горения пропилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода.
- 6. полимеризация пропилена:
В результате образуется полипропилен.
Получение пропилена (пропена). Химические реакции – уравнения получения пропилена (пропена):
Пропилен получают как в лабораторных условиях, так и в промышленных масштабах.
Обычно пропилен получают при пиролизе углеводородного сырья и каталитическом крекинге нефтяных фракций.
В промышленных масштабах пропилен получают, например, в результате следующей химической реакции:
Пропилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. дегидратация изопропилового спирта:
- 2. дегалогенирования дигалогенпроизводных пропана:
- 3. неполное гидрирование пропина:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Применение и использование пропилена (пропена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: оксида пропилена, изопропилового спирта, ацетона, альдегидов, акриловой кислоты, акрилонитрила, полипропилена,
– в производстве полимеров , пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить пропилен реакция ацетилен пропен 1 2 вещество пропилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение пропилена
напишите уравнение реакций пропилен
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 483)
- Экономика Второй индустриализации России (102 475)
- Программа искусственного интеллекта ЭЛИС (27 490)
- Метан, получение, свойства, химические реакции (23 728)
- Этилен (этен), получение, свойства, химические реакции (22 792)
- Природный газ, свойства, химический состав, добыча и применение (21 164)
- Крахмал, свойства, получение и применение (20 570)
- Целлюлоза, свойства, получение и применение (19 414)
- Пропилен (пропен), получение, свойства, химические реакции (19 086)
- Прямоугольный треугольник, свойства, признаки и формулы (18 725)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
пропин + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме пропин + H2O = ? Укажите тип реакции. Охарактеризуйте класс органических соединений алкины: приведите основные типы химических взаимодействий, а также способы получения.
Реакция взаимодействия пропина с водой (пропин + H2O = ?) носит название гидратации. Это одна из важнейших реакций алкинов (непредельные углеводороды с одной тройной связью), в результате которой получаются карбонильные соединения. Реакция гидратациии алкинов была открыта русским химиком М.Г. Кучеровым (1881) и носит его имя.
Гидратация алкинов протекает в присутствии катализаторов – серной кислоты и сульфата ртути (II) 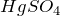
Отличительной чертой алифатических ненасыщенных соединений, содержащий гидроксильную группу при двойной связи, является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды и кетоны). При гидратации пропина образуется ацетон (диметилкетон):
Ацетон – бесцветная жидкость с характерным запахом. Вероятно, у многих из вас найдется в доме этот незаменимый растворитель лаков и красок. Ацетон смешивается с водой в любых отношениях. Он хорошо растворяет многие вещества, поэтому является незаменимым растворителем в быту и в лакокрасочной промышленности. Он также широко используется в производстве полимерных материалов и взрывчатых веществ. Ацетон встречается и в организме человека. Он является промежуточным продуктом обмена веществ.
Качественной реакцией на ацетон является образование иодоформа – желтого вещества с характерным запахом, образующегося при нагревании ацетона с иодом в присутствии щелочей.
Источник
Химические свойства алкинов
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С ≡ С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С – С | 348 | 0,154 |
| С ≡ С | 814 | 0,120 |
| С – Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
| Например, уравнение сгорания пропина: |
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C ≡ | R-COOH | -COOMe |
| CH ≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C ≡ , поэтому образуется соль уксусной кислоты – ацетат калия |
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp 2 | sp 3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н + , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C ≡ C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Источник